纳氏试剂配制方法改进研究
王晓颖


摘 要:该文讨论了利用已有原料K2[HgI4]以及超纯水,同时视实际情况决定是否额外添加HgCl2的方法配制纳氏试剂。通过空白实验、标准曲线、检出限、精密度等实验和数据得知,与传统的文献方法相比,改进方法配制速度快,所配纳氏试剂空白值和检出限较低,灵敏度高,准确度及精密度都较好,适合生产型企业大批量生产。
关键词:纳氏试剂;超纯水;氨氮
中图分类号:R123.1 文献标志码:A
0 引言
工农业的快速发展往往伴随着对自然环境的破坏。近年来,国家大力提倡“绿水青山就是金山银山”的理念,使得对土壤和水质的监测达到前所未有的重视。由于氮肥的广泛使用,土壤中总氮含量的监控是必不可少的;提倡节能减排的同时,水和废水中氨氮的监测更加重要。纳氏试剂分光光度法是总氮和氨氮含量检测的经典方法。在某公司的试剂销售中,纳氏试剂的销售额占有一定比重,并且每年都呈递增趋势增长,这就要求寻找到一种既能保证纳氏试剂的质量,又能提高生产效率的配制方法。该文阐述了直接以市售K2[HgI4]为主要原料,以超纯水代替去离子水制备纳氏试剂的过程,并与《水和废水监测分析方法》(第四版)[1]中介绍的以KI、HgCl2和KOH制备的方法进行对比得知,新方法也有较好的灵敏度,较低的空白值,且应用于工业生产时能使生产效率得到大幅提高。
1 实验部分
1.1 实验原理
HgCl2与KI反应生成朱红色的HgI2不溶物,当KI过量时,则继续反应生成淡黄色的可溶性络合物纳氏试剂,化学式为K2[HgI4]。反应式[2]如下:
HgCl2+2KI= HgI2↓+2KCl
过量2KI
K2[HgI4](淡黄色)
纳氏试剂之所以能够显色,是由于[HgI4]2-在碱性条件下可与游离态的氨或化合态的铵盐反应生成黄色至红棕色的络合物NH2Hg2OI,其色度与氨氮含量成正比[3]。反应过程为:
NH4++4OH-+2[HgI4]2-?NH2Hg2OI↓+7I-+3H2O
配制过程中要控制好HgCl2的量,因为只有KI过量时才会生成K2[HgI4],如果KI的量不足,Hg2-会与[HgI4]2-解离出来的I-生成HgI2[4],导致试剂显色不够灵敏;但是如果KI的量过多,由于I-的过量存在也会降低显色反应灵敏度。所以配制时需使HgCl2稍稍过量,待生成的HgI2全部沉降后取上层清液使用即可。
1.2 仪器与试剂
1.2.1 仪器
紫外-可见分光光度计,UV-1800,岛津企业管理(中国)有限公司。
分析天平,MS104S,梅特勒-托利多国际贸易(上海)有限公司。
1.2.2 试剂
实验使用的KI、HgCl2、KOH、K2[HgI4]、超纯水,酒石酸钾钠溶液(1.5M)均为上海麦克林生化科技有限公司生產;氨氮标准溶液(1 000 μg/ mL)由国标(北京)检验认证有限公司提供;氨氮标准物质由北京坛墨质检科技有限公司提供。
纳氏试剂的配置方法如下。1) 称取15 g KOH溶于50 mL超纯水中,冰浴冷却至室温;取7.08g K2[HgI4]于20 mL超纯水中,超声助溶,如果能够溶解完全,再向内逐滴滴加HgCl2饱和溶液,直至有少许朱红色沉淀产生;如果超声片刻后溶液中仍有朱红色不溶物,则无需滴加HgCl2。将制好的K2[HgI4]溶液缓慢倒入KOH溶液中,然后将此混合液移入100 mL聚乙烯容量瓶中,以超纯水定容至刻度线,于暗处静置24 h后取上层清液待用。2) 按照文献[1]方法配制,称取15 g KOH溶于50 mL去离子水中,冷却至室温。取5 g KI溶于10 mL去离子水中,再将2.5 g HgCl2加入其中搅拌溶解,此溶解过程较为缓慢,约4 h左右,溶解后改为滴加HgCl2饱和溶液至出现朱红色沉淀,将KOH溶液与此溶液混溶后静置,取上清液待用。
氨氮标准使用液(10 μg/ mL):准确移取10 mL氨氮标准溶液于1 000 mL容量瓶中,以去离子水定容至刻度线待用。
1.3 实验方法
在2组50 mL比色管中加入适量待测液,以去离子水稀释至刻度线,加入1 mL酒石酸钾钠溶液,再分别加入2种方法配制的纳氏试剂1.5 mL,充分混合,此时溶液的pH在12.0左右,显色10 min后,使用分光光度计在420 nm处,以10 mm光程的比色皿,去离子水水为参比,测定溶液吸光度。
标准曲线制作:准确移取0.0 mL、0.5 mL、1.0 mL、2.0 mL、4.0 mL、6.0 mL、10.0 mL氨氮标准使用液于50 mL比色管中,以去离子水稀释至刻度线,按照上述实验方法测定吸光度,以氨氮浓度(mg/L)为横坐标,以空白校正后的吸光度为纵坐标分别绘制2种方法的标准曲线。
2 结果与讨论
2.1 空白实验
分别用2种方法配制的纳氏试剂按照实验方法进行空白实验。每天每个方法测2个空白,连续测定5 d,每种方法得到10个数据,见表1。
由表1数据可知,在5 d内,2种方法配制的纳氏试剂的空白吸光度都较为稳定,但改进方法的吸光度值更低一些。这是由于文献方法使用的去离子水或经去离子水处理而成的无氨水,是将水经离子交换去除其中可电离的阴阳离子的水,水中可溶性的高分子物、热源和细菌等未电离物是不能经离子交换去除的,而超纯水中几乎无杂质,也无热源、细菌等,可使得配制的纳氏试剂空白值更低,这对于准确测定低浓度的水样是有帮助的。经验表明,配好的纳氏试剂应保存在2℃~8℃条件下,以保证一个月内空白值无较大变化。
2.2 标准曲线
用2种方法配制的纳氏试剂绘制标准曲线,结果如图1和图2所示。
改进方法配制纳氏试剂绘制曲线的回归方程为A=0.1658C-0.0038,线性相关系数为0.9996;文献方法配制纳氏试剂绘制曲线的回归方程为A=0.1639C-0.0013,线性相关系数为0.9996。可知,改进方法斜率K更高一些,灵敏度也更高。
2.3 检出限
取建立标准曲线所配制的0浓度的溶液,重复检测其吸光度10次,测得改进方法标准偏差S1为0.00127,检出限L1=3S1/K1=0.023 mg/L;文献方法标准偏差S2为0.00168,检出限L2=3S2/K2=0.031 mg/L。
2.4 精密度和准确度
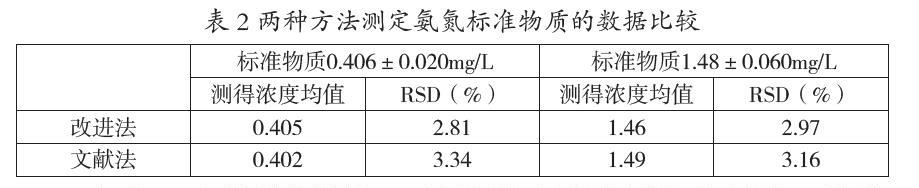
采用2种方法对2个不同浓度的氨氮标准物质进行检测,每个样品平行测定6次,得到浓度平均值和相对标准偏差见表2。
由表2中的数据得知,无论是改进法还是文献法,其准确度都在允许的误差范围内,但改进法2组数据的RSD值均比文献法的RSD值低,说明改进法的精密度要好一些。
3 结论
直接使用原料K2[HgI4]、KOH和超纯水,并视溶解情况添加HgCl2的方法配制的纳氏试剂,与KI、HgCl2、KOH和去离子水配制的纳氏试剂相比,具有低的检出限,高的灵敏度以及良好的精密度,且由于省去了K2[HgI4]的生成过程,使得配制时间大大缩短,可以有效提高企业的生产效率。
参考文献
[1]水和废水监测分析方法编委会.水和废水监测分析方法[M].北京:中国环境科学出版社,2002:279-281.
[2]张瑶霞.纳氏试剂配制中新技术应用的探讨[J].能源与节能,2012(1):57-58.
[3]孙永秀.用纳氏试剂测定氨氮影响因素及解决办法[J].山西建筑,2010,36(3):197-198.
[4]王雅心.纳氏试剂配制方法的探索[J].中国环境监测,1990,6(5):63-64.

