慢性阻塞性肺疾病加重期患者继发静脉血栓栓塞症与甲状腺激素水平的相关性研究
韩京旭 赵雪锋 刘姣姣 底胜峰
慢性阻塞性肺疾病(COPD)是由多种原因导致气道和肺泡异常,出现以持续性气流受限为特征的慢性肺部疾病。一项流行病学调查显示,我国40岁以上的成年人发病率为13.6%,且呈逐年升高趋势,预计至2020年COPD的死亡率将上升至全球慢病死亡率原因的第3位[1]。COPD急性加重期(AECOPD)是患者在受到环境污染或冷空气刺激后短期内出现病情持续恶化的过程,是COPD患者急诊住院和死亡的重要原因。多项国内外研究显示,AECOPD 患者因机体二氧化碳潴留和缺氧常处于高凝状态,极易发生静脉血栓栓塞症(VTE),而一旦患者合并VTE,死亡风险将成倍增加[2-3]。临床实践中,由于AECOPD合并或不合并VTE患者临床表现类似,鉴别诊断十分困难,因而具有较高的漏诊率。一项纳入882例AECOPD 患者的研究发现,8%的AECOPD的患者肺栓塞(PTE)诊断延迟超过3天,导致此部分患者也具有更差的预后结果,故对AECOPD患者VTE的早期筛查至关重要[4]。
目前关于AECOPD继发VTE的相关机制仍不明确,其发生可能受多种因素的影响。近来有研究发现甲状腺激素与AECOPD患者的预后相关[5]。甲状腺激素在调节糖脂代谢中具有重要作用,低甲状腺激素水平将对呼吸造成影响,主要表现为呼吸肌功能下降,呼气功能障碍。既往多项研究发现血栓性疾病如急性心肌梗死、急性肠系膜上动脉栓塞患者机体甲状腺激素水平存在异常降低,而经过溶栓治疗后甲状腺激素水平可有明显回升[6-7]。甚至有学者将甲状腺激素用于评估急性心肌梗死患者预后[8]。因此,AECOPD患者合并VTE患者是否存在甲状腺激素水平异常变化呢?此类患者血清甲状腺激素水平与凝血功能指标的是否存在相关性尚未有研究。基于上述背景,本研究拟选取2017年1月至2019年6月在我院呼吸科住院诊治的AECOPD患者进行甲状腺激素和凝血功能检测,旨在探讨AECOPD继发VTE患者血清甲状腺激素与凝血功能指标的相关性,及其在VTE早期诊断的潜在价值。
资料与方法
一、纳入及排除标准
纳入标准:①AECOPD诊断明确,临床症状和体征均符合中华医学会呼吸病学分会制定的COPD急性发作期相关诊断标准(2013年修订版)[9];②年龄>60岁;③具备相关治疗适应症,且病例资料完整;④获得患者直系亲属或本人知情同意。排除标准:①合并有原发甲状腺疾病或近3个月内口服影响甲状腺激素水平的药物如糖皮质激素、胺碘酮等;②合并有脂肪或空气等非血栓栓塞患者;③合并有糖尿病、恶性肿瘤、严重肝肾功能不全、血液或免疫系统疾病者;④合并有认知功能障碍或治疗依从性差者。
二、一般资料与分组
根据纳入及排除标准,选取2017年1月至2019年6月在我院呼吸科住院诊治的AECOPD患者166例,男108例(65.06%),女58例(34.94%),年龄60~92岁,平均(75.1±12.6)岁。所有患者入院后均常规行双下肢血管彩超检查,高度怀疑合并PTE患者进一步行胸部计算机断层摄影肺血管造影(CTPA)。根据患者是否发生VTE分为VTE组和非VTE组。VTE诊断标准符合2018年中华医学会呼吸病学分会制定的肺血栓栓塞症诊治与预防指南[10]。其诊断包括深静脉血栓形成(DVT)和PTE。
三、研究方法及观察指标
① 患者入院后即由家属或本人填写我科自编问卷建立基本档案,包括患者基本人口学资料(如年龄、性别、工作、联系方式),既往史(既往基础疾病史、吸烟饮酒史、用药史),和病例资料。②入院第2天即留取患者空腹外周静脉血进行实验室指标检测,记录血常规包括白细胞计数(WBC)、血红蛋白(HB)和血小板计数(PLT);C-反应蛋白(CRP);血沉(ESR);血气分析包括血氧分压(PaO2)和动脉血二氧化碳分压(PaCO2);凝血功能包括活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、凝血酶原时间(PT);血浆粘度(PV);D-二聚体(D-D)。并采用电化学发光法测定血清甲状腺激素水平,包括促甲状腺激素(TSH)、总三碘甲状腺原氨酸(TT3)、游离三碘甲状腺原氨酸(FT3)、总甲状腺素(TT4)和游离甲状腺素(FT4)。
四、统计学处理

结 果
一、两组患者基线资料比较
VTE组共纳入患者71例,其中男44例(61.97%),女27例(38.03%);COPD病程9~30年,平均(10.6±2.6)年;合并高血压疾病19例(26.76%),冠心病11例(15.49%);43例(60.6%)患者有5年以上吸烟史。32例(45.07%)患者合并PTE,21例(29.58%)合并有DVT,18例(25.35%)同时合并PTE和DVT。非VTE组共纳入患者95例,其中男64例(67.37%),女31例(32.63%);COPD病程6~28年,平均(9.5±3.0)年;合并高血压疾病28例(29.47%),冠心病19例(20%);52例(54.7%)患者合并有5年以上吸烟史。经统计学比较,两组患者在性别、年龄、病程、WBC、HB、ESR等基线情况均无明显区别(P>0.05);VTE组PLT、CRP和PaCO2明显高于非VTE组,PaO2明显低于非VTE组,差异均具有统计学意义(P<0.05)(见表1)。
二、两组患者血凝及血黏度指标比较
VTE组血D-D、FIB和PV水平均明显高于非VTE组,差异均具有统计学意义(P<0.05);而两组APTT、PT比较差异均无统计学意义(P>0.05)(见表2)。
三、两组患者血清甲状腺激素水平比较
VTE组血清TT3、FT3和TSH水平均明显低于非VTE组(P<0.001),两组血清TT4和FT4水平比较差异无统计学意义(P>0.05)(见表3)。
四、血清甲状腺激素与血凝、血黏度指标的相关性
血清TT3均与D-D、FIB和PV呈负相关(P<0.001);TT4与FIB呈负相关(P<0.001),与D-D和PV无明显相关性(P>0.05);FT3均与D-D、FIB和PV呈负相关(P<0.001);FT4与FIB呈负相关(P<0.05),与D-D和PV无明显相关性(P>0.05);TSH均与D-D、FIB和PV呈负相关(P<0.05)(见表4)。
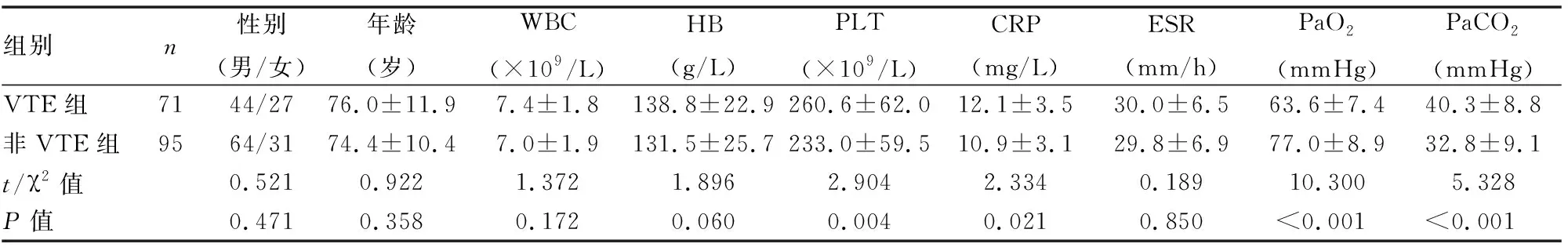
表1 两组患者一般临床及实验室资料比较
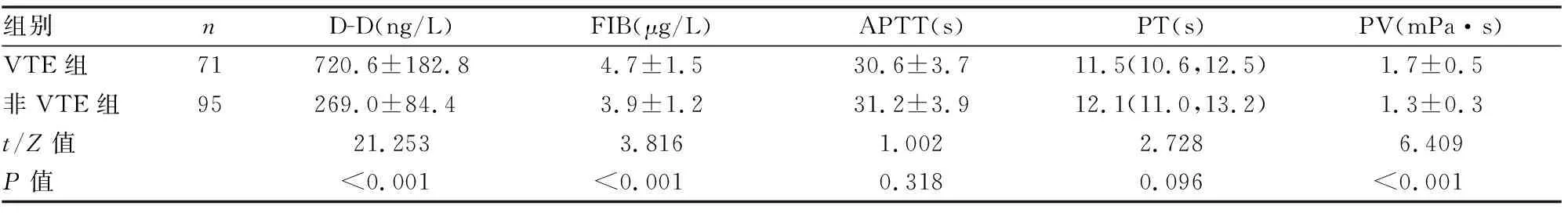
表2 两组患者血凝及血黏度指标比较

表3 两组患者血清甲状腺激素水平比较

表4 血清甲状腺激素与血凝、血黏度指标的相关性
五、血清甲状腺激素在预测AECOPD患者继发VTE的ROC曲线
TT3、TT4、FT3、FT4和TSH在预测AECOPD患者继发VTE的曲线下面积(AUC)分别为0.842(P<0.001,95%CI:0.803~0.920)、0.623(P=0.012,95%CI:0.530~0.715)、0.785(P<0.001,95%CI:0.711~0.859)、0.581(P=0.100,95%CI:0.486~0.675)和0.725(P=0.012,95%CI:0.642~0.809)。TT3对静脉血栓栓塞症的诊断价值最高,取ROC曲线约登指数最大值为最佳诊断点,当TT3取0.61 nmol/L时为判断AECOPD患者继发VTE的最佳截断点(见图1)。

图1 血清甲状腺激素在预测AECOPD继发VTE的ROC曲线
讨 论
既往研究认为,AECOPD是发生VTE的重要危险因素之一,此类患者心肺功能下降、活动量减少,血液常处于高凝状态,常易形成细小动脉原位栓塞[11]。本研究比较了AECOPD和AECOPD继发VTE患者一般实验室指标,结果发现VTE组PLT、CRP和PaCO2明显高于非VTE组,PaO2明显低于非VTE组,差异均具有统计学意义。表明AECOPD继发VTE患者存在更为严重的炎症反应和缺氧刺激,可能增加肺功能进一步降低的风险。这与既往相关研究结果相似,有学者认为CRP作为炎症反应的非特异性敏感指标,能够用于检测AECOPD的严重程度[12]。白久武[13]等研究也发现AECOPD继发VTE患者CRP浓度较非VTE组明显升高,表明AECOPD合并血栓性疾病存在更严重的炎症反应。炎症反应的增加能够进一步导致内皮细胞损伤,激发凝血功能机制。除炎症反应外,AECOPD患者继发VTE的主要机制还包括低氧血症氧化应激增强和血栓前状态等[2-3,14]。其中血栓前状态可能为主导机制,该机制主要与血氧功能指标和凝血功能指标异常有关。此类患者在受到缺氧、炎症反应和高碳酸血症的交叉重合的网状机制,将共同刺激血液中促红细胞生成素的生成而导致血液黏滞性上升,流动性降低和细胞结氧能力下降。另有学者提出,COPD可能不仅仅是累及气道和肺部的单独疾病,也可导致全身不同系统的受累,如此类患者往往存在不同程度的甲状腺激素水平异常[5,15]。尽管近年来关于AECOPD和甲状腺激素的研究逐渐增多,但目前尚未有研究关注AECOPD继发VTE患者中甲状腺激素水平的变化规律及潜在价值。
临床研究发现,COPD 患者常合并有不同程度的血清甲状腺激素水平异常,可表现出亚临床甲减或非甲状腺疾病综合征(NTIS)。其中NTIS定义为在一些非甲状腺相关疾病种,由于应激、创伤等多种原因引起的血清甲状腺激素的变化,其中以低T3综合征最为多见[16]。而在AECOPD患者中,有学者研究指出与COPD患者相比,AECOPD患者NTIS发病率更高,可达到40%以上[17]。与上述研究结果类似,本研究也发现AECOPD患者存在一定程度的血清TT3、FT3和TSH 水平降低,但进一步与合并VTE患者比较发现,合并VTE患者存在更低水平的TT3、FT3和TSH,差异均具有统计学意义,提示此类患者丘脑-垂体-甲状腺轴受到更高程度的抑制,TT3、FT3和TSH可能在判断AECOPD是否继发VTE方面具有一定价值。笔者分析认为AECOPD继发VTE患者甲状腺功能进一步受到抑制的主要原因如下:①首先前文已发现VTE组患者炎症指标升高的更加明显,这种炎症反应状态能够抑制TSH、甲状腺激素结合蛋白的释放。同时碘化甲腺氨酸脱碘酶-1的合成和活性也会受到不同程度的影响,进而抑制TT4向TT3的转化过程,血清TT3浓度进一步降低[12]。既往也有学者观察到VTE患者血清中IL-38、IL-10及TNF-α等多种炎性因子水平改变,进一步导致甲状腺分泌节律的改变[18]。②此外,AECOPD合并VTE患者呼吸功能受损更为严重,机体在这种严重缺氧状态下,可抑制下丘脑-垂体-甲状腺轴功能,与炎症反应机制协同作用,影响外周甲状腺激素分泌。③在缺氧和高碳酸血症的刺激下,机体应激反应增强,皮质醇、儿茶酚胺及糖皮质激素生成增多,糖原异生和蛋白质分解增加,可反馈性的抑制下丘脑-垂体-甲状腺轴,TSH生成进一步受到抑制。而皮质醇和儿茶酚胺也能一定程度抑制Ⅰ型脱碘酶的活性,导致Ⅲ型脱碘酶基因表达增加,TT4向TT3转化功能障碍,无活性rT3增加[14,19]。
目前关于反映机体凝血和纤溶功能的主要指标有D-D和FIB等,D-D是来源于纤维蛋白原交联时的降解产物,是目前临床上监测机体继发性纤溶功能的特异性标志物。而FIB的升高是血栓形成的重要条件,其在凝血酶的作用下分解为可相互交联的纤维蛋白,是反映凝血功能的重要指标。既往研究证实在多种血栓性疾病如PTE和DVT中,患者机体内二者含量可表现出异常升高[20-21]。本研究分析了71例AECOPD合并VTE患者中凝血功能和血粘度指标,结果表明VTE患者血D-D、FIB和PV水平均明显高于非VTE组。白久武[13]等也观察到AECOPD继发VTE患者血黏度显著升高,VTE组患者低、中、高切血黏度均值,均高于非VTE组。Sohne[22]等研究了COPD继发血栓栓塞患者中D-D水平的变化,结果发现COPD对D-D诊断的准确性影响不大,这也与临床实际相符,目前D-D已成为血栓性疾病经常参考的指标之一。但也有学者认为AECOPD不论是否合并PTE,均能出现明显程度的D-D水平升高,故对于此类患者需进一步定义D-D诊断的临界值[23]。
基于观察到AECOPD继发VTE患者甲状腺激素和凝血功能指标的异常变化,科研组尝试采用相关性分析探索两类指标的相关性,结果发现血清TT3均与D-D、FIB和PV呈负相关,TT4与FIB呈负相关,与D-D和PV无明显相关性。FT3均与D-D、FIB和PV呈负相关,FT4与FIB呈负相关,与D-D和PV无明显相关性。TSH均与D-D、FIB和PV呈负相关。因此可以推测AECOPD继发VTE患者甲状腺功能激素与D-D、FIB和PV指标变化趋势相反,甲状腺激素指标降低趋势程度可能对VTE的诊断具有一定的价值。采用ROC曲线进一步比较TT3、TT4、FT3、FT4和TSH在预测AECOPD患者继发VTE的评估价值,结果发现TT3对预测VTE的诊断价值最高,曲线下面积为0.842,当TT3取0.61 nmol/L时为判断AECOPD患者继发VTE的最佳截断点。TT4、FT3和TSH对VTE的诊断价值一般,FT4对VTE的诊断无预测价值。目前已有多项研究将甲状腺激素联合用于急性心肌梗死、脑梗死等血栓性疾病患者的临床诊断和预后评估中[24-25]。课题组上述结果也表明甲状腺激素尤其是TT3对AECOPD合并VTE患者具有一定的诊断价值,其可能成为联合D-D、PV等诊断VTE的重要指标,故对于临床中高度怀疑VTE的患者,甲状腺激素检测有望成为一项辅助诊断的血清学指标。但目前关于该指标的有效性尚未见大样本研究,仍需进一步前瞻性研究证实。
综上所述,AECOPD 继发VTE患者血清TT3、FT3和TSH水平明显降低,且与血凝、血黏度指标存在一定相关性。笔者认为,对AECOPD应注意监测血清甲状腺激素水平变化,对筛查继发VTE患者的具有一定价值。本研究仍存在不足之处,首先受限于单中心研究,纳入样本量较少。同时未将稳定期COPD患者进行对照研究。未来课题组将利用网络数据库优势进一步纳入更多的COPD患者,同时进一步开展甲状腺激素与D-D等凝血功能联合检测VTE的前瞻性研究,并进一步探索其在AECOPD继发VTE患者的潜在作用机制。

