毛竹薄壁细胞组分分布及取向显微成像研究
冯 龙, 孙存举, 毕文思, 任珍珍, 刘杏娥, 江泽慧, 马建锋*
1. 国际竹藤中心竹藤科学与技术重点实验室, 北京 100102 2. 四川省林业和草原调查规划院, 四川 成都 610500 3. 国家林业和草原局管理干部学院, 北京 102600
引 言
拉曼光谱应用于植物细胞壁主要组分结构表征及分子取向的研究始于1986年, Atalla等用拉曼光谱阐明了针叶木管胞中纤维素及木质素的分子取向与拉曼光谱特征峰强度间的相关性[1]。 随着激光器及共聚焦成像技术的进步, 直到2006年显微拉曼光谱技术才成功应用于针叶木管胞细胞壁主要组分分布的研究[2], 随后这一技术在桉树[3]、 竹材[4]、 黄瓜[5]、 黄藤[6]等植物细胞壁研究中广泛应用。
竹材作为一种重要的天然梯度材料, 主要由维管束及围绕维管束的基本薄壁组织构成, 其中维管束是由高度木质化的纤维细胞围绕筛管和伴胞组成, 基本薄壁组织则由大量薄壁细胞排列构成。 竹材因其优良的抗拉强度、 抗拉模量、 抗压强度、 抗压模量等广泛应用于建筑、 工程材料等领域[7], 而竹材优良的力学特性取决于纤维和薄壁细胞的组织比量、 组分分布规律及微纤丝取向。 目前已开展的竹材分子光谱研究阐明了纤维细胞的组分分布规律及纤丝取向, 而薄壁细胞分子光谱成像的研究仍属空白。 尽管偏光显微镜[8]、 透射电子显微镜[9]、 紫外显微镜[10], 原子力显微成像[11]等已经应用于薄壁细胞的研究, 但主要是针对细胞壁分层结构及木质素分布规律研究, 而对纤维素的分布和取向, 木质素相联接的结构单元的研究鲜有报道。 故此利用共聚焦显微拉曼光谱成像技术在细胞乃至亚细胞尺度研究了毛竹(Phyllostachyspubescens)节间组织中薄壁细胞纤维素及木质素相连接结构单元的空间分布, 同时探索了纤维素分子的空间取向规律, 半定量的研究结果有助于加深对竹材薄壁细胞壁力学变异的理解, 同时拓展了拉曼显微光谱在植物细胞壁研究中的应用。
1 实验部分
1.1 原料
毛竹(Phyllostachyspubescens)茎长约25 m, 采自国际竹藤中心安徽太平试验中心林场。 从基部至稍部第10节节间截取竹筒, 竹筒沿轴向分割成2.0 cm×1.5 cm×10.0 cm的竹条, 进一步利用单面刀片分割成长宽高0.5 cm×0.5 cm×1.0 cm大小的矩形样品块。 然后利用滑走式切片机(Leica RM 2010R)切取15 μm厚的样品横截面切片, 保存在超纯水中供成像使用。
1.2 共聚焦显微荧光成像
将样品进一步分割成0.2 cm×0.2 cm×1.0 cm火柴棒大小竹条放入体积比为1∶1的30%双氧水和冰醋酸混合溶液中, 在80 ℃水浴锅中解离2 h。 获得的样品用蒸馏水反复冲洗后置于表面皿中用0.001%的吖啶橙溶液染色15 min, 然后利用50%(1 min), 100%(20 s, 两次)梯度乙醇进行脱水, 脱水后的切片置于载玻片上, 滴一滴甘油, 盖上盖玻片, 然后使用加拿大树脂封片。 检测时采用的共聚焦荧光显微镜为CarlZeiss LM510 Meta, 激发光源为488 nm Ar-Kr激光器, 发射波长为558 nm, 竹材横切面切片的自发荧光成像采用相同的测试条件。
1.3 共聚焦显微拉曼光谱成像
将15 μm厚的毛竹横截面切片置于载玻片上, 滴一滴去离子水, 盖上盖玻片, 然后使用加拿大树脂封片后采用显微共聚焦拉曼光谱(LabRAMHR Evolution, Horiba JobinYvon)进行光谱采集和成像。 为了获得较高的空间分辨率, 光谱采集时采用100倍油镜(Plan N 100×, Oil, NA=1.25)以及532 nm激发波长, 到达样品的激光功率为8 mW。 测试用光栅300 mm-1, 狭缝宽度100 μm, 扫描步距0.5 μm, 单点光谱采集时间1 s, 光谱测定范围3 100~500 cm-1, 光谱分辨率2 cm-1。 获得数据利用LabSpec6软件进行线性偏最小二乘法基线校正, 然后利用特征峰峰高进行成像分析。 偏振光拉曼成像时入射激光偏振方向平行于细胞径向壁。
1.4 透射电子显微镜成像
将竹条分割成0.2 cm×0.2 cm×1.0 cm火柴棒大小, 无水乙醇脱水后, 采用Spurr低粘度树脂对其进行渗透包埋, 固化温度为80 ℃(12 h)。 修整后的样品块, 通过Leica超微切片机(EM-UC6)获取90 nm的超薄切片带, 使用的钻刀为Diatome-Ultra45°。 在室温下用2%(w/v)高锰酸钾溶液对超薄切片染色1 min, 蒸馏水反复冲洗三遍后, 自然晾干。 用JEM-1230透射电子显微镜, 在加速电压为80 kV的条件下, 对竹材薄壁细胞分层结构进行成像研究。
2 结果与讨论
2.1 共聚焦显微荧光成像研究
薄壁细胞是竹材基本组织中的主要细胞类型, 起到填充、 贮存及应力缓冲作用, 是竹材构成中的重要组成成分[12]。 通过竹材节间组织横切面共聚焦荧光显微图像可以清楚的发现竹材由维管束及环绕其分布的基本薄壁组织组成。 维管束中的主要细胞类型有薄壁细胞、 纤维细胞以及导管等[图1(a)]。 薄壁细胞通常细胞腔大, 壁薄, 横截面近乎圆形, 具有明显的细胞间隙[图1(b)], 其次生壁临近细胞腔及复合胞间层临近细胞角隅的部分呈现出较高的木质化程度。 薄壁细胞可以分为长形细胞和短细胞两种。 相比于长形细胞, 短细胞具有更薄的细胞壁, 散布于长形细胞之间[图1(c)]。

图1 毛竹维管束、 薄壁细胞横切面及解离后的毛竹细胞荧光成像
2.2 多糖拉曼光谱归属
拉曼光谱中的特征峰是由样品组份分子的非弹性散射产生的, 前人研究表明植物细胞壁中纤维素、 半纤维素和木质素均能产生明显的拉曼信号[13]。 比较竹材薄壁细胞, 细胞角隅(ccml), 复合胞间层(cml), 次生壁外层(s-out)以及次生壁内层(s-in)拉曼光谱可以发现不同形态区域的拉曼特征锋主要出现在2 897 cm-1(—CH, —CH2伸缩振动)波数区[14], 1 600 cm-1(木质素芳香环伸缩振动), 1 098 cm-1(糖苷键C—O—C伸缩振动), 1 247 cm-1(木聚糖), 520 cm-1(纤维素C—O—C弯曲振动), 380 cm-1(吡喃环C—C—C对称弯曲振动)(图2)。
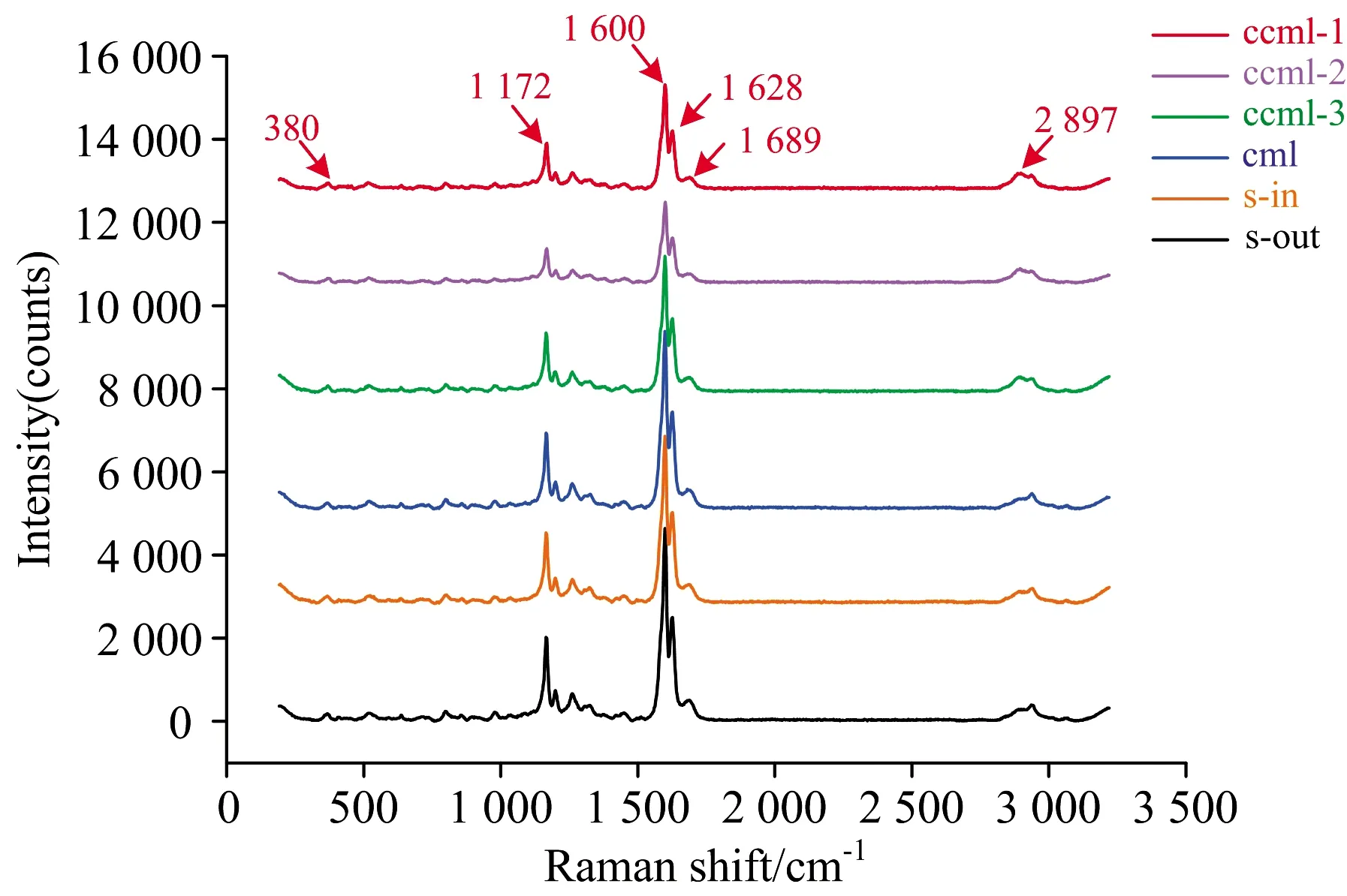
图2 薄壁细胞不同形态区域拉曼光谱比较
2.3 毛竹薄壁细胞拉曼光谱成像
2.3.1 细胞壁形态及微纤丝取向
通过对—CH特征峰区域2 800~3 000 cm-1进行积分,从获得的拉曼光谱成像图中毛竹薄壁细胞各个形态区域清晰可见[图3(a)]。 由于受到共聚焦拉曼显微镜的空间分辨率(0.5 μm)的限制, 其次生壁中的亚层结构难于区分。 通过对—CH特征峰区域320~400 cm-1进行积分, 可以观察到纤维素在薄壁细胞中均一性的分布规[图3(b)]。 同时利用透射电子显微镜研究发现薄壁细胞呈多层结构, 且薄层的厚度在0.2~0.3 μm范围内[图3(c)]。
研究指出天然纤维素拉曼光谱中的三个主要特征峰位于380, 1 097和2 897 cm-1处, 分别归属于吡喃环C—C—C的对称弯曲振动、 糖苷键C—O—C的非对称伸缩振动、 以及CH和CH2的伸缩振动。 其中糖苷键C—O—C特征峰(1 097 cm-1)以及CH, CH2特征峰(2 897 cm-1)的拉曼信号强度与入射激光的偏振方向存在明显的相关性。 偏振光拉曼光谱1 083~1 100 cm-1积分成像发现薄壁细胞次生壁在径向具有较高的拉曼信号强度[图4(a)], 归因于细胞次生壁的糖苷键C—O—C非对称伸缩振动更趋近平行于入射激光偏振方向。 另外, 拉曼信号在同一细胞壁亚层中均一的强度分布表明微纤丝高度定向有序排列。 由于纤维素分子中CH和CH2伸缩振动方向近乎垂直于糖苷键C—O—C非对称伸缩振动, 因此对2 840~2 930 cm-1区域进行积分, 薄壁细胞弦向次生壁具有更高的拉曼信号强度[图4(b)], 此时弦向壁CH和CH2伸缩振动更趋近平行于入射激光方向。 同样地对竹材纤维素方向敏感特征锋1 083~1 100 cm-1积分时可以清楚的区分出竹材纤维细胞宽窄交替的层状结构, 且窄层在激光偏振方向具有更高的拉曼信号强度[图4(c)]。

图3 薄壁细胞形态及纤维素分布拉曼光谱成像及透射电子显微图像
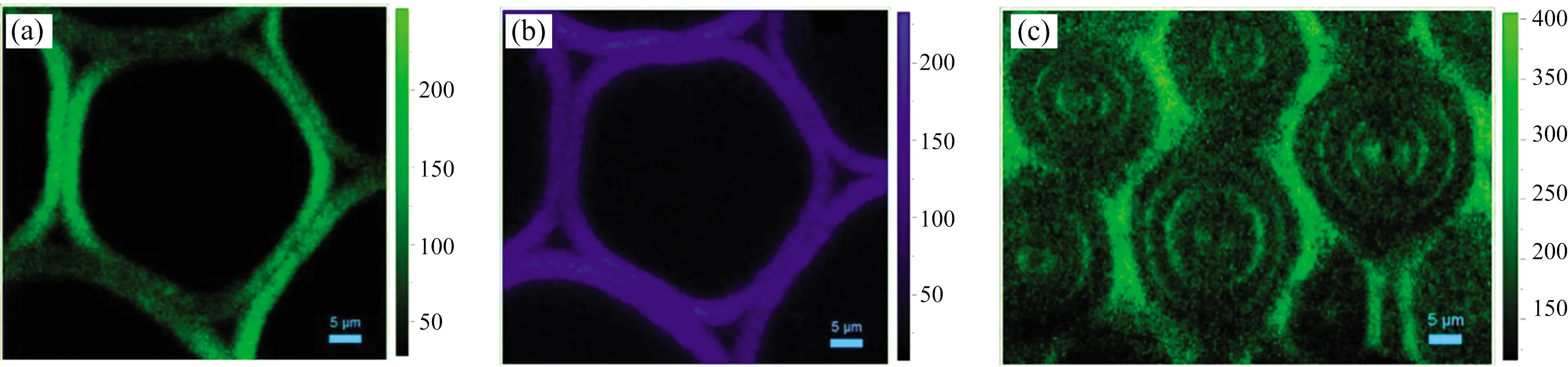
图4 薄壁细胞(a: 1 083~1 100 cm-1, b: 2 840~2 930 cm-1)及纤维细胞(c: 1 083~1 100 cm-1)
通过引入拉曼特征锋的比值(I1 095/I2 939)可半定量的阐明纤维素微纤丝在薄壁细胞壁中的取向规律。 从表1中可以看出380 cm-1(吡喃环C—C—C对称弯曲振动)拉曼特征峰在细胞不同形态区域中没有明显的空间取向规律。 而糖苷键C—O—C特征峰(1 097 cm-1)以及CH和CH2特征峰(2 897 cm-1)的拉曼信号强度在薄壁和纤维细胞弦向及径向具有明显的规律性。 薄壁细胞中I1 095/I2 939的均值为0.79, 与纤维细胞次生壁窄层的比值近似, 且明显高于纤维细胞次生壁宽层(0.55~0.63), 这表明这些区域中纤维素微纤丝更加趋近平行于入射激光电矢量偏振方向, 由于入射激光电矢量偏振方向与细胞轴向垂直, 由此可知相比于竹材纤维细胞宽层, 薄壁细胞与纤维细胞窄层中纤维素微纤丝的取向更加趋近垂直于细胞轴向, 也即更大的微纤丝角。
2.3.2 木质素微区分布
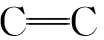
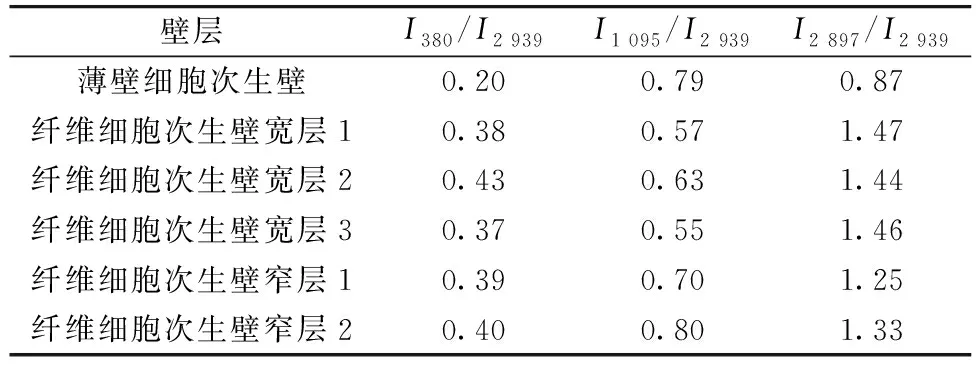
表1 纤维素方向拉曼敏感特征峰比值表
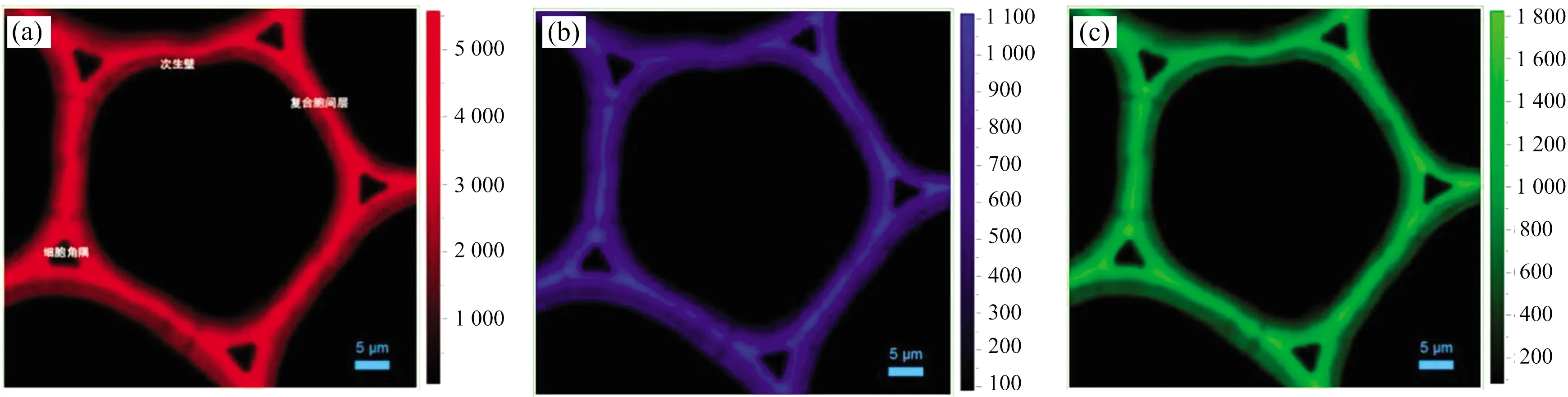
图5 薄壁细胞芳香化合物拉曼光谱成像
3 结 论
竹材薄壁细胞主要存在长型及短型两种细胞形态, 其细胞壁中木质素主要聚集于复合胞间层及次生壁内层, 与木质素共轭相联的松柏醛/芥子醛, 以及以酯键和醚键与木质素和半纤维素相联的对羟基肉桂酸也呈现类似的分布规律。 纤维素分子在薄壁次生壁中呈均一性的分布规律, 在薄壁和纤维细胞次生壁中具有明显的空间取向性。 由于受空间分辨率的限制, 薄壁细胞壁的分层结构难以通过拉曼光谱技术进行成像, 纳米红外光谱成像技术因其更高的空间分辨率有望揭示纤维素分子在薄壁细胞次生壁亚层中的排列规律。

