血吸虫感染通过抑制前炎症免疫应答缓解实验性脑疟的发生
冯永辉, 曹雅明, 朱晓彤
(1.中国医科大学附属第一医院 检验科,辽宁 沈阳 110001; 2.中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122)
2017年WHO疟疾全球报告[1]指出:截至2016年底,全球91个国家和地区约一半人口受到疟疾威胁,其中2.16亿人发病,44.5万人死亡,死亡人群绝大多数是5岁以下儿童。脑疟(cerebral malaria, CM)所引起的严重神经系统的并发症是引起5岁以下儿童死亡的主要原因。尽管CM发生的具体机制仍未完全清楚,但疟原虫感染的红细胞在脑部血管内皮细胞之间的沉积是脑疟发生的主要先前因素;同时宿主免疫应答的失调会进一步加剧脑疟的发生:过度的前炎症免疫应答(尤其是Th1型免疫应答)诱导血管内皮细胞黏附分子的表达上调,促进炎性细胞的聚集和红细胞、血小板的黏附聚集,引起脑组织微血管的堵塞和脑组织缺血,从而诱发中枢神经系统产生一系列症状[2]。利用PbANKA感染C57 BL/6小鼠所建立的实验性脑疟(experimental cerebral malaria, ECM)模型能模拟脑疟发生过程中的宿主免疫应答,常用于评价脑疟的免疫应答水平[3]。在疟疾流行区,疟疾患者常常伴随有蠕虫感染[4],但关于混合感染的研究结果存在争议,主要因为不同研究所采用的小鼠品系、疟原虫虫株,感染途径不同所致[5]。蠕虫反复感染常常会改变宿主的免疫应答水平,促使机体产生显著的Th2免疫应答[6]。Th1和Th2免疫应答的平衡对于疟疾控制至关重要。而在疟疾感染过程中,DCs等固有免疫细胞介导的固有免疫应答在平衡Th1和Th2免疫应答的过程中发挥重要作用[7]。因此采用血吸虫感染模型和ECM模型来探讨日本血吸虫感染对实验性脑疟的缓解作用,明确固有免疫应答在此过程中的重要作用,从而为疟疾流行区蠕虫混合感染的治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物及虫株 3~4周龄,雌性C57 BL/6小鼠,购自中国科学院上海实验动物中心。日本血吸虫虫株(Schistosomajaponicum)购自江苏血吸虫病研究所(无锡),PbANKA由日本爱嫒大学分子寄生虫学教研室惠赠。
1.1.2 主要试剂 以下抗体均购自BD PharMingen或eBiosciences:抗-CD4-FITC单克隆抗体(GKl.5;BD Pharmingen)、抗-CD25-PE单克隆抗体(PC61;BD Pharmingen)、抗-Foxp3-APC单克隆抗体(clone FJKl6s;eBioscience)、抗FcγIII/II封闭抗体(2.4G2;BD Pharmigen)、抗-CDllc-FITC单克隆抗体(HL3;BD Pharmigen)、抗-CDllb-PE单克隆抗体(M1/70;BD Pharmigen),抗-CD45R/B220-PerCP单克隆抗体(RA3.682;BDPharmigen)、抗-CD86-PE单克隆抗体(GLl;BD Pharmigen)、抗-MHC II-PE单克隆抗体(M5/115.15.2;BD Pharmigen)、抗-TLR4-PE单克隆抗体(MTS510;BD Pharmigen)、抗-TLR9-PE单克隆抗体(5G5;HBT)、抗-F4/80-FITC单克隆抗体(T45-2342;BD Pharmigen)和抗CD36-PE单克隆抗体(CRF D-2712;BD Pharmigen)。IFN-γ、TNF-α、IL-10细胞因子试剂盒购自R&D公司。
1.1.3 仪器与设备 流式细胞仪(BD FACS Calibuler, USA),酶标仪(BioRad,USA)。
1.2 方法
1.2.1 实验模型建立及处理 雌性C57 BL/6小鼠随机分为4组:正常组(Normal)、感染对照组(Pb)、血吸虫组(Schistosoma)和混合感染(Schistosoma+Pb)组。Schistosoma组和Schistosoma+Pb组小鼠在感染PbANKA前8周经尾静脉注射50条血吸虫尾蚴。然后在第0天,感染对照组和混合感染组小鼠经腹腔分别感染1×106PbANKA寄生红细胞,建立ECM模型,Normal组小鼠不做任何处理。感染后不同时间,小鼠尾静脉取血,镜检计数红网织红细胞数量和细胞感染率,并每日观察生存率。
1.2.2 脾脏流式细胞术 无菌取出感染后第5天小鼠脾脏,常规方法制备脾细胞悬液[8],用0.17 mol/L NH4Cl裂解红细胞。以含10%胎牛血清(FCS)的RPMI 1640调整脾细胞终浓度为1×107/mL。每份样品用抗-CD11c-FITC单克隆抗体、抗-CD11b-PE单克隆抗体、抗-CD45R/B220-PerCP和抗-CD86-APC单克隆抗体进行四色分析,另设阴性对照管。在预先加入FcγⅢ/Ⅱ封闭抗体的流式细胞仪专用染色管中加入脾细胞悬液0.1 mL,再加入抗-CD11c-FITC单克隆抗体、抗-CD11b-PE单克隆抗体、抗-CD45R/B220-PerCP单克隆抗体和抗-CD86-APC单克隆抗体进行表面染色。离心去上清后,用0.5 mL细胞染色缓冲液重悬浮细胞,流式细胞仪进行检测。每份样品用抗-CD11c-FITC单克隆抗体和抗TLR4-PE单克隆抗体进行双色分析,另设阴性对照管。每份样品用抗-CD11c-FITC单抗进行双色分析, 另设阴性对照管。在预先加入FcγⅢ/Ⅱ封闭抗体的流式细胞仪专用染色管中加入脾细胞悬液0.1 mL,按试剂说明书所示,进行固定和透膜后,再分别加入生物素标记的抗-TLR9单抗和PE-streptavidin。每份样品用抗-F4/80-FITC单克隆抗体和抗CD36-PE单克隆抗体进行双色分析,另设阴性对照管。在预先加入FcγⅢ/Ⅱ封闭抗体的流式细胞仪专用染色管中加入脾细胞悬液0.1 mL,再加入抗-F4/80-FITC单克隆抗体和抗CD36-PE单克隆抗体进行表面染色。每份样品用抗-CD4-FITC、抗-CD25-PE和抗-Foxp3-APC单抗进行三色分析,另设阴性对照管。在预先加入FcγⅢ/Ⅱ封闭抗体的流式细胞仪专用染色管中加入脾细胞悬液0.1 mL,用抗-CD4-FITC、抗-CD25-PE进行表面染色,固定透膜后,用抗-Foxp3-APC单抗进行胞内染色。采用FACS Calibur流式细胞仪进行检测,用Flowjo进行分析。
1.2.4 统计学分析 使用SPSS17.0统计软件对数据进行处理,3组样本之间采用方差分析比较均值差异,采用Kaplan-Meyer方法进行生存期分析。P< 0.05为显著差异。
2 结果与分析
2.1 日本血吸虫感染对小鼠体重、感染率和生存期的影响
C57小鼠感染血吸虫1个月后,建立ECM模型。如图1A与1B所示,在感染后第9天,混合感染组小鼠的原虫血症水平显著低于感染对照组(P<0.05),随后2组小鼠的原虫血症水平均逐渐上升,最后死于贫血。在第6~11天,70%(7/10)感染对照组小鼠出现脑疟典型症状并死于ECM,并于感染后19 d内全部死亡;混合感染组小鼠30%(3/10)出现脑疟典型症状并死于ECM,所有小鼠于感染后第23天全部死亡,2组生存期存在统计学差异(P<0.05)。同时还监测了2组小鼠的体重变化,图1C显示感染对照组小鼠的体重从感染后第7天开始持续下降,在第5天和第9天,混合感染组小鼠的体重显著高于感染对照组(P<0.05)。
2.2 日本血吸虫感染抑制ECM模型小鼠脾脏DC的分化和活化
DC分为髓样树突状细胞(mDC)和浆样树突状细胞(pDC)两种,在抗疟保护性免疫应答中发挥重要作用,尤其是mDC的数量和功能分子表达水平的高低对ECM的进展至关重要[9]。首先检测了混合感染对ECM模型DC亚群数量的影响。如图2A所示,在感染后第5天,血吸虫感染和/或PbANKA感染能显著增加DC及其亚群的比例,与感染对照组相比,混合感染组小鼠脾脏中mDCs(CD11c+CD11b+)和pDCs(CD11c+CD45R/B220+)的比例未见显著差异;但混合感染能显著降低小鼠脾脏中mDCs和pDCs的数量(如图2B、2C、2D所示)。此外,还通过FACS检测了各组小鼠DC的CD86、TLR4和TLR9分子表达水平(如图2E、2F、2G所示),结果显示日本血吸虫混合感染均能降低PbANKA感染小鼠这三种分子的表达水平,与感染对照组相比,TLR9分子的表达水平显著降低(P<0.01)。

图1 日本血吸虫感染对小鼠体重、感染率和生存期的影响Fig.1 The effect of co-infection on the bodyweight, parasitemia and survival of C57BL/6 mice infected with Pb ANKAA:感染率;B:生存率;C:体重变化;与Pb 相比,*:P<0.05 A: Parasitemia; B: Survival rate; C: Body weight change;* represent P<0.05 compared with Pb group
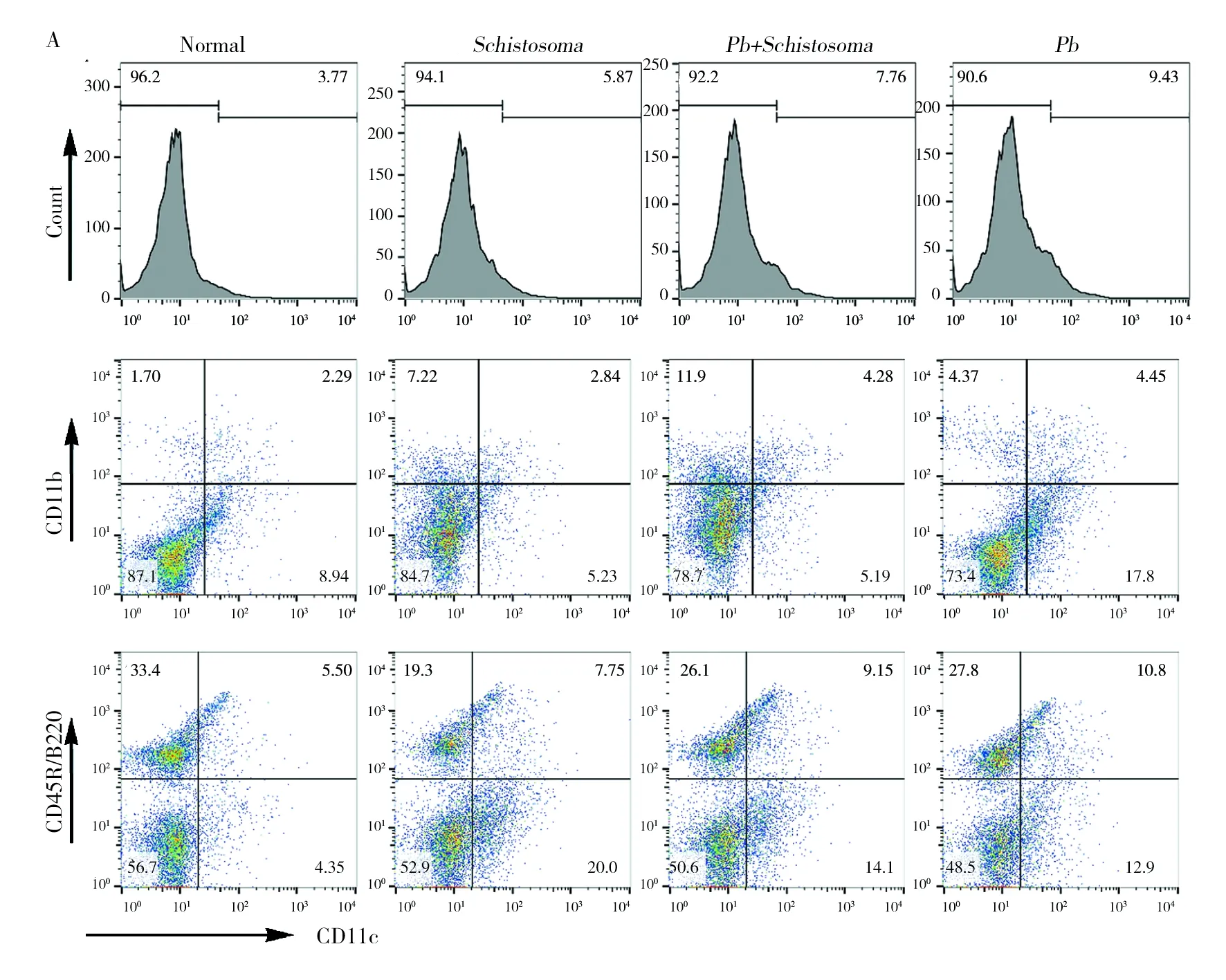

图2 日本血吸虫感染抑制ECM模型小鼠脾脏DC的分化和活化Fig.2 Co-iinfection inhibited the differentiation and activation of DC from the spleen of C57BL/6 mice infected with Pb ANKAA:DC亚群流式结果;B:DC总数;C:髓样DC总数;D:浆样DC总数;E:CD86表达水平;F:TLR4表达水平;G:TLR9表达水平;与Pb组相比,*:P< 0.05,**:P< 0.01,***:P< 0.001,下图同A: FACS results of DC; B: total DCs; C: total myeloid DCs; D: total plasmacytoid DCs; E: MFI of CD86; F: MFI of TLR4; G: DCs expressing TLR9; *, ** and*** represent P< 0.05, P< 0.01 and P< 0.001 compared with Pb group, respectively,same the follow
2.3 日本血吸虫感染抑制ECM小鼠脾脏巨噬细胞的活化和增殖
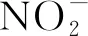
2.4 混合感染对ECM前炎症细胞因子的影响
在小鼠感染后第0、3、5和8天,检测了Pb组、Schistosoma组和Pb+Schistosoma组脾细胞培养上清中前炎症细胞因子TNF-α和IFN-γ水平。结果显示(图4),Schistosoma组脾细胞培养上清中TNF-α和IFN-γ的水平在感染后第0~8天未见显著变化。Pb+Schistosoma组和Pb组脾上清中TNF-α水平在第3天显著升高,随后下降(两组相比,P<0.01);同时两组IFN-γ和TNF-α水平在感染后第3天和第5天显著升高(两组相比,P<0.01),随后下降。
2.5 血吸虫混合感染对脾脏Treg的影响
Treg作为平衡体内前炎症免疫应答的一群重要细胞,在调控ECM的进展中发挥重要作用[11]。为此检测了脾脏中Treg的数量和功能因子IL-10的表达水平。从图5中可以看出,血吸虫和/或PbANKA感染会诱导脾细胞中Treg的数量显著升高(与正常鼠相比,P<0.05),与Pb组相比,混合感染会增加Treg的数量;血吸虫感染会显著提高脾细胞培养上清中的IL-10水平(与正常鼠相比,P<0.05)。
图3 日本血吸虫感染抑制ECM小鼠脾脏巨噬细胞的活化和增殖Fig.3 Co-infection inhibited the activation and proliferation of macrophages from the spleen of C57BL/6 mice infected with Pb ANKAA:活化巨噬细胞的流式结果;B:巨噬细胞总数;C:NO分泌水平 A: FACS results of activated macrophages; B: total macrophages; C: secreted NO level

图4 混合感染对前炎症细胞因子的影响Fig.4 Effect of co-infection on the pro-inflammatory cytokinesA:TNF-α表达水平;B:IFN-γ表达水平 A: TNF-α levels; B: IFN-γ levels

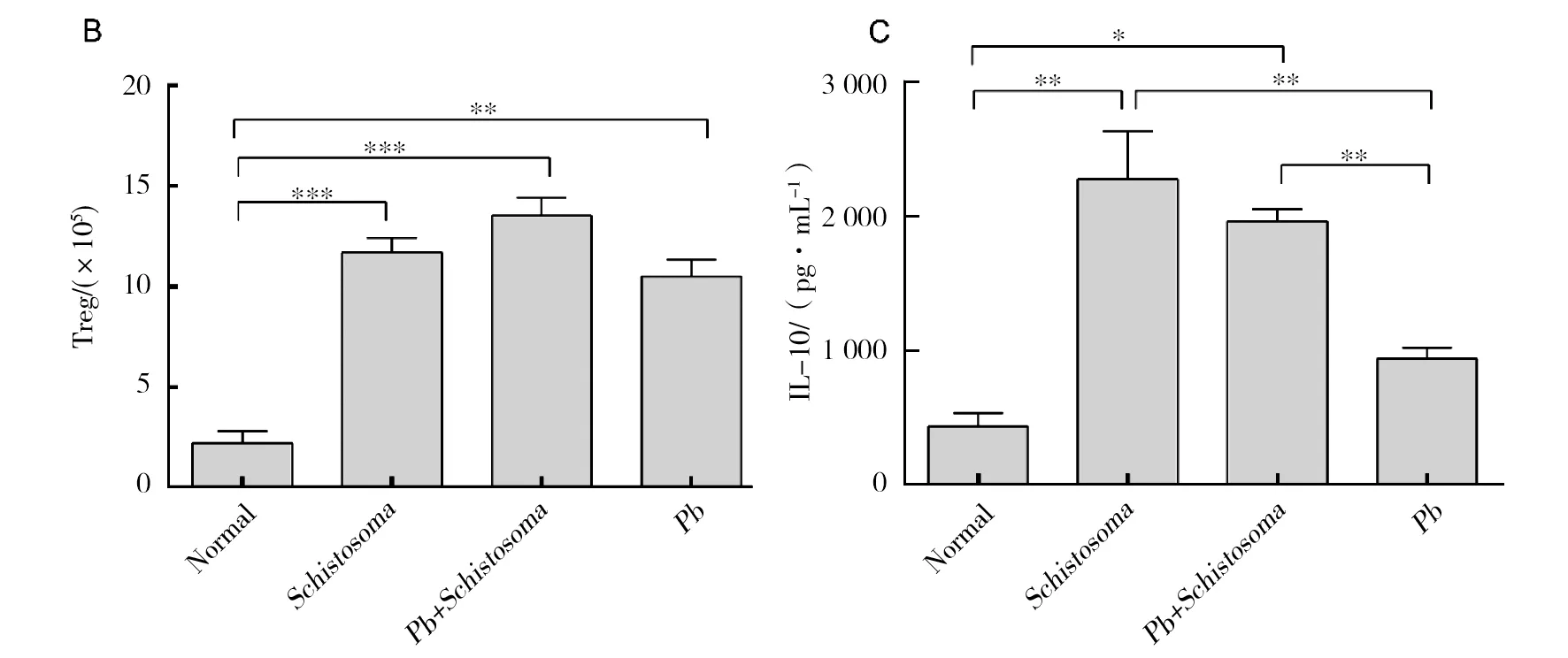
图5 日本血吸虫感染上调ECM小鼠脾脏Treg的数量和功能Fig.5 Co-infection increased the proliferation and function of Treg from the spleen of C57BL/6 mice infected with Pb ANKAA:Treg流式结果;B:Treg总数;C:IL-10表达水平A: Facs results of Treg; B: total Tregs; C: IL-10 levels
3 讨 论
疟疾作为世界三大致死性疾病之一,严重威胁居住在热带和亚热带的居民,其中血吸虫病与疟疾混合感染的流行并行尤为常见[12]。目前关于血吸虫与疟原虫混合感染对于宿主免疫应答的文献报道较少,同时不同种属的血吸虫与不同种属的疟原虫混合感染所引起的感染结局不尽相同。有研究认为曼氏血吸虫与伯氏疟原虫混合感染C57BL/6小鼠,对ECM有保护作用[13];而在Swiss albino小鼠模型中的混合感染会引起原虫血症和死亡率显著升高[14]。目前关于血吸虫与疟原虫混合感染对宿主免疫的影响主要集中于适应性免疫应答,而对于调控Th1/Th2免疫应答至关重要的固有免疫应答的报道较少。为此,本研究通过建立日本血吸虫与ECM模型来探讨混合感染对宿主固有免疫细胞介导的前炎症免疫应答(包括树突状细胞、巨噬细胞数量及其相关功能分子)的影响。结果显示,日本血吸虫感染会通过抑制宿主前炎症免疫应答来缓解实验性脑疟的发生。
树突状细胞(Dendritic cells, DCs)在诱导Th1免疫应答过程中发挥重要作用,成熟的DCs是活化初始T细胞的重要抗原提呈细胞,能诱导T细胞向Th1/Th2/Treg/Th17等不同的亚群分化。DCs作为固有免疫系统中最重要的细胞亚群,其亚群的分化及功能分子的表达水平会影响后续的Th1/Th2免疫应答形式和强度。DC能直接识别并提呈疟原虫抗原给CD4+T细胞,诱导宿主建立抗原特异性的免疫应答[15]。本研究通过FACS检测了脾脏中两种重要的DC亚群(mDC和pDC),结果显示日本血吸虫感染会降低两种DC亚群的数量,尤其是能够极化Th1免疫应答的mDC数量;CD86作为DC成熟重要标志之一,其表达上调会促进DC的提呈,疟疾感染过程中,疟原虫会通过TLR4和TLR9上调趋化因子和细胞因子的表达,促进宿主的前炎症应答水平,提示日本血吸虫感染会降低DC功能分子如CD86、TLR4和TLR9的表达水平,从而抑制DC的成熟和活化。
NO是在病原体感染时主要由iNOS产生,由IFN-γ和TNF-α诱导巨噬细胞产生[16]。NO在CM进展过程中的作用存在争议[17]。有研究认为感染早期脾细胞培养上清中高水平的NO能够抵抗疟疾感染[18]。但也有研究表明NO有助于CM病理发生,体内低水平NO 与CM内皮细胞功能失调和损伤有关[19]:NO水平降低会通过促进内皮细胞活化和白细胞及血小板的沉积来介导血管破坏及降低血流速度。我们检测了活化巨噬细胞的数量和功能,结果提示血吸虫感染会抑制PbANKA感染引起的巨噬细胞活化和增殖,从而抑制宿主体内过强的前炎症免疫应答,从而缓解ECM的发生。
Treg作为体内平衡Th1/Th2免疫应答最重要的免疫细胞,研究发现Treg会通过改变前炎症免疫应答(IFN-γ、TNF-α、IL-6、IL-17和 NO)和抗炎症免疫应答(IL-10)的平衡来决定ECM的结局[11,20]。血吸虫感染会增加宿主体内Treg的数量,并抑制体内Th1免疫应答,从而避免过强的免疫应答对宿主脑组织产生损伤。
综上,前炎症和抗炎症免疫应答之间的平衡对于ECM的结局至关重要。本研究表明,日本血吸虫感染会通过抑制DC亚群尤其是mDC的数量及 TLR9的表达水平来抑制DC的活化,以及巨噬细胞的数量和前炎症介质如NO和TNF-α等前炎症免疫应答,以及降低Th1细胞因子IFN-γ的水平,但对Treg的细胞数量未见有显著影响,猜测是通过血吸虫感染引起的Th2免疫应答来抑制前炎症免疫应答,进而缓解ECM的发生,从而延长宿主生存期,也为疟疾流行区的疟疾防控提供了参考。
——“零疟疾从我开始”

