提高D-二聚体的临界值对评估肺癌患者预后的价值
刘 勤, 陈 冲, 岳 超
(1. 天津市第五中心医院检验科,天津 300450;2.天津医科大学肿瘤医院检验科,天津 300060;3.天津市第五中心医院输血科,天津 300450)
肿瘤相关血栓严重影响肿瘤患者预后,静脉血栓(venous thromboembolism,VTE)导致患者需进行长时间抗凝治疗,从而延误抗肿瘤治疗时机[1-2]。肿瘤患者出血风险约12%,而存在VTE或进行抗凝治疗的肿瘤患者出血风险可提高21%,抗凝治疗会延误或中断化疗,严重影响肿瘤患者生存质量[3]。血栓形成可导致患者因非肿瘤本身原因死亡,降低患者生存率[4]。VTE的早期发现和及时抗凝治疗对患者预后有重要意义[1-2]。
D-二聚体(D-dimer,DD)作为纤维蛋白是蛋白水解过程中产生的最小交联蛋白,对临床排除肿瘤相关血栓有重要意义[2]。胃癌、结直肠癌、肺癌、乳腺癌患者血浆中DD水平明显升高[5-10]。有研究结果表明,许多实体瘤的预后与血浆DD含量密切相关[5-6,10-11],患者DD水平可预测是否存在VTE。现阶段临床认可的DD诊断存在VTE的临界值是500 ng/mL,由于肿瘤本身生物特性,导致肿瘤患者机体内凝血和纤溶系统异常,临界值为500 ng/mL虽有很高敏感性,但特异性很差,不能满足临床需要[12]。提高肿瘤患者DD的临界值对预测是否存在VTE有重要临床意义。本研究团队前期通过回顾性分析711例可疑VTE肿瘤患者DD水平,发现肿瘤患者DD的临界值提高至981 ng/mL时,可明显提高预测VTE的敏感性和特异性[13]。
肿瘤进展与机体凝血纤溶系统密切相关,凝血系统通过纤溶酶原激活剂被激活,纤溶系统激活可促进肿瘤生长和迁移,降低炎症细胞免疫应答,从而促进肿瘤进展。纤溶系统激活会影响肺癌患者化疗耐受[10]。DD作为纤溶酶调节交联蛋白凝块降解产物,于凝血系统激活后形成[11]。有研究结果表明,DD含量高低是评估许多恶性肿瘤,尤其是肺癌患者肿瘤进展和预后的重要指标[5,8,11,14]。由于DD常规临界值不能满足临床需求,本研究将DD的临界值提高至981 ng/mL,回顾性分析DD与肺癌患者生存期的相关性,探讨新的DD临界值(981 ng/mL)作为评估肺癌患者预后的价值。
1 材料和方法
1.1 研究对象
选取天津市第五中心医院和天津医科大学肿瘤医院2012年10月—2016年10月住院的153例经组织学或细胞学确诊的肺癌患者(鳞癌38例、腺癌79例和小细胞肺癌36例),其中男108例、女45例,年龄28~78岁。非小细胞肺癌患者中Ⅰ+Ⅱ期18例、Ⅲ+Ⅳ期90例;小细胞肺癌患者中局限期23例、广泛期22例。记录随访患者治疗后4年内生存期(overall survival,OS)相关情况。
1.2 排除标准
符合下列任一条件:体质量指数(body mass index,BMI)>35,肝功能异常(总胆红素>15 mg/L),肾功能异常(肌酐>15 mg/L),正进行肝素治疗或服用任何预防性抗凝药物。
1.3 实验室检测指标
肺癌患者临床病理分期采用国际抗癌联盟和美国癌症联合会制定的第7版TNM分期标准。所有实验室指标均为首次住院手术前或化疗前检测结果,实验室指标包括癌胚抗原(carcinoembryonic antigen,CEA)、细胞角蛋白19片段(cytokeratin-19 fragment,CYFRA21-1)、鳞状细胞癌抗原(squamous cell carcinoma antigen,SCC-Ag)、乳酸脱氢酶(lactate dehydrogenase,LDH)、DD。
1.4 方法
CEA采用MODULAR E170全自动电化学发光免疫分析仪(瑞士罗氏公司)及配套试剂(电化学发光法)测定,参考区间为0~5.0 μg/L。CYFRA21-1采用Cobas e602全自动化学发光仪(瑞士罗氏公司)及配套试剂(电化学发光法)测定,参考区间为0~3.3 ng/mL。SCC采用Cobas e602全自动化学发光仪(瑞士罗氏公司)及配套试剂(电化学发光法)测定,参考区间为0~1.5 ng/mL。LDH采用Cobas C701全自动生化分析仪(瑞士罗氏公司)及配套试剂(速率法)测定,参考区间为100~245 IU/mL。DD检测采用VIDAS仪器(法国生物梅里埃公司)及配套试剂(酶联免疫法)测定。
1.5 统计学方法
采用SPSS 17.0软件进行统计分析。各组生存曲线的比较采用Kaplan-Meier法,计量数据采用中位数(M)[四分位数(P25~P75)]表示,统计方法用非参数检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同DD临界值临床特征患者DD水平比较
当DD的临界值提高至981 ng/mL时,高龄组(≥65岁)与低龄组(<65岁)DD水平差异有统计学意义(P<0.05);DD的临界值为500 ng/mL和981 ng/mL时,不同性别、吸烟史、病理类型的肺癌患者DD水平无明显差异(P>0.05)。见表1。
女性肺癌患者生存期明显高于男性(P<0.01),不同吸烟史、年龄、病理类型、CEA、CYFRA21-1、LDH患者生存期无明显差异(P>0.05)。不同DD的临界值与肺癌患者生存期有关:当临界值为500 ng/mL时,不同DD分组肺癌患者生存期无明显差异(P>0.05);而当临界值为981 ng/mL时,不同DD分组肺癌患者生存期差异有统计学意义(P<0.05)。见表2。
2.2 以不同DD临界值分组的肺癌患者生存期比较
当DD的临界值为500 ng/mL时,≤500 ng/mL组和>500 ng/mL组患者生存期差异无统计学意义(P>0.05);而当DD的临界值提高至981 ng/mL时,>981 ng/mL组生存期明显低于≤981 ng/mL组(P<0.05)。见图1。

表1 不同临床特征肺癌患者DD水平比较
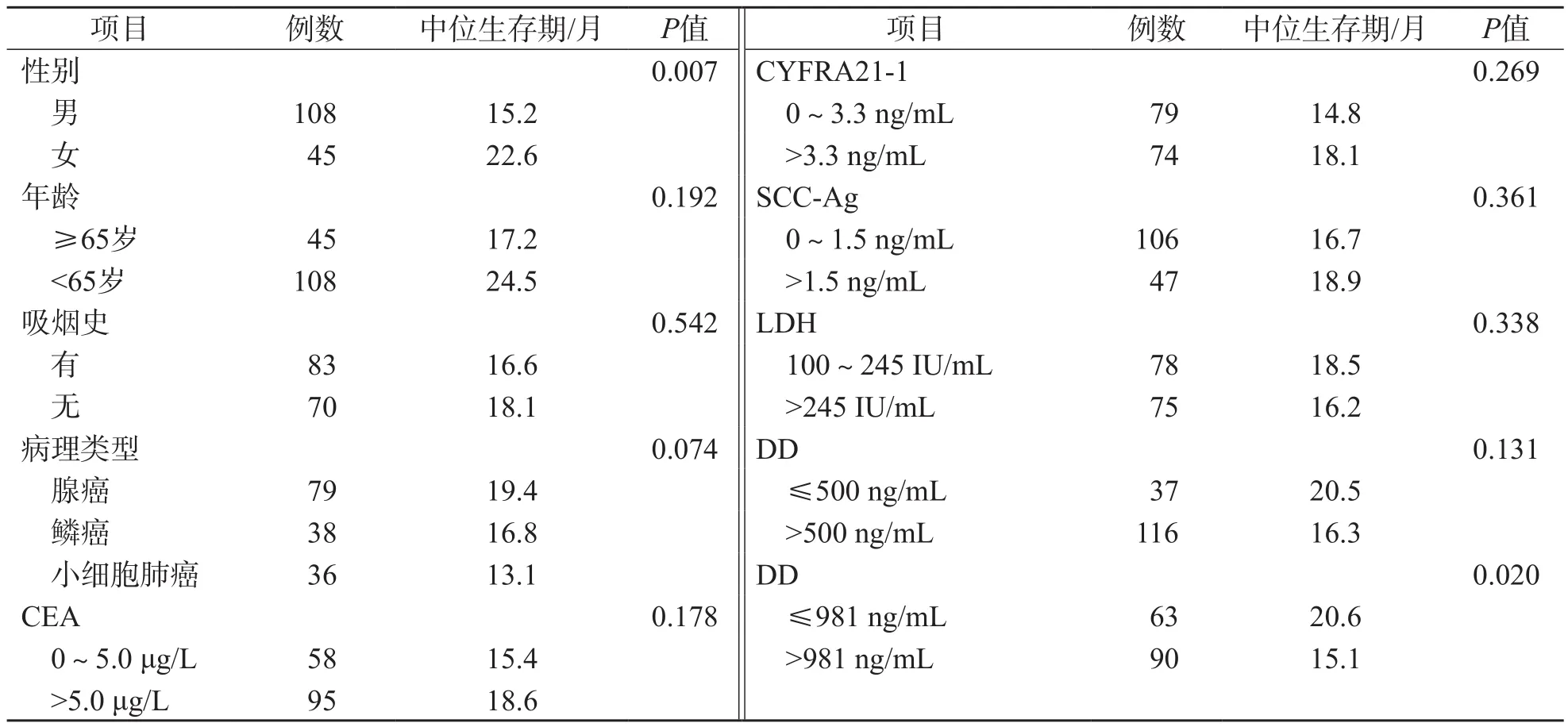
表2 不同临床特征的肺癌患者中位生存期比较
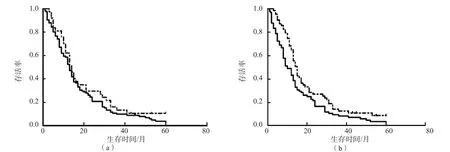
图1 以不同DD临界值分组的肺癌患者生存期比较
3 讨论
肿瘤患者常伴有凝血和纤溶系统异常,而凝血和纤溶系统异常会加速肿瘤进展,尤其是纤溶亢进可溶解肿瘤基质蛋白,改变肿瘤微环境,促进肿瘤细胞浸润、迁移。有研究结果表明,纤溶系统与肿瘤转移密切相关,DD与非小细胞肺癌患者淋巴转移密切相关[15-16]。肿瘤患者由于自身肿瘤细胞浸润和机体内免疫细胞数量及功能异常,肿瘤细胞、免疫细胞及其他基质细胞提供“免疫微环境”不同,导致肿瘤患者纤溶亢进,纤维蛋白降解产物之一的DD含量升高[13]。本研究团队前期分析了711例肿瘤患者凝血和纤溶相关实验室指标,发现肿瘤患者相关的指标异于正常人群,以500 ng/mL作为肿瘤患者DD的临界值可能无法满足临床需求,将DD的临界值提高至981 ng/mL可有效预测肿瘤患者是否存在血栓,为临床及时进行干预治疗提供实验室依据[13]。
既往研究发现,不同性别、病理类型、CEA、CYFRA21-1和LDH肺癌患者DD含量无明显差异,而年龄是影响肺癌患者DD水平的重要因素[17]。本研究发现,提高DD临界值至981 ng/mL时,不同年龄组DD含量存在统计学差异,而以500 ng/mL作为临界值时不能体现出年龄与DD的相关性,这与文献报道是一致的[17]。
有研究证实,肺癌、胰腺癌患者常伴高凝状态,同时纤溶亢进[3]。既往研究发现,血浆DD可作为非小细胞肺癌进展和淋巴结转移的重要指标,血浆中高水平的DD也是小细胞肺癌患者预后的不良因素[5,15]。本研究发现,当以500 ng/mL作为DD的临界值时,不同组别的肺癌患者生存期无明显差异,这可能与500 ng/mL偏低,无法将肺癌患者不同纤溶状态正确区分开有关。而将DD的临界值提高至981 ng/mL时,>981 ng/mL肺癌患者生存期明显低于≤981 ng/mL肺癌患者,因此,将DD的临界值提高至981 ng/mL可能是准确评估肺癌患者预后的关键。
总之,将肺癌患者DD的临界值提高至981 ng/mL可明确其机体内是否存在纤溶亢进,高水平DD(>981 ng/mL)是肺癌患者不良预后的重要指标,故提高DD的临界值可有效评估肺癌患者预后。

