热带东印度洋春季浮游植物群落结构空间特征分析
孙萍,李艳,潘玉龙,韦钦胜,袁超,张学雷,王宗灵
( 1. 中国海洋大学 环境科学与工程学院,山东 青岛 266100;2. 自然资源部第一海洋研究所 海洋生态环境科学与技术重点实验室,山东 青岛 266061;3. 青岛海洋科学与技术国家试点实验室 海洋生态与环境科学功能实验室,山东 青岛266237;4. 国家海洋局北海环境监测中心,山东 青岛 266033)
1 引言
印度洋三面环陆,南面是开阔大洋,海陆热力差异非常大,印度洋地区是世界上最强的季风区之一[1]。季风扰动了大洋上层海洋生态系统,季风转换被认为是印度洋北部初级生产力转换的首要驱动力,强烈的季风驱动了沿岸的上升流和带有大量营养物质的远岸水,导致阿拉伯海浮游植物藻华发生[2]。印度洋因受强烈季风影响,是全球热量、盐度、碳和营养物质运输的重要组成部分[3],对调节全球气候变化有重要的潜在性影响。苏门答腊−爪哇外海不仅是金枪鱼的重要渔场,也是南大洋蓝鳍金枪鱼(Southern Bluefin)迄今已知的唯一产卵场[4],因此印度洋日益成为当前各国海洋学家研究的热点区域。国际上对印度洋的研究,始于第一次国际印度洋科学考察计划(International Indian Ocean Expedition,IIOE-1,1957−1965),涉及海洋生物、海洋化学、物理海洋等多个学科,成果丰富[5]。2015 年启动了第二次国际印度洋科学考察计 划( Second International Indian Ocean Expedition,IIOE-2,2015−2020),主要包含六大科学主题,空间上从近海环境延伸到深海[5]。
浮游植物是大洋上层浮游生态系统最主要的初级生产者,其光合作用形成的有机物是海洋各级消费者最重要的物质和能量来源。浮游植物群落组成对上层大洋生物地球化学和物质输出有重要意义[6]。IIOE-2 计划认为应建立印度洋浮游植物分类数据库,定量初级生产速率和生物固氮效率,量化关键种和从不同生态区域跨越到印度洋的物种的生物地理学模型等科学问题[7]。浮游植物研究为量化、评估海洋渔业资源和海洋哺乳类等高营养级生物的生存提供支撑。但关于热带东印度洋浮游植物群落结构的文献近些年较少,尤其是水采的微型浮游植物研究更是鲜见,大部分仍是IIOE-1 研究成果[8-12]。近几十年来,由于人类活动和全球气候变化双重作用,研究海域生态环境和生物资源已发生了很大变化,全球气候变化会影响浮游植物的物候学、生长、物种组成及细胞大小等[13],因此十分迫切需要对该海域生态环境和浮游植物的时空分布、变化规律、形成及制约因素等有新的认识。最新研究仅有Monika 开展了温度对浮游植物群落结构的影响[14];王磊等[15]研究了春季季风间期巽他陆架和马六甲海峡表层海水浮游植物群落结构;薛冰等[16]开展了东印度洋赤道及其邻近海域硅藻群落研究,并对多年数据进行了比较分析。近些年,对大洋浮游植物种类组成、生物量等多样性特征研究较少,可能受制于枯燥、耗时但专业要求又极高的种类鉴定工作。但是,浮游植物种类鉴定是研究大洋、近海生态系统结构和功能最基础的环节,是研究生源要素生物地球化学循环的主要载体,尽管其生物量可以用叶绿素a来表征,也可用高效液相色谱法(HPLC)来测定大类色素组成,然而,上述方法不能给出浮游植物个体大小、种类组成特征,也就无法更好分析全球气候变化和人类活动对海洋生态系统的影响。
基于此,本论文以2013 年3−5 月季风间期在热带东印度洋获得的浮游植物水样数据及其同步环境数据,研究分析浮游植物种类组成、优势类群、细胞丰度等集群空间特征,掌握热带东印度洋水平和垂向上浮游植物群落分布格局和规律。该研究为从种群、物种层次研究大洋生物多样性,为实现保护和可持续利用生物资源提供数据支撑。
2 研究材料与方法
2.1 调查站位
本研究依托全球变化与海气相互作用专项东印度洋水体调查航次,现场观测于2013 年3−5 月进行,调查船为“向阳红09”号科学考察船。研究海区共布设4 条断面,3 条横断面自北向南分别为I04、I05 和I06,其中I04 断面沿赤道自83°E 到94°E,I05 断面沿5°S 自88°E 到97.5°E,I06 断面沿10°S 自85°E 到102°E(澳大利亚科科斯基林群岛周边未设调查站位);纵断面为I07 断面,沿88°E 自10°S 到4°N。调查站位共计35 个,大致均匀布设于整个调查区内(图1)。
2.2 取样和分析方法
参照《海洋调查规范第6 部分:海洋生物调查》和《全球气候变化与海气相互作用专项技术规程》要求,用捆绑在CTD 上的Niskin 采水器采集0 m、30 m、75 m、100 m、150 m 和300 m 各层水样进行浮游植物种类和细胞丰度的分析鉴定。每份浮游植物样品采水体积为1.5 L,使用鲁哥氏碘液固定,终浓度为2%。实验室内将样品静置沉降24 h 以上,用虹吸法浓缩至一定体积(约100 mL)保存于样品瓶中。由于印度洋微型浮游植物丰度非常低,显微镜观察前将样品再次浓缩并标定至10 mL,取0.5 mL 于计数框内,在Nikon TE2000-U 倒置显微镜下进行种类鉴定和计数。对一些个体小或固定后形态发生较大变化的细胞个体(细胞粒径≤20 μm),因未能鉴别到种或属,以门类划分,归入微型硅藻(Nano-diatom)和微型甲藻(Nano-dinoflagellates),无法鉴定到门类的统一计为微型浮游植物(Nano-phytoplankton)。
用Surfer 12 软件绘制浮游植物细胞丰度水平分布图,硅藻和甲藻种类数及细胞丰度占比平面分布图;用海洋数据视图软件ODV4.7.10(Ocean data view,http://odv.awi.de, 2018)绘制细胞丰度剖面图,用Sigmaplot 绘制硅藻、甲藻种类和细胞丰度占比及主要营养盐的垂直结构图。

图 1 2013 年春季热带东印度洋微型浮游植物观测站位Fig. 1 Locations of investigated stations of water phytoplankton in the tropical eastern Indian Ocean in spring 2013
3 结果
3.1 浮游植物种类组成
东印度洋春季水采浮游植物主要由硅藻、甲藻、金藻、蓝藻、裸藻和隐藻六大门类组成,共306 种(含变种、变型及3 类未能鉴定到种、属的微型甲藻、微型硅藻和微型浮游植物),其中硅藻43 属120 种,甲藻39 属175 种,金藻2 属4 种,蓝藻1 属2 种,裸藻1 属1 种,隐藻1 属1 种。硅藻和甲藻是研究海域内浮游植物的主要类群,占总种类数的比例分别为39.22%和57.19%。其中,硅藻门的角毛藻属17 种,根管藻属11 种,圆筛藻属10 种,星脐藻属、海线藻属和辐杆藻属各6 种,其他各属包含种类较少(1~3种)。甲藻门中大洋常见种新角藻属33 种,尖甲藻属16 种,鳍藻属15 种,原多甲藻属10 种,其次是鸟尾藻属和梨甲藻属各6 种,其他各属为1~5 种(种类名录详见文献[17])。
3.2 浮游植物优势种和优势类群
水采浮游植物优势类群主要以粒径较小的隐藻纲(Cryptophyceae)、微型甲藻、微型浮游植物、菱形藻(Nitzschiaspp.)、环沟藻(Gyrodiniumspp.)和小等刺硅鞭藻(Dictyocha fibula)为主,与同航次网采所获的小型浮游植物优势种类差异显著[17-18],后者主要是一些细胞个体较大或呈链状群体的硅藻(美丽漂流藻、佛朗梯形藻、角毛藻、距端假管藻等)和少数甲藻(夜光梨甲藻、波状角藻)。各优势类群在不同水层的平均细胞丰度、出现频率和占总细胞丰度比例见表1。由此可知,细胞大小在3~6 μm 的隐藻为第一优势类群,优势度为0.125,在30 m 水层,其平均细胞丰度达到57.31×102cells/L。而在100 m 水层,尽管细胞丰度不高(23.37×102cells/L),但 出 现 频 率 高(77.14%),因此占总细胞丰度比例达到了41.10%。明显看出,越深的水层(150 m,300 m),由于多种环境要素的限制作用,浮游植物优势类群以个体很小的门类为主。微型甲藻优势度为0.057,仅次于隐藻,其在整个调查区出现频率较高(25.71%~82.86%),平均细胞丰度在各水层差异较大(1.97×102~33.77×102cells/L),0 m 和300 m 较高,分别为33.77×102cells/L 和31.43×102cells/L,而在浮游植物生物量较高的75 m 水层,该类群细胞丰度却较低(4.39×102cells/L)。其他微型浮游植物优势度为0.056,不同水层出现频率差异亦较大(30 m为25.71%,75 m 为80.00%),平均细胞丰度明显低于隐藻和微型甲藻,仅为0.04×102~3.68×102cells/L。菱形藻在调查区优势度为0.048,是赤道印度洋浮游植物群落的广布种和常见种,在总细胞丰度较高的30 m和75 m 水层,其平均丰度分别为31.09×102cells/L、18.05×102cells/L,出现频率达到了82.86%、62.86%,由此可知,在细胞总丰度较高的大洋水域,硅藻仍然是生物量的主要贡献者。环沟藻是甲藻中的一大属,是微型浮游植物组成之一,其在不同水层出现频率差异大(0~77.14%)。小等刺硅鞭藻属金藻门,在近海也广泛分布,有时会形成赤潮,其在热带东印度洋也是常见种,尽管丰度和占比都较低,但各水层出现频率均在70%以上(71.42%~94.29%),显著提升了该种类的优势度。以上分析可知,隐藻和甲藻是调查期的主要优势门类,硅藻和金藻次之,采水浮游植物优势门类对比网采方式更加多样化。
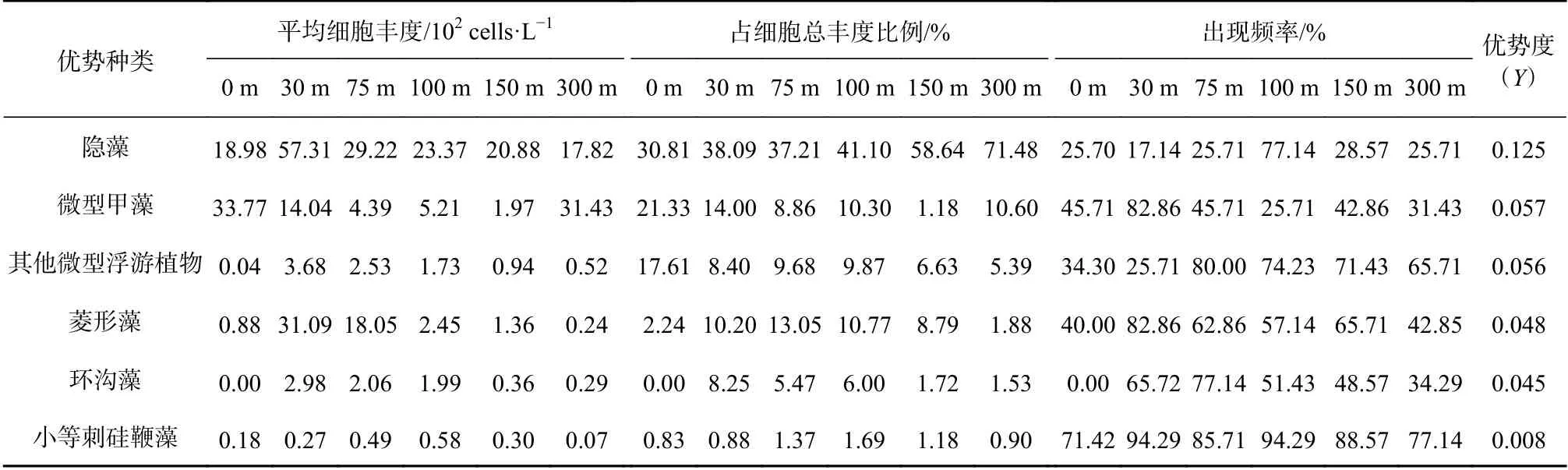
表 1 2013 年春季东印度洋微型浮游植物优势类群或优势种Table 1 Dominant group or species of water phytoplankton in the tropical eastern Indian Ocean in spring 2013
3.3 浮游植物细胞丰度与分布
3.3.1 细胞丰度的平面分布
浮游植物细胞丰度各水层分布趋势相似(图2),高值区基本都集中在88°E 断面赤道以南次表层水体(30 m、75 m),局部区域细胞丰度值可达104cells/L 以上,最高值出现在I0715 站(7°S,88°E)30 m 水层,细胞丰度高达253.5×102cells/L,主要贡献类群为隐藻、环沟藻、菱形藻及其他微型甲藻;而与其毗邻的东部、东南部水域出现了大面积的低值区并向赤道延伸,数值多在102cells/L 以下,最低位于I0515 站(5°S,94.5°E),细胞丰度仅为0.29×102cells/L,最高值是最低值的近1 000 倍。在88°E 断面赤道以北水域次表层(75 m)局部镶嵌有小高值区,主要贡献种类是微型浮游生物和小等刺硅鞭藻。

图 2 2013 年春季热带东印度洋微型浮游植物细胞丰度水平分布Fig. 2 Horizontal distribution of biomass of water phytoplankton in the tropical eastern Indian Ocean in spring 2013
3.3.2 浮游植物垂直分布特征
热带东印度洋春季浮游植物细胞丰度整体很低,不同纬度和区域差别较大,尤其是10°S 和88°E 两个断面,各断面鉴定出的物种数和细胞丰度详见表2。10°S 断 面 细 胞 丰 度 变 化 范 围 为0.34×102~88.69×102cells/L,最高值是最低值的200 多倍,88°E 断面变化范围为0.43×102~253.5×102cells/L,最高值是最低值的近500 倍。赤道断面((2.37±1.27)×102cells/L)和5°S 断面((1.95±1.47)×102cells/L)细胞丰度整体很低,站位间差异不显著。
各断面垂向上表现的空间分布格局基本相似,上混合层和跃层内浮游植物斑块特征明显。赤道断面,从西往东水采浮游植物细胞丰度高值逐步收窄,5°S 断面,跃层内水采浮游植物细胞丰度较高,且位置由西往东逐步抬升,并在94°~95°E 范围内出现一个 小 高 值,丰 度 达 到4×102cells/L。10°S 断 面,在92°E 附近海域,出现水采浮游植物的局部高值区,细胞丰度最高值达到30×102cells/L,整体丰度值明显比赤道和5°S 断面高。88°E 断面,在6°S~10°S 海域30~50 m 深度中,水采浮游植物细胞丰度达到2×104cells/L以上,往北丰度逐步降低且深度下压,整个赤道以北丰度相对低且分布较均匀(图3)。
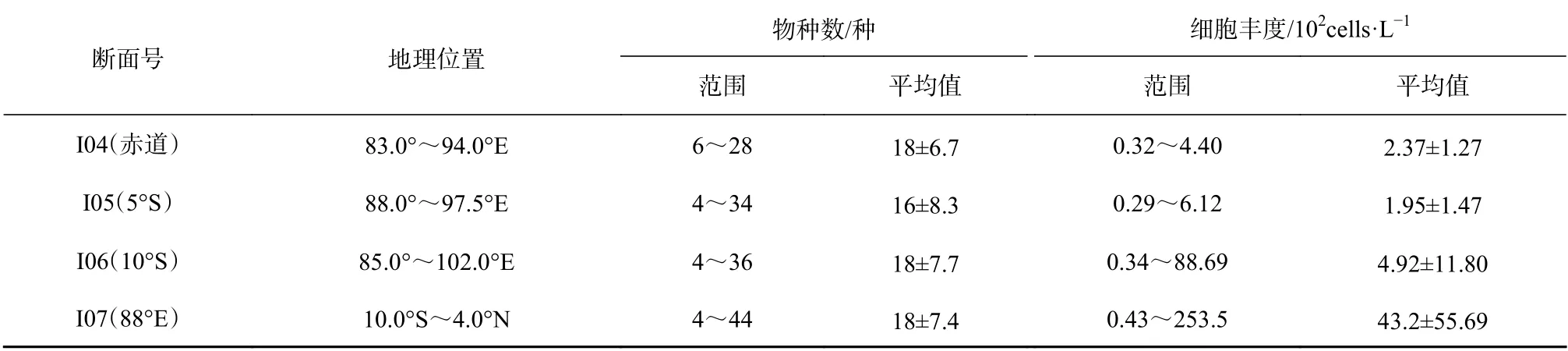
表 2 2013 年春季热带东印度洋不同断面浮游植物物种数和细胞丰度Table 2 Species and cell abundance of water phytoplankton in the tropical eastern Indian Ocean in spring 2013

图 3 2013 年春季热带东印度洋各断面微型浮游植物细胞丰度Fig. 3 Distribution of cell abundance of water phytoplankton in the tropical eastern Indian Ocean in spring in 2013
4 讨论
4.1 浮游植物种类组成空间差异性
本研究显示,隐藻是第一优势种类,优势度为0.125,该藻细胞个体很小(3~6 μm),属广盐广布种,在营养盐缺乏的近海海域,如黄海冷水团海域内也大量存在[19],而营养盐丰富的沿岸海域,隐藻鲜少能成为优势种,可能与其具有较小的体表面积和体积比有关。该种在每水层的细胞丰度相差不大,但占细胞总丰度的比例随着水层加深逐步增多(表1),在300 m水层达到了71.48%。该种在寡营养海域的广泛分布,说明了其环境适应性和种间竞争策略,值得深入研究。
除隐藻外,硅藻和甲藻广泛分布在各取样深度,但两门类的分布规律值得探讨。研究发现随着水深增加硅藻种类数相对比例增多(表3,图4),在0 m、30 m 大部分站位介于0.2~0.3 甚至更低,而较深水层(75 m、100 m、150 m、300 m)大部分站位在0.5~0.6。甲藻种类数相对比例与硅藻相反,即硅藻相对比例低的水层,甲藻相对比例明显较高,0 m 和30 m甲藻占比在0.7~0.8,其他水层在0.4~0.5,也就是说,甲藻在30 m 以浅海域,种类数占显著优势(图5,表4)。在75 m 层水体,无论硅藻还是甲藻种类数均最多。
在所有水层均出现的硅藻种类有海链藻、菱形藻、舟形藻、脆杆藻、角毛藻、伏氏海毛藻、斜纹藻、距端假管藻、美丽漂流藻等种类,甲藻有原甲藻、海洋原夜光藻、嘴状原夜光藻、单刺足甲藻、掌状足甲藻、尖甲藻、帆鳍藻、裸甲藻和膝沟藻等种类。除距端假管藻和美丽漂流藻细胞个体较大外,其他种类细胞个体较小,并且海链藻、脆杆藻、角毛藻均是长链状群体,这些种类的细胞集群能实现快速增殖。在100 m 及以下出现的硅藻种类有细弱辐环藻、辐裥藻、格氏圆筛藻、中心圆筛藻、弓束圆筛藻、蛇目圆筛藻、粗星脐藻、罗氏星脐藻、蜂窝三角藻、海毛藻、凌氏双肋藻;甲藻种类有短裸甲藻、纤细尖甲藻、华冠球藻、膨大双管藻。有意思的现象是辐环藻、辐裥藻、圆筛藻、星脐藻均为圆盘状,隶属于中心硅藻纲,细胞直径可达几十微米到三百多微米,这些种属的细胞浮力大,不排除是从上层沉降到深层的。同样现象在东北太平洋亦有发现:100 m 以浅水体中通常是一些可快速增殖的热带性小型链状藻类群体,如密聚角毛藻、短刺角毛藻和地中海指管藻等,而在较深水层通常是个体较大的藻类,如太阳漂流藻、伯古根管藻、大星纹藻和椭圆星脐藻等,尤其是在200~500 m的深处[20]。学者Cullen 在揭示次表层叶绿素最大值(Subsurface Chlorophyll Maximum, SCM)形成机制时认为:在合适光照和营养盐条件下,浮游植物具有控制自身游泳和浮力的生理活动能力也是重要的决定因素之一[21]。
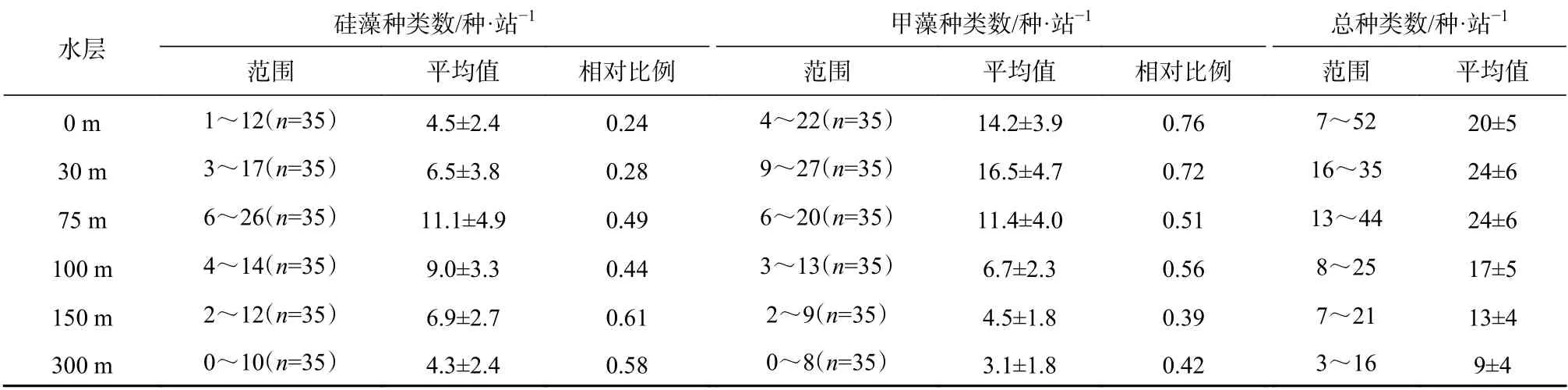
表 3 不同水层出现的浮游植物种类数及硅、甲藻相对比例Table 3 Species and relative proportion of diatoms and dinoflagellates in different water layers

图 4 2013 年春季热带东印度洋不同水层硅藻种类数相对比例Fig. 4 Relative proportion of species numbers of diatom in different layers in the tropical eastern Indian Ocean in spring 2013

图 5 2013 年春季热带东印度洋不同水层甲藻种类数相对比例Fig. 5 Relative proportion of species numbers of dinoflagellate in different layers in the tropical eastern Indian Ocean in spring 2013
早在IIOE-1 科学计划中对大洋上层海洋浮游植物分布特征的研究结果表明,甲藻种类数远高于硅藻(羽纹硅藻和中心硅藻之和),即大洋浮游植物群落结构中,甲藻是最重要的集群(表4)[11];本文研究与IIOE-1 研究结果基本相同。杨清良等[20]通过分层拖网的方式,对东北太平洋浮游植物研究发现,表层至50 m 层各类浮游植物的种数和丰度都最高,往下逐层递减;其中,蓝藻和具有运动功能的甲藻类主要分布于100 m 以浅,往下急剧减少。相对而言硅藻类分布范围较大,即使在透光层以下200~500 m 的低温层,仍有相当数量,总趋势本研究与其类似。
4.2 浮游植物细胞丰度空间差异性
各水层总细胞丰度空间分布规律显示,30 m 和75 m 细胞丰度明显高于其他水层,尤其在调查区的西南部海域,高值区高达253.5×102cells/L,甲藻和硅藻仍然是细胞丰度的主要贡献者。由图6 可知,在6 个水层均表现出甲藻是大洋中微型浮游植物细胞丰度的重要贡献者,研究海区北部与东北部表现的更为明显,贡献率在0.8~0.9 及以上。上混合层(0 m、30 m)和混合层下部(300 m)也是甲藻贡献率较大(0.9),而混合层(75 m、100 m、150 m)各站位间变化较大(0.3~0.9)。硅藻在75 m、100 m、150 m 和300 m对生物量的贡献率等值线较为密集(图7),也就是说,硅藻分布的空间异质性显著,不同站位间变化明显。结合各水层种类数所占比例来看,0 m、30 m 硅藻种类数占比低(0.2~0.3),其细胞丰度占比也较低(0.1~0.2),75 m、100 m 和150 m 尽管种类数占比明显上升(0.5~0.6),但细胞丰度占比仍然不高(0.1~0.5)。
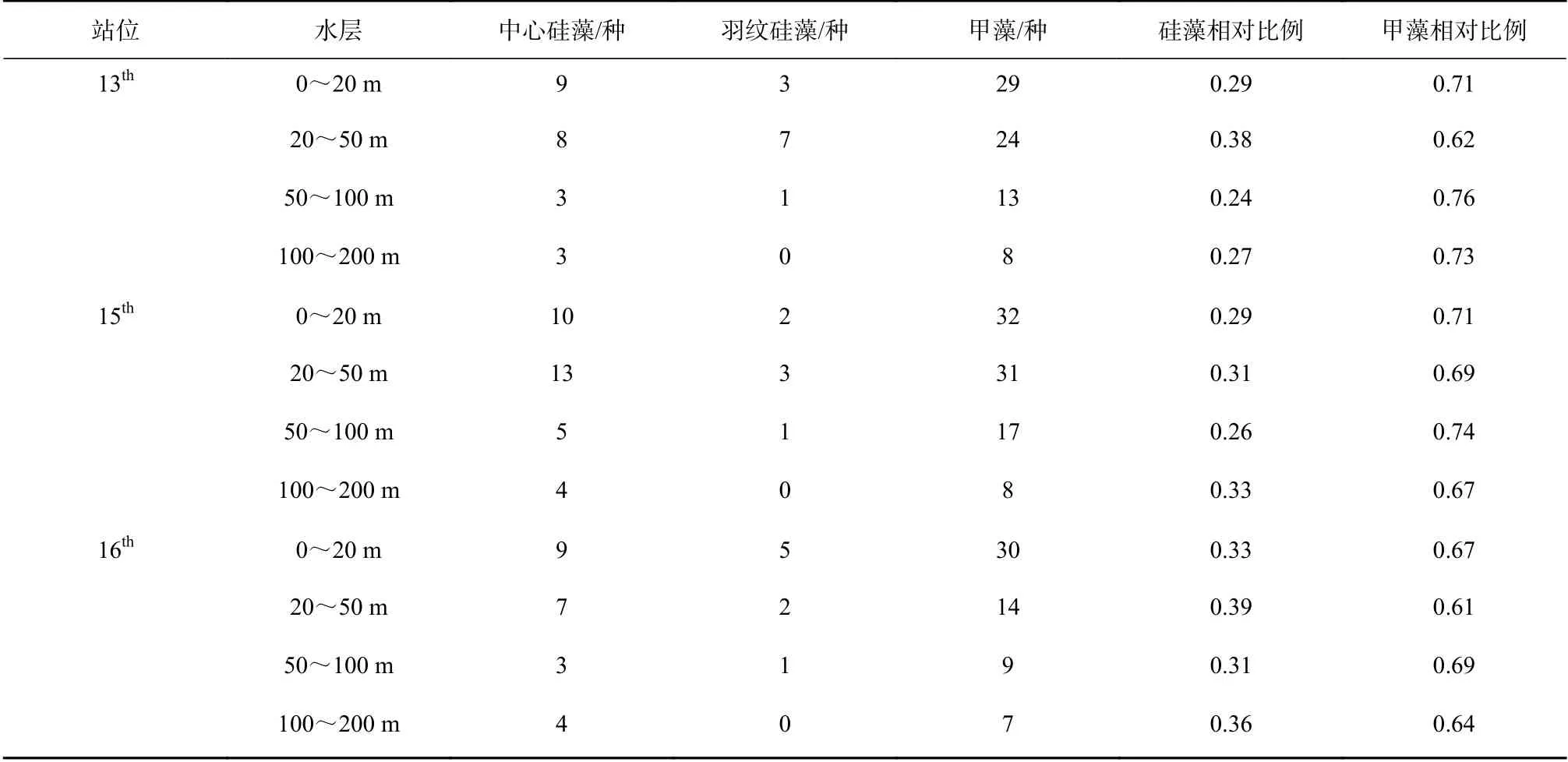
表 4 1960 年东印度洋爪洼岛临近海域不同水层出现的浮游植物种类[11]Table 4 Species of phytoplankton in different water layers of the sea area near Java Island in the tropical eastern Indian Ocean in 1960[11]
4.3 浮游植物类群结构及其主要影响因素
热带东印度洋浮游植物细胞丰度斑块状分布特征显著,与该时期物理环境特征密切相关。东印度洋春季季风间期最典型的两个水文现象—Wyrtki 急流和赤道潜流直接或间接影响,调控着浮游植物的分布格局。赤道断面高浮游植物细胞丰度水舌从西向东变窄变弱,Wyrtki 急流把阿拉伯海高温、高溶解氧和浮游植物相对高值的水自西向东输运,不但给贫瘠的赤道海域输运营养盐,同时,也带去了浮游植物细胞丰度的相对高值水团。Duan 等[22]运用现场实测数据(2013 年春季流系数据和生物数据是同步观测的),揭示了热带东印度洋2013 年春季和秋季两种Wyrtki急流的显著异常行为,发现这两个Wyrtki 急流均发生在130 m 以上深度,持续时间超过1 个月,2013 年春季5 月份的表现异乎寻常地强于2012 年秋季。浮游植物样品的收集与重要的水文学的数据相结合,不仅可以研究浮游植物的地理分布特征,还可以综合分析浮游植物群落与水团的关系。88°E 断面,浮游植物细胞丰度的垂直分布与水平分布均能很好印证这一点。赤道潜流一般分布在80~200 m 水深处,基本处于温跃层内,其核心盐度高于35.25,输运高盐水的能力比Wyrtki 急流强得多。大洋水体比较稳定,浮游植物在营养盐、盐度和溶解气体等方面的需求依赖海洋环境,潮流及其运动决定了浮游植物的传播和输运。IIOE-1 有学者对西印度洋浮游植物群落特征及其与水团关系进行了研究,鉴定出浮游植物239 种,分成了4 个生物水文地理学上的区系:(1)赤道次表层水;(2)赤道潜流边界;(3)南赤道流;(4)表层流,发现赤道次表层水是生物最大的一个栖息环境,发现了50 种,在所有样品中占据主导地位,被认为是印度洋典型的浮游植物区系[12]。本研究也表明,表层流、赤道次表层水等水团显著影响着浮游植物的分布,并且在赤道次表层水内,浮游植物丰度是最高的。

图 6 2013 年春季热带东印度洋不同水层甲藻细胞占总丰度比例Fig. 6 Proportion of abundance of dinoflagellate vs. total abundance in different layers in the tropical eastern Indian Ocean in spring 2013
从上述分析得出,热带东印度洋浮游植物主要类群为硅藻和甲藻,为较清晰描述这两个重要类群垂直空间的分布规律以及细胞丰度和营养盐的关系,我们选 取 了 两 个 较 典 型 的 站 位I0416(0°N,90.5°E)和I0715(7°S,88°E),试图去说明影响浮游植物群落结果的主要影响因素。I0416 站位细胞丰度总体偏低(1.01×102~1.67×102cells/L)。该站位的物理环境特征是由于赤道断面太阳辐射强,海表温度高,上混合层较厚可达70 m,营养盐贫乏(图8),无明显流系。I0715 站位细胞丰度总体较高,各水层变化范围为5.64×102~253.50×102cells/L。该站位物理特征是温跃层在此处明显抬升,上混合层厚度在50 m 以浅,受东向赤道潜流影响,将阿拉伯海的高盐、高溶解氧海水向东输运,表层和次表层营养盐有持续补充(图9)。
尽管两站位物理环境明显不同,细胞丰度差异显著,但硅藻和甲藻的种类和丰度占比有一个共同规律,即0 m 时,甲藻无论是种类数还是细胞丰度,都占明显优势,随着水层加深细胞丰度增大,硅藻占比增多;I0715 站位表现更为明显,即营养盐相对丰富时,硅藻快速增长,这与近岸浮游植物群落特征表现一致。75 m 及以深水层,硅藻种类和丰度贡献都有所增加(300 m 除外)。值得指出的是,I0416 站,0 m 和100 m 细胞丰度相差无几,但硅、甲藻种类却明显不同,0 m 层硅藻种类数相对比为0.32,占总丰度比为0.08,甲藻种类数相对比为0.68,占总丰度比为0.92;100 m 层硅藻种类数相对比为0.73,占总丰度比为0.22,甲藻种类数相对比为0.26,占总丰度比为0.77。推测两水层营养盐和光照的差异可能是主要原因。浮游植物两大重要类群硅、甲藻,其结构不但受营养盐的控制,同时光照也是很重要的一个调控因子,且环境要素对浮游植物的调控在不同水层所起的作用是不同的。光照、营养盐及其细胞丰度都会对浮游植物结构特征产生影响,多要素协同综合作用。藻类经过长期进化适应,对光强的需求分为两种:适阴型藻类和适阳型藻类[23]。大洋浮游植物群落调控机制研究,具有极大吸引力,指引着我们去探索。

图 7 2013 年春季热带东印度洋不同水层硅藻细胞占总丰度比例Fig. 7 Proportion of abundance of diatom vs. total abundance in different layers in eastern tropical Indian Ocean in spring in 2013
5 结论
热带东印度洋春季浮游植物主要由硅藻、甲藻、金藻、蓝藻、裸藻和隐藻6 大门类组成,硅、甲藻是印度洋浮游植物的主要门类,其优势类群主要是粒径较小的隐藻、微型甲藻、微型浮游植物、菱形藻、环沟藻和小等刺硅鞭藻。微型浮游植物细胞丰度各水层平面分布趋势相似,但各站位差异显著,高值区集中在88°E 断面赤道以南次表层水域,而与其毗邻的调查区的东部、东南部水域出现了大面积的低值区并向赤道延伸,最高值是最低值的近1 000 倍。垂直剖面上看,浮游植物群落存在差异且呈现一定规律,上混合层甲藻种类在物种组成上占显著优势,随着水层加深硅藻种类的优势逐步升高,跃层内硅、甲藻种类数均最多。上混合层下部和跃层内细胞丰度明显高于其他水层。在寡营养海域,甲藻是微型浮游植物种类数和细胞丰度的重要贡献者。不同深度的微型浮游植物群落结构,环境要素对其的影响和控制作用并不是单一的,而是多要素协同作用。
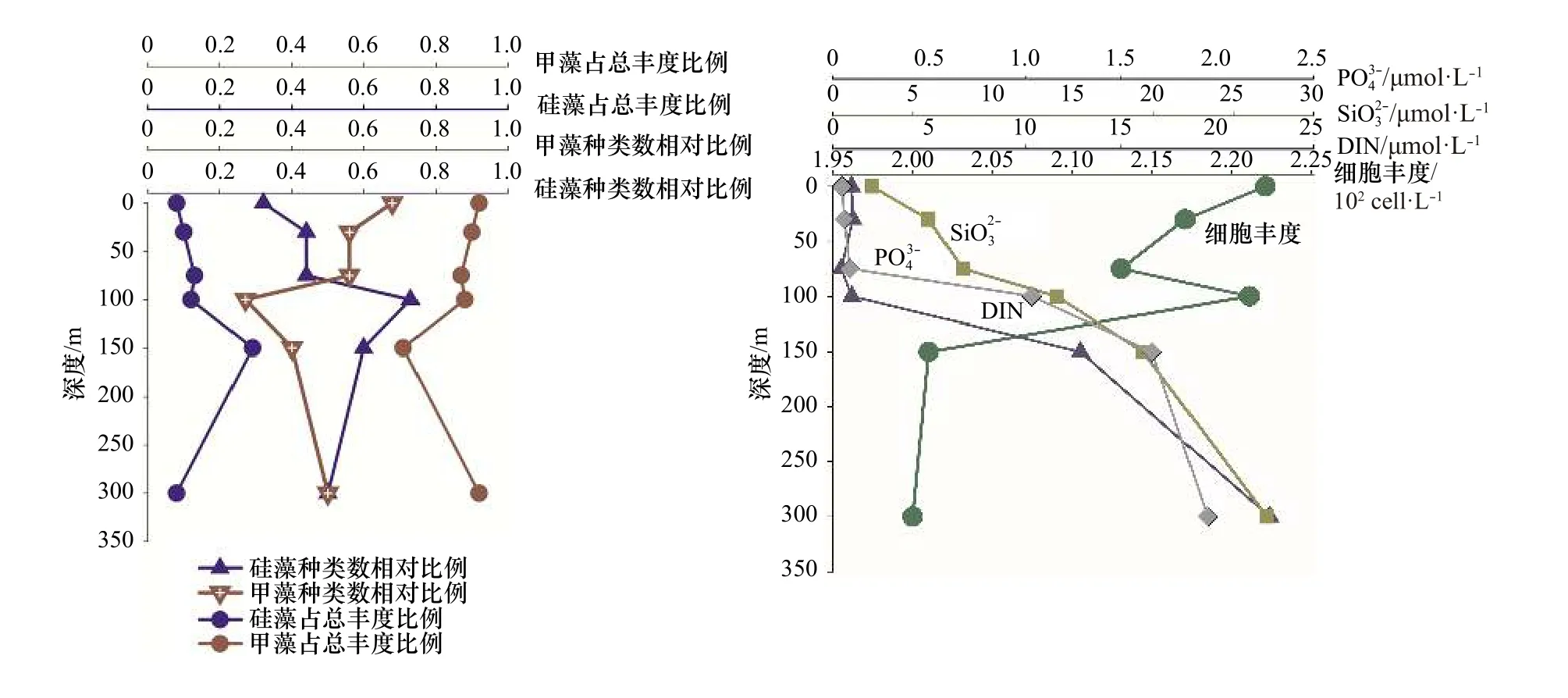
图 8 I0416 站位硅、甲藻种类和细胞丰度占比及主要营养盐的垂直结构Fig. 8 The vertical structure of nutrient, species ratio and cell abundance ratio of diatom and dinoflagellate in Station I0416
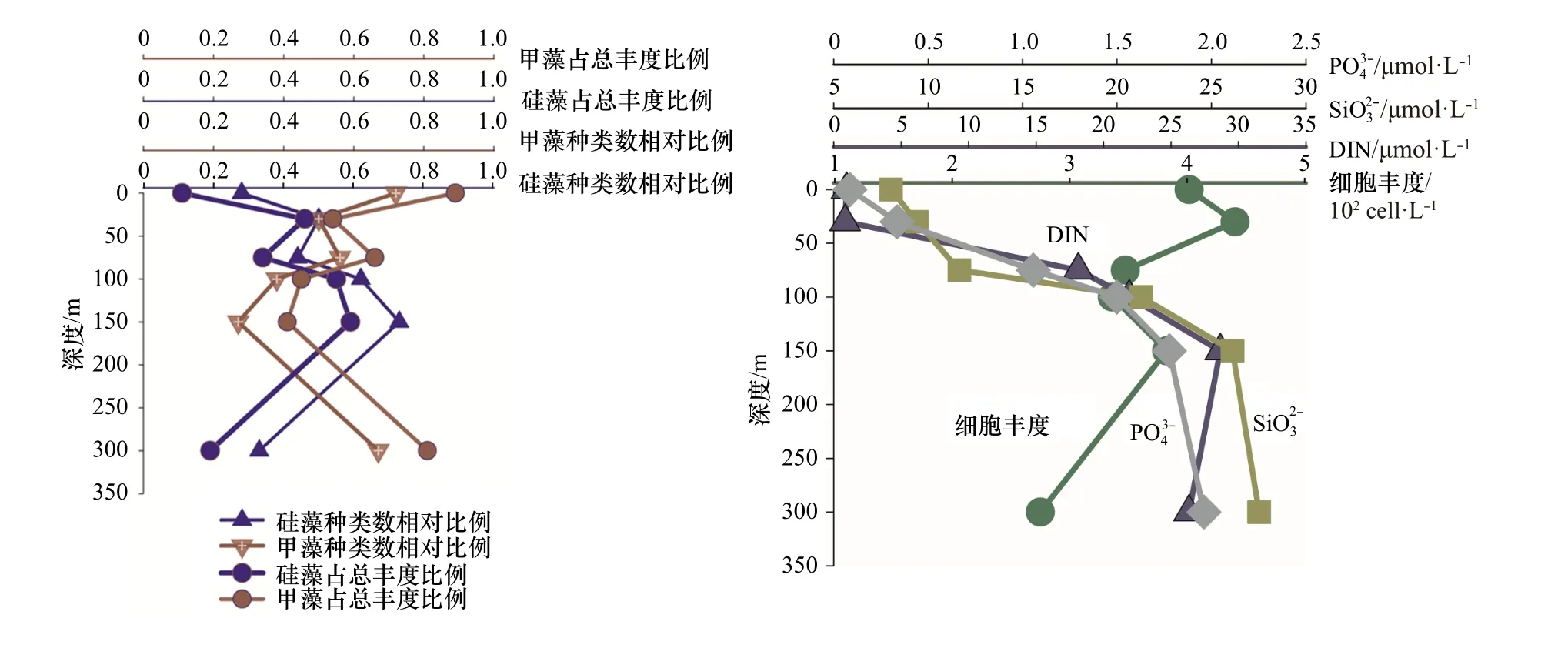
图 9 I0715 站位硅、甲藻种类和细胞丰度占比及主要营养盐的垂直结构Fig. 9 The vertical structure of nutrient, species ratio and cell abundance ratio of diatom and dinoflagellate in Station I0715
致谢:感谢刘一霆、张清波、徐宗军、王晓、王洪平、徐金涛、刘湘庆以及“向阳红09”船全体船员在样品采集中的支持,特别感谢李瑞香研究员在论文写作上给予的指导。

