超声与X线引导下经皮肾镜取石术治疗儿童复杂性肾结石的疗效及安全性比较
张 斌 王 翔
近年来,儿童肾结石的发病率明显升高,有研究报道肾结石在儿童的发病率已上升至0.5%[1]。尽管各国地域不同,医疗条件不一,但是各国学者一致认为,对高发病率及高复发率的儿童结石病,应该选择高效且对发育中的肾脏损伤最小的治疗方法[2]。目前临床上治疗儿童肾结石以体外冲击波碎石术(extracorporeal shock wave lithotripsy,ESWL)、采用输尿管硬/软镜的逆行肾内取石术(retrograde intrarenal surgery,RIRS)、经皮肾镜取石术(percutaneous nephrolithotomy,PCNL)为主。对于负荷比较大的复杂性肾结石,PCNL在儿童中已成为首选治疗手段[3]。
精确穿刺并建立皮肾通道是PCNL手术成功与否的关键,目前建立皮肾通道最常用的两种定位方法是经X线引导和经超声引导。本研究回顾性分析复旦大学附属儿科医院泌尿外科2011年7月至2018年7月PCNL治疗儿童复杂性肾结石的临床资料,比较经X线引导和经超声引导两种定位方式的临床疗效及安全性。
材料与方法
一、临床资料
收集国家儿童医学中心复旦大学附属儿科医院泌尿外科2011年7月至2018年7月经PCNL治疗的儿童复杂性肾结石病例资料,共80侧,左肾38侧,右肾42侧。其中经X线引导组41侧;经超声引导组39侧。复杂性肾结石纳入标准[4]:鹿角形结石、单颗结石≥2 cm、肾盂肾盏内多发结石。排除标准:患有心血管疾病及出血性疾病且术前控制不佳者;合并泌尿系统多发畸形者;未接受治疗的急性尿路感染者。所有患儿家属同意并签署手术知情同意书后实施手术治疗。
二、资料收集
收集患儿术前一般资料包括性别、年龄、左右侧别以及结石负荷量等;手术及术后资料包括一次穿刺皮肾通道建立成功率、穿刺失败例数、平均手术时间、术中及术后并发症例数、术后平均住院天数、结石清除率(stone free rate,SFR)等。SFR以拔除双J管后3个月复查超声为准。
三、手术方法
手术均采用气管插管全身麻醉,患儿先取截石位,膀胱镜下向患侧输尿管插入4Fr输尿管导管,退镜后膀胱内留置导尿管,并将输尿管导管和导尿管一并固定后,患儿改俯卧位,垫高腹部使腰背部平坦。
建立皮肾通道:穿刺点选择腋后线与肩胛下线之间第11肋间至第12肋下区域。从输尿管导管注入1∶2欧乃派克造影剂(经X线引导组:X线C臂机为PHILIPS BV Endura)或生理盐水(经超声引导组:超声为HITACHI-ALOKA Noblus),形成人工肾积水。X线C臂机采用靶心法定位结石,超声采用穿刺引导线定位结石。确定穿刺角度和深度后,刺入18G穿刺针,拔除针芯见尿液流出,置入导丝,穿刺点切开皮肤,筋膜扩张器自8Fr依次扩张至14Fr,留置16Fr剥皮鞘并固定。
经剥皮鞘置入肾镜(儿童采用9.5Fr膀胱镜代替肾镜),找到结石后予气压弹道(EMS碎石新星)碎石至2 mm以下,碎石随灌洗液经同一通道排出,术毕留置肾盂输尿管D-J管及14F肾造瘘管。术后5~7 d拔除肾造瘘管,术后2个月膀胱镜下取出D-J管。
四、统计学方法
采用SPSS 20.0统计软件对数据进行整理与分析,对于年龄、结石大小、手术时间等服从正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验;对于性别、侧别、一次穿刺皮肾通道建立成功率、SFR等计数资料采用频数分析,两组间比较采用χ2检验。以P<0.05为差异有统计学意义。
结 果
所有病例均得到随访,中位随访时间为5年(1~8年)。自拔除双J管起,所有病例每年进行至少2次及2次以上的超声检查。
一、两组病例术前一般资料比较
经X线引导组共41侧,平均年龄(4.85±3.72)岁,左肾21侧,右肾20侧,平均结石大小(17.92±4.40)mm;经B超引导组共39侧,平均年龄(5.47±3.98)岁,左肾17侧,右肾22侧,平均结石大小(16.80±5.28)mm。两组病例在年龄、左右肾及结石大小方面的差异均无统计学意义(P>0.05),这说明两组具有可比性(表1)。
二、两组病例手术及术后情况比较
经X线引导组一次穿刺皮肾通道建立成功率为70.7%(29/41),最终因穿刺失败终止手术2例,平均手术时间为(109.76±32.46)min;术中并发症1例,为穿刺针损伤结肠,术中及时发现,术后予保守治疗后痊愈;围手术期因严重失血予以输血2例,1例因术中穿刺部位选择不佳,损伤盏颈处血管导致出血,血红蛋白从109 g/L降至70 g/L,1例为术后7 d下床活动后发生迟发性出血,血红蛋白从116 g/L降至72 g/L,2例均予以输血及止血药物治疗,通过局部加压后止血;术后平均住院天数为(8.49±2.72)d;结石清除率为80.5%(33/41)。经超声引导组一次穿刺皮肾通道建立成功率为89.7%(35/39),所有手术均顺利完成,平均手术时间为(109.26±74.68)min;术中无胸膜、腹腔脏器损伤等并发症以及围手术期出血导致输血的发生;术后平均住院天数为(8.23±1.78)d;结石清除率为76.9%(30/41)。超声引导组在一次穿刺皮肾通道建立成功率上优于X线组,差异有统计学意义(χ2=2.617,P=0.034);两组其余各方面差异均无统计学意义(P>0.05)(表2)。

表1 两组病例术前一般资料比较Table 1 Comparison of preoperative profiles between two groups
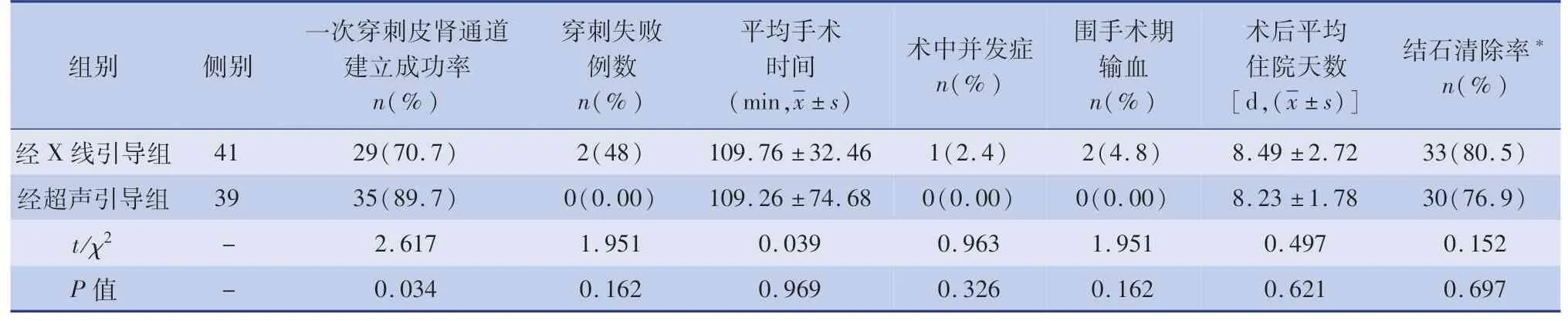
表2 两组病例手术及术后情况比较Table 2 Comparison of perioperative data between two groups
讨 论
复杂性肾结石往往结石负荷量大,感染率高,患肾功能易受损甚至丢失,其治疗的目的在于最大限度地取出结石,从而减少残石量,控制尿路感染,保护肾功能[5]。目前临床上治疗儿童肾结石可以采用的手段包括:ESWL、RIRS和PCNL。
ESWL具有微创、可重复性高等优点,但其碎石效果受结石大小、密度、部位等因素影响较大,SFR较低,且对于低龄儿童需要镇静或麻醉[6]。RIRS具有相似的特点,如果结石负荷较大,其泌尿系统感染率高、手术时间长以及术后即刻SFR稍低,并且受患儿年龄影响,年龄越小,输尿管管径越细,手术成功率相对越低[3]。
上世纪70年代,Fernstrom等[7,8]提出了经皮肾镜取石术的概念,因其具有创伤小、安全、SFR高等优势,已成为成人复杂性肾结石的标准治疗方式。1985年Woodside等[9]报道将PCNL术用于治疗儿童上尿路结石。但由于初期PCNL手术器械的原因,其手术并发症以及对肾脏发育影响等因素始终阻碍着PCNL在儿童肾结石治疗中的广泛开展。近二三十年来,随着医疗技术的不断提高,医疗器械的逐步改善以及更精细化的手术设备型号的出现,PCNL在治疗儿童复杂性肾结石逐步占据主导地位。Mishra等[10]报道微通道PCNL相对于标准通道可以减少术中出血、缩短住院时间;Kapoor等[11]建议儿童PCNL应限制在24F以内;而国内也有文献报道根据不同年龄段采用不同通道大小进行PCNL[12]。本研究中所采用的是16F通道,也属于微通道PCNL范围。
进行PCNL手术的第一步就是建立皮肾通道,目前最常用的2种定位方法是经X线引导穿刺和经超声引导穿刺。X线定位集合系统及结石显示直观清晰,但无法显示通道的肾外脏器及肾血管情况,且X线辐射会对医患身体造成伤害;而超声引导可有效避开周围脏器及肾血管,避免副损伤,降低出血风险,且对人体无创。文献报道,在超声或X线引导下建立皮肾通道的成功率达86.7%~100%[13]。本研究仅X线引导组有2侧最终因通道建立失败而终止手术,故经超声或X线引导下建立皮肾通道的总体成功率为97.5%(78/80)。因经超声引导可以实时监测,成功穿刺后进行皮肾通道的建立中,通道不易丢失,故经超声引导组的一次穿刺皮肾通道建立成功率(89.7%)较X线引导组具有优势(70.7%)。而且超声引导具有安全、简便、定位精确等优点,关键在于超声能实时明确穿刺通道与肾组织的空间立体信息,并可清晰辨别结石和肾集合系统的位置以及肾组织的厚度,更好地把握穿刺角度和深度,提高穿刺准确率和成功率,有效避免周围脏器的损伤以及严重并发症的发生[14]。故本研究中经超声引导组中的全部病例未出现胸膜及腹腔脏器的损伤。经超声引导的经验是,首先通过多切面(至少包括横切面和纵切面)扫描确定穿刺点,然后将探头保持纵切面最优穿刺方向,确定穿刺深度,穿刺针平行探头进针,纵切面上实时微调探头方向,结合穿刺针内有无液体流出,判断穿刺针头是否进入肾盏,从而提高一次性穿刺成功率。但也有文献报道,在皮肾通道的建立中,经X线引导的穿刺成功率优于经超声引导[15]。该研究认为经超声引导采集的图像质量受操作者影响大,而X线定位成像清晰,具有更直观的影像学表现,术中结合逆行肾盂造影,可明确显示穿刺针方向,以及与集合系统的位置关系[16]。故本研究认为,经超声引导和经X线引导都可以很好地辅助经皮肾穿刺及皮肾通道的建立,关键在于术者对于哪种辅助定位方式掌握的更好。但毫无疑问,超声的优势在于无创,经X线引导必然会使医患双方暴露于放射线中,特别是对儿童尚未发育完善的性腺影响较大[17,18]。
出血是影响PCNL手术进程以及危及患儿生命的重要因素[19]。本研究中,经X线引导组有2侧因围手术期出血需接受输血支持,而经超声引导组未发生严重的术中、术后失血。本研究认为可能的原因是反复无效穿刺增加了肾盏盏颈血管的损伤,或皮肾通道位置欠佳导致肾镜摆动幅度大,增加了对肾脏的损伤,从而导致术中出血以及术后发生迟发性出血。经超声引导可以实时定位穿刺针位置,选择最佳路径,并能检测肾区包括肾集合系统在内的任何出血情况,有效判断和评估术中出血量。尤其是对于血常规尚未反应的出血更有意义,有助于指导进一步治疗,必要时可终止手术,减少出血并发症的发生[20]。
PCNL的目标是尽可能彻底清除结石,术后的结石残余情况是评价整个手术效果的金标准。目前随着各种激光碎石、气压弹道碎石的改进,使碎石粉末化的效果及结石清除率都得到了明显提高。即便如此,肾脏残留少量结石碎片是难以避免的,临床上大多认为,对于术后<4 mm的结石碎片无需予以处理,这些结石碎片属于临床无症状性残留结石碎片(clinically insignificant residual fragments,CIRF)[5]。但也有研究认为CIRF特别是位于下盏的CIRF自行排出概率并不高,会增加结石复发、血尿、输尿管梗阻的风险[21]。本研究中,术后随访为CIRF的病例仍归为结石清除,两组的SFR无统计学差异,说明经超声引导与经X线引导辅助PCNL碎石效果相似。当然,本研究为单中心回顾性研究,且样本量较小,可能存在较大的误差,还需要进一步前瞻性研究来评估。
综上所述,随着穿刺技术和设备的不断改进与创新,无论经X线引导还是经超声引导下行PCNL治疗儿童复杂性肾结石均是安全有效的。本研究发现经超声引导在一次穿刺皮肾通道建立成功率上有一定优势。因此,在保证手术安全有效的前提下,采用经超声引导下PCNL,完全可以避免医患人员暴露于X线中,值得在儿童复杂性肾结石的治疗中推广与应用。

