自噬相关蛋白ULK1在糖尿病大鼠溃疡创面组织中的变化
麻华胆 黄庆 郑爱甜 刘贤彬 李政 王琳 曾娜 吴标良


【摘要】 目的 观察糖尿病大鼠溃疡创面愈合过程中UNC-51样激酶1(UNC-51-like kinase 1,ULK1)的变化,初步探讨细胞自噬在糖尿病慢性创面愈合中的作用。 方法 SPF级Wistar雄性大鼠18只,随机分为对照组、模型组,每组9只。模型组建立糖尿病模型,随后两组大鼠均行全层皮肤切除。分别于第1天、第11天、第18天观察创面愈合情况并于上述各个时相点每组随机取3只大鼠采集创面组织,HE染色观察组织病理改变,Western blotting法检测ULK1及其磷酸化水平,qRT-PCR分析ULK1基因的表达。结果 (1)创面愈合情况及组织病理改变:模型组创面愈合速度较对照组快,组织病理改善差于对照组。(2)第1天、第11天,模型组ULK1蛋白表达低于对照组,第18天,模型组ULK1蛋白表达高于对照组(P<0.05),p-ULK1在对照组、模型组中的表达差异无统计学意义(P>0.05)。(3)第1天、第11天,模型组ULK1 mRNA表达低于对照组,第18天,模型组ULK1 mRNA表达高于对照组(P<0.05)。结论 糖尿病慢性创面愈合过程中细胞自噬可能受到抑制,可能是糖尿病溃疡创面愈合不良的机制之一。
【关键词】 ULK1;糖尿病;溃疡创面;细胞自噬
中图分类号:R587.2 文献标志码:A DOI:10.3969/j.issn.1003-1383.2020.07.002
【Abstract】 Objective To observe the changes of UNC-51-like kinase1(ULK1) in the process of wound healing in diabetic rats,and to preliminarily investigate the role of autophagy in chronic wound healing in diabetes mellitus.Methods 18 male Wistar rats of SPF grade were randomly divided into control group and model group with 9 rats in each group.The diabetic model was established in the model group,and then full-layer skin resection was performed in both groups.Wound healing was observed on day 1,day 11 and day 18,respectively,and 3 rats were randomly selected from each group to collect wound tissues at the above time points,HE staining was performed to observe histopathological changes,ULK1 and its phosphorylation levels were detected by Western blotting,and ULK1 gene expression was analyzed by qRT-PCR.Results (1) Wound healing and histopathological changes:the wound healing rate of the model group was slower than that of the control group,and the histopathological improvement was worse than that of the control group.(2) On day 1 and day 11,the expression of ULK1 protein in the model group was lower than that in the control group,and on day 18,the ULK1 protein expression in the model group was higher than that in the control group(P<0.05),and there was no statistically significant difference in the expression of p-ULK1 between the control group and the model group(P>0.05).(3) On day 1 and day 11,ULK1 mRNA expression in the model group was lower than that in the control group,on day 18,ULK1 mRNA expression in the model group was higher than that in the control group(P<0.05).Conclusion Autophagy may be inhibited during chronic wound healing in diabetes mellitus,which may be one of the mechanisms of poor wound healing in diabetic ulcer.
【Key words】 ULK1;diabetes;ulcer wound;autophagy
細胞自噬是广泛存在于真核细胞生物中的蛋白质降解方式,参与维持细胞的稳态,在疾病的转归中发挥重要作用。ULK1为自噬的启动因子,主要通过磷酸化修饰而改变自身活性,影响自噬进程[1]。糖尿病溃疡创面受代谢紊乱的影响,愈合效率低下,然而其潜在机制尚未完全明了,本实验通过观察糖尿病状态下自噬水平的变化,探讨糖尿病溃疡创面愈合不良的机制,以期为糖尿病溃疡创面治疗方法的开发及应用提供理论依据。
1 材料与方法1.1 实验动物 SPF级Wistar雄性大鼠18只,3月龄,体重230~260 g,由长沙市天勤生物技术有限公司提供。该实验经右江民族医学院动物伦理委员会批准。
1.2 主要试剂 链脲佐菌素(Streptozocin,STZ):北京华越洋生物科技有限公司生产;水合氯醛:成都市科龙化工试剂厂生产;ULK1-Antibody、p-ULK1(phospho S758)-Antibody:Abcam公司生产;山羊抗兔Ig、β-actin抗体:北京中杉金桥生物技术有限公司生产;ULK1、β-actin引物:上海捷瑞生物工程有限公司合成。
1.3 方法
1.3.1 实验动物分组及糖尿病创面模型的建立 大鼠予适应性喂养1周后随机分为对照组、模型组,每组9只。对照组大鼠在背部行约2.5 cm×2.5 cm面积大小全层皮肤切除;模型组予高脂饮食4周,禁食16小时后腹腔注射STZ,1周后大鼠出现多饮、多尿、体重减少等糖尿病症状且空腹血糖≥16.7 mmol/L为糖尿病大鼠模型建立成功。糖尿病大鼠造模成功后作全层皮肤切除,即完成糖尿病创面大鼠模型的建立[2]。
1.3.2 标本采集与处理 各组于创面模型建立后第1天、第11天、第18天共3个时间点各随机取3只大鼠,腹腔注射麻醉,采集造模区创面组织后将大鼠处死。将采集到的样本之一用10%福尔马林固定制作HE染色切片,其余样本置于-80℃冰箱保存,待行qRT-PCR和Western blotting检测。
1.3.3 HE染色观察病理改变 创面组织固定48小时后依次脱水、透明、浸蜡包埋、切片、烤片、HE染色制片,光学显微镜下观察炎症细胞浸润、肉芽组织生长及再上皮化情况。
1.3.4 Western blotting法检测ULK1、p-ULK1的表达水平 液氮研磨待检组织,加组织裂解液充分裂解,提取总蛋白,测定总蛋白质浓度并计算蛋白质上样量。制作SDS-PAGE凝胶,上样,电泳、转膜、封闭后4 ℃孵育一抗过夜,PBST洗膜3次,然后加入二抗,室温下孵育60 min,PBST洗膜3次后显影,使用Image J软件分析蛋白质条带的灰度值。
1.3.5 qRT-PCR分析ULK1 mRNA的表达 以未建立模型(空白组)的大鼠背部皮肤组织作为对照样本,液氮研磨待检组织,按照组织提取RNA的方法提取总RNA,测定总RNA的浓度及质量。将质量合格的总RNA作为反转录的模板,合成cDNA,然后以cDNA为模板,进行PCR扩增,结果使用公式:F=2- Ct转换。
1.4 统计学方法 所有数据使用SPSS 17.0软件进行统计分析,实验数据符合正态分布用均数±标准差(±s)表示,采用两因素重复测量方差分析进行比较,检验水准:α=0.05,双侧检验。
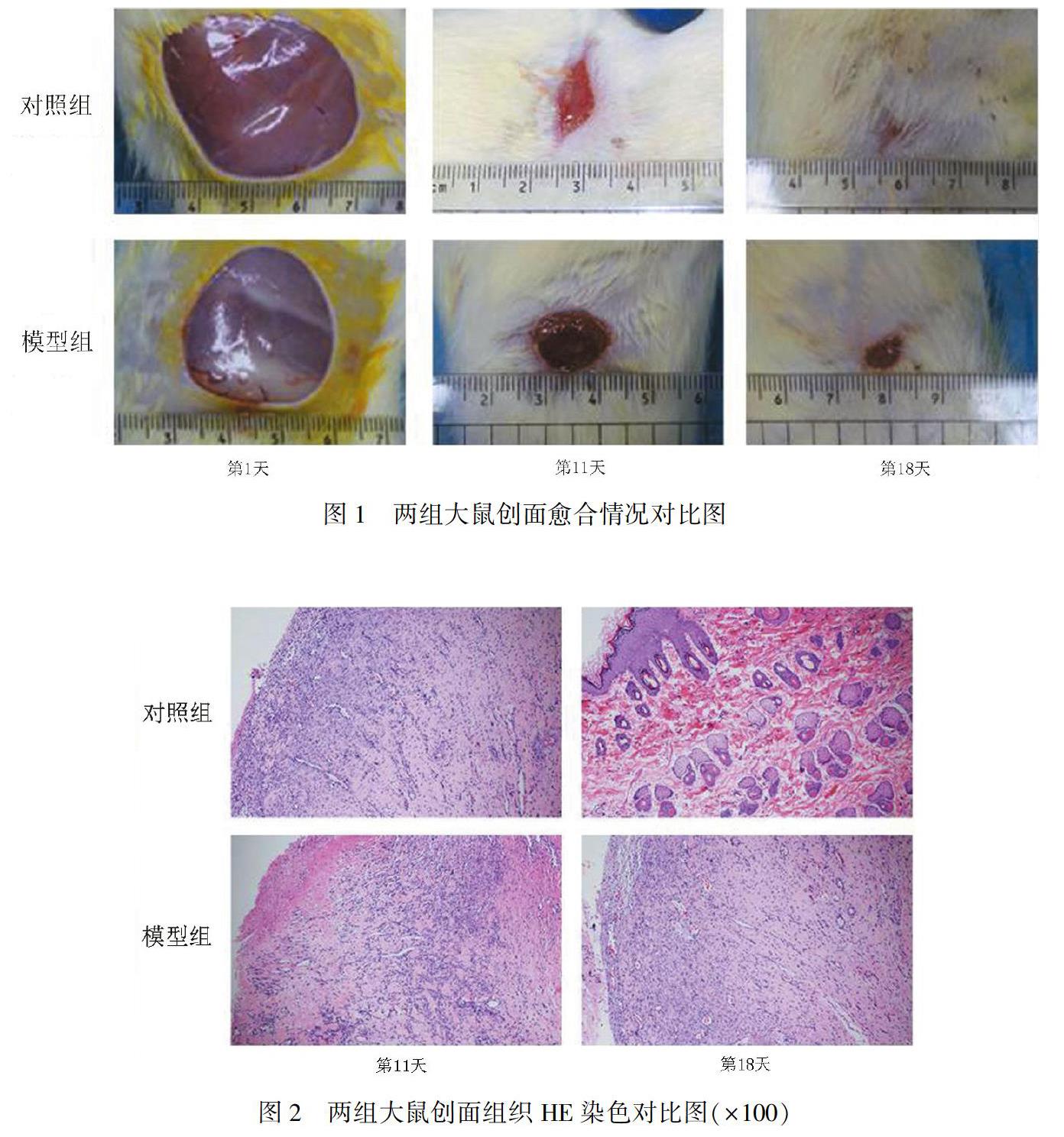
2 结 果2.1 创面愈合情况及组织病理改变 第11天,两组大鼠肉眼可见创面红润,大片肉芽组织,镜下可见炎症细胞浸润,大量成纤维细胞及毛细血管形成,但对照组肉芽组织长势优于模型组,炎性浸润轻于模型组。第18天,对照组大鼠创面基本愈合,仅留一点状疤痕,镜下可观察到完整表皮及皮肤附属器;模型组大鼠创面可见颗粒状肉芽组织生长,镜下仍可见到少许炎症细胞浸润及广泛分布的毛细血管网,但均较第11天明显减少(图1~图2)。
2.2 ULK1、p-ULK1蛋白检测结果 两因素重复测量方差分析显示,组间因素和时间因素的交互作用对ULK1表达的影响有统计学意义(P<0.001),即对照组和模型组中ULK1的表达均随时间的变化而改变,对照组和模型组中ULK1的表达均升高后下降,第11天的表達量最高,第1天的表达量最低,第1天、第11天,模型组ULK1表达低于对照组,第18天,模型组ULK1表达高于对照组(P<0.05)。组间因素和时间因素对p-ULK1表达的影响不存在交互作用(P=0.056),p-ULK1在对照组、模型组间的表达差异无统计学意义(P=0.142),p-ULK1在创面愈合过程中各个时相点的表达差异有统计学意义(P<0.001)。见图3、表1~表2。
2.3 ULK1 mRNA检测结果 qRT-PCR检测结果显示,对照组、模型组ULK1 mRNA随时间的变化幅度不同(P<0.001),对照组ULK1 mRNA的表达升高后下降,第11天的表达量最高,第1天的表达量最低,而模型组ULK1 mRNA的表达逐渐升高后趋于平稳;第1天、第11天,模型组ULK1 mRNA表达低于对照组,第18天,模型组ULK1表达高于对照组(P<0.05)。见表3。
3 讨 论 细胞自噬是真核生物进化过程中高度保守的降解系统,在应激过程中,通过高尔基复合体或者内质网来源的双层膜结构将胞内异常蛋白和受损细胞器包裹,形成自噬体,然后与溶酶体融合形成自噬溶酶体并将其内容物降解,部分降解产物可作为营养底物参与细胞的新陈代谢以获得细胞结构和功能的稳定。ULK1的活性主要受哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex,mTORC)和腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)的调节。能量充足的情况下,mTORC1将Ser758和Ser638位点磷酸化,抑制ULK1活性;饥饿状态下,AMPK通过磷酸化ULK1、Ser317 和Ser777等多个位点激活ULK1[1],此外,ULK1亦可发生自身磷酸化(Thr180位点)而导致自噬终止[3]。研究表明,自噬参与免疫调节,促进细胞增殖、血管再生和胶原合成而在创面组织修复中发挥积极的作用[4]。
本研究显示:模型组创面愈合速度及病理改善均差于对照组,这与前期研究结果一致,糖尿病创面愈合延迟与糖尿病状态下的胰岛素抵抗(insulin resistance,IR)[5]、自主神经功能紊乱[6]、糖基化终产物(advanced glycation end products,AGEs)的堆积[7]、免疫和血管功能障碍[8]等因素相关。在创面形成早期,模型组ULK1蛋白及ULK1 mRNA的表达量低于对照组,表明糖尿病状态抑制细胞自噬,糖尿病状态下的细胞功能受损及蛋白合成不足为主要影响因素。高糖环境下,线粒体和溶酶体功能受损,促进活性氧(reactive oxygen species,ROS)的产生,并阻断自噬流[9]。p38/MAPK作为调节基因表达的蛋白激酶,具有促进自噬相关蛋白 (autophagy-related protein,Atg)基因转录的功能,高糖暴露下,p38/MAPK途径受抑制并伴随自噬失活[10],此外,相关研究表明,高血糖对自噬的损害与赖氨酸63泛素化蛋白(lysine63 ubiquitinated proteins,Lys63-Ub)的积累[11]及时钟基因Bmal1的表达抑制[12]有关。在创面愈合过程中,对照组大鼠自噬水平呈先升高后降低的趋势,推测为创面形成早期,在应激及创面缺血缺氧的诱导下,mTORC1受抑制,ULK1去磷酸化,从而激发自噬活性,随着新生血管形成,缺血缺氧改善,mTORC1抑制解除,ULK1磷酸化水平升高,引起自噬抑制。由于模型组在创面形成晚期尚未愈合,细胞仍处于能量缺乏状态,因此其第18天的自噬水平无明显降低,较对照组具有更强的自噬诱导作用,从而表现为模型组ULK1蛋白及ULK1 mRNA的表达量高于对照组。该结果也表明,创面愈合过程中,饥饿状态对自噬的诱导作用远大于糖尿病状态对自噬的抑制作用。关于p-ULK1在对照组、模型组中表达无显著性差异的实验结果,我们认为,ULK1的活化涉及其分子结构中多个位点的磷酸化与去磷酸化,此外,泛素化[13]、乙酰化[14]等修饰亦被认为参与其中,可见,ULK1的活化机制十分复杂。本实验中使用Ser758位点磷酸化的p-ULK1抗体,推测在糖尿病状态下,Ser758位点的去磷酸化在ULK1的活化中并不起主导作用,尚存在其他协同机制,与上述机制共同作用,引起ULK1的活化进而诱发自噬。
综上所述,糖尿病状态抑制创面组织细胞自噬,可能为糖尿病溃疡创面愈合延迟的机制之一。由于实验设计有限,有待通过在药物干预下对比观察相关自噬分子的变化以进一步证实。
参 考 文 献
[1] DOSSOU A S,BASU A.The emerging roles of mTORC1 in macromanaging autophagy[J].Cancers (Basel),2019,11(10):E1422.
[2] 趙亚男,刘明,张玥,等.糖尿病难愈性创面大鼠模型的建立[J].山东医药,2016,56(14):31-32.
[3] LIU C C,LIN Y C,CHEN Y H,et al.Cul3-KLHL20 ubiquitin ligase governs the turnover of ULK1 and VPS34 complexes to control autophagy termination[J].Mol Cell,2016,61(1):84-97.
[4] 麻华胆,郑爱甜,吴标良.细胞自噬在糖尿病溃疡创面愈合中作用的研究进展[J].右江医学,2020,48(2):81-85.
[5] OTRANTO M,NASCIMENTO A P D,MONTEALTOCOSTA A.Insulin resistance impairs cutaneous wound healing in mice[J].Wound Repair Regen,2013,21(3):464-472.
[6] THEOCHARIDIS G,Veves A.Autonomic nerve dysfunction and impaired diabetic wound healing:The role of neuropeptides[J].Auton Neurosci,2020,223:102610.
[7] GONG J H,DONG J Y,XIE T,et al.The influence of AGEs environment on proliferation,apoptosis,homeostasis,and endothelial cell differentiation of human adipose stem cells[J].Int J Low Extrem Wounds,2017,16(2):94-103.
[8] AHMED A S,ANTONSEN E L.Immune and vascular dysfunction in diabetic wound healing[J].J Wound Care,2016,25(Sup7):S35-S46.
[9] YUAN Y J,CHEN Y N,PENG T Q,et al.Mitochondrial ROS-induced lysosomal dysfunction impairs autophagic flux and contributes to M1 macrophage polarization in a diabetic condition[J].Clin Sci,2019,133(15):1759-1777.
[10] LI L F,ZHANG J H,ZHANG Q,et al.High glucose suppresses keratinocyte migration through the inhibition of p38 MAPK/autophagy pathway[J].Front Physiol,2019,10:24.
[11] PONTRELLI P,ORANGER A,BAROZZINO M,et al.Deregulation of autophagy under hyperglycemic conditions is dependent on increased lysine 63 ubiquitination:a candidate mechanism in the progression of diabetic nephropathy[J].J Mol Med,2018,96(7):645-659.
[12] 高文蔚,袁泉,江梦,等.高糖通过抑制Bmal1调控的自噬加重细胞缺氧复氧损伤[J].山西医科大学学报,2020,51(1):65-68.
[13] NAZIO F,STRAPPAZZON F,ANTONIOLI M,et al.mTOR inhibits autophagy by controlling ULK1 ubiquitylation,self-association and function through AMBRA1 and TRAF6[J].Nat Cell Biol,2013,15(4):406-416.
[14] LIN S Y,LI T Y,LIU Q,et al.GSK3-TIP60-ULK1 signaling pathway links growth factor deprivation to autophagy[J].Science,2012,336(6080):477-481.
(收稿日期:2020-04-06 修回日期:2020-05-06)
(编辑:梁明佩)

