利用同源重组技术构建Hoxa5、BMP6真核表达载体及共转染成纤维细胞表达
李 晶,张梦瑶,刘开东,柳 楠,贺建宁
(1.青岛农业大学 动物科技学院,山东 青岛 266109;2.曲阜市畜牧兽医技术服务中心,山东 曲阜 273100;3.青岛畜牧兽医研究所,山东 青岛 266121)
敖汉细毛羊是我国很早培育出的细毛羊品种,它主要分布在东北部地区,是我国最具有代表性的细毛羊之一[1],其羊毛是纺织工业的重要原料。敖汉细毛羊毛囊的结构和特性直接决定毛发品质和商业价值[2],毛囊拥有着相对复杂的结构,它的形成是由多种细胞来协同完成的。毛囊通过一系列的分化生长最后成为羊毛,其生长发育也有些复杂,它是由多种因子来相互调节,因此,通过研究相关因子来探讨毛囊的生长发育显得尤为重要。
Hox家族在生物体内是一类与发育调控相关十分重要的基因。Hox家族这类转录因子都是高度保守的[3],对毛囊细胞增殖分化也起着十分重要的作用[4-5]。研究发现,在皮肤和毛囊生长发育过程中Hox家族基因起到了主导作用[6],Hoxa5主导了皮肤细胞增殖、分化与凋亡[5],对毛囊退行期进行了调控,并诱导了细胞分化[7]。动物形态的进化和多样性与Hox基因数目、序列及其表达方式密切相关,已有研究结果表明,当Hox家族基因发生变化时,动物在被毛生长时会表现出缺陷[8]。BMP6基因是TGF-β超家族中的一员[9-10],TGF通路中的许多转录因子都受BMP6调控,均表现出上调和下调趋势。杨燕燕等[11]在生殖发育上对BMP6进行了研究,它控制着羊的多胎,尤其是在发情期基因表达相当明显。也有研究表明,BMPs通路中的转录组因子对毛囊发育主要表现出抑制作用,而它的下游靶标BMPRs主要表现出促进的作用[12-13]。程旭等[14]通过对铁调素在BMP6-HJV-SMAD信号通路的作用,验证了BMP6的重要性。由此可见,Hoxa5和BMP6基因都能抑制毛囊生长,但二者之间的关系鲜有报道。
对于家畜皮肤毛囊的一些研究大多集中在单个基因的功能验证上,还有一些是与骨的调节、繁殖等与皮肤毛囊无关的研究,本试验主要的侧重点是利用同源重组技术构建表达载体通过与单、共转染比较基因表达量的变化来研究Hoxa5和BMP6之间的作用关系,旨在为更深层次上研究毛囊功能基因奠定基础。
1 材料和方法
1.1 试验材料
健康的30日龄胎羊由青岛畜牧所奥特种羊场提供;TRIzol、KpnⅠ、倒置显微镜、荧光定量PCR等均购自Bio-Rad公司[9]。
1.2 试验方法
1.2.1 引物设计 选取绵羊Hoxa5基因(GenBank登录号为NM-001009431.1)CDS区 和BMP6基因(GenBank登录号为NM-001110277.1)CDS区,软件导入pcDNA3.1表达载体的序列,通过Snap Gene设计Hoxa5基因和BMP6基因上下游引物,序列分别如下:
F(Hoxa5):5′-ATGCGTTAACTCAGGAATCGGATGCATCGGTCAAGCTGGCAT-3′;R(Hoxa5):5′-TGGCCTTAAAATCTCCGAGGAAATACTCGCTCACGCGGTAG-3′。F(BMP6):5′-TTACGGGCATCGGTAGGGAAATTCGTATTGCATGCAAAGCT-3′;R(BMP6):5′-TGTCCGAGACCTGCACATCCACGGCGGCCCTTCAGCATACCCCTA-3′。扩增体系:20 μL,cDNA 1 μL,上下游引物各1 μL,Mix 17 μL。
1.2.2 pcDNA3.1与Hoxa5、BMP6基因同源重组 对Hoxa5、BMP6进行切胶,用KpnⅠ对pcDNA3.1进行单酶切,体系:KpnⅠ 1 μL,pcDNA3.1 5 μL,Buffer 5 μL,ddH2O 39 μL。通过电泳对BMP6、Hoxa5基因片段及pcDNA3.1进行胶回收,SoSo连接体系:BMP6、Hoxa5基因上、下游引物各1 μL,pcDNA3.1 1 μL,SoSo 5 μL,ddH2O 3 μL,转化DH5α,过夜对菌液进行振荡培养,将菌液生长良好的送往公司进行测序[12-13]。
1.2.3 胎儿成纤维细胞培养 在细胞室将30日龄胎羊从母羊子宫内取出,先用75%的酒精对胎儿进行消毒,再用PBS将胎儿表面的酒精冲洗掉。在培养皿中用手术刀将胎儿的头部和四肢、内脏等全部剔除,只用胎羊的躯干,将其剪碎,分布在培养皿中,在每一个肌肉块上面加2滴已经预热的胎牛血清,放进CO2培养箱(37 ℃,5.0% CO2),24 h对其进行观察并且换液[15-16]。
1.2.4 细胞转染 细胞进行传代以后,等密度再次达到95%左右时,借助转染试剂对重组的载体进行瞬时转染。取脂质体20 μL,PBS 480 μL,加入到无菌的离心管中并混匀,静置5 min。进一步进行转染,转染时分为2组,分别是共转染组和单转染组,共转染组中加入Hoxa5、BMP6质粒各20 μL,单转染组加入Hoxa5质粒40 μL或者BMP6质粒40 μL,2组均加入PBS 460 μL,具体详细操作步骤参照Lipofectamine2000说明书[17]。
1.2.5 细胞转染后的qPCR 重组载体转染成纤维细胞后需要进一步的增殖培养,当密度达到95%左右时,对成纤维细胞的RNA进行提取,并将其反转录成cDNA[18]。使用Snap Gene软件对Hoxa5、BMP6和GAPDH基因进行qPCR引物设计,序列见表1。

表1 引物信息Tab.1 Primers information
qPCR反应条件:95 ℃反应7 min;95 ℃ 40 s,60 ℃退火40 s,35个循环;72 ℃ 30 s,4 ℃保存。每组3个生物学重复,对数据利用Ct(2-ΔΔCt)公式进行计算,得出Hoxa5、BMP6的相对表达量。借助SPSS 20.0软件对数据进行差异显著性的分析,以P<0.01作为差异显著性判断标准[17]。
1.2.6 Hoxa5、BMP6蛋白表达的检测 提取成纤维细胞中的组蛋白,进行Western Blot,首先进行转膜,后进行封闭,时长2 h;进行一抗、二抗的孵育,均对抗体进行2 000倍的稀释。孵育完成后利用1∶1的曝光液进行曝光拍照[17]。
2 结果与分析
2.1 Hoxa5、BMP6基因PCR扩增
以cDNA为模板,添加引物进行PCR 扩增获取Hoxa5、BMP6基因片段。1%琼脂糖凝胶电泳结果表明(图1),Hoxa5基因条带在图中804 bp处,BMP6基因条带在图中537 bp处,都与目的基因CDS区大小吻合,可用于后期的试验。

M.2000 Marker;1.Hoxa5基因扩增片段(804 bp);2.BMP6基因扩增片段(537 bp)。M.2000 Marker;1.Hoxa5 product(804 bp);2.BMP6 product(537 bp).
2.2 pcDNA3.1表达载体酶切纯化
使用KpnⅠ将pcDNA3.1表达载体从环状酶切成链状,用1%琼脂糖凝胶电泳检测是否酶切成功(图2)。1,2是对pcDNA3.1的KpnⅠ单酶切,pcDNA3.1长度为5 428 bp,图中条带所在位置约是5 428 bp,结果显示酶切完成,回收条带进行重组。
图2 pcDNA3.1载体单酶切鉴定Fig.2 Single enzyme digestion identification of pcDNA3.1 vector
2.3 pcDNA3.1表达载体的重组及鉴定
将pcDNA3.1酶切成链状后,用SoSo试剂盒将BMP6、Hoxa5分别与pcDNA3.1相连接,转化,振荡培养,进行菌液PCR验证如图3所示,在约804 bp处有明亮电泳条带,是Hoxa5基因;537 bp处的是BMP6基因。菌液测序结果用Blast进行对比,结果如图4,说明BMP6、Hoxa5没有碱基的突变,已成功的连接到pcDNA3.1载体上。将连接好的重组载体从菌液中提取出来,如图5所示,1-2为pcDNA3.1-BMP6重组质粒,大小为5 965 bp,3-4为pcDNA3.1-Hoxa5重组质粒,大小为6 232 bp,与图中条带相符。

M.2000 Marker;1,4.BMP6菌液PCR;2,3.Hoxa5菌液PCR。M.2000 Marker;1,4.BMP6 bacterial PCR;2,3. Hoxa5 bacterial PCR.
2.4 细胞培养观察
对胎儿成纤维细胞的生长情况进行观察记录(图6),24 h能够观察到细胞已经开始贴到培养皿底部,周围也有一些漂浮的组织。培养至96 h后,密度再次达到95%左右,此时即可对原代细胞进行传代[18]。
2.5 RT-PCR检测Hoxa5、BMP6基因mRNA表达
对引物进行验证,1%琼脂糖凝胶电泳结果(图7)表明,引物扩增效果良好,没有出现二聚体等杂物,在128 bp 处的是内参基因GAPDH,在186 bp处的是Hoxa5基因,在116 bp处的是BMP6基因,综上可得引物均可用于实时荧光定量PCR试验。

图4 BMP6(上)和Hoxa5(下)表达载体菌液的测序比对Fig.4 Sequencing comparison of BMP6 (up) and Hoxa5 (down) expression vector bacilli
M.10000 Marker;1-2.pcDNA3.1-BMPR6;3-4.pcDNA3.1-Hoxa5。M. 10000 Marker;1-2. pcDNA3.1-BMPR6 recombinant plasmids;3-4. pcDNA3.1-Hoxa5 recombinant plasmids
图 8,9分别为Hoxa5、BMP6和GAPDH的qPCR过程中的扩增曲线、熔解曲线,两线效果显示均良好,在qPCR过程中没有出现非特异性产物。对2组的mRNA表达进行差异显著性分析(图10),分析显示Hoxa5与BMP6共转染后的Hoxa5基因相对表达量极显著低于单转染(P<0.01),而共转染后的BMP6基因相对表达量在共转染却极显著高于单转染(P<0.01)。

图6 成纤维细胞原代(左)、传代(右)培养(×100)Fig.6 Primary (left) and passage (right) culture of fibroblasts (×100)
A:M.500 Marker;1-2.内参基因GAPDH;B:M.500 Marker;1-2.目的基因BMP6;C:M.500 Marker;1-2.目的基因Hoxa5。A:M.500 Marker;1-2 .Reference gene GAPDH;B:M. 500 Marker;1-2.Target gene BMP6;C:M.500 Marker;1-2. Target gene Hoxa5.

图8 Hoxa5、BMP6和GAPDH 熔解曲线Fig.8 Hoxa5,BMP6 and GAPDH melting curves

图9 Hoxa5、BMP6和GAPDH扩增曲线 Fig.9 Hoxa5, BMP6 and GAPDH amplification curve
2.6 Hoxa5、BMP6蛋白表达的检测
对Hoxa5、BMP6基因的共转染、单转染蛋白的表达(图11)进行比较分析,从灰暗度以及条带的大小,使用ImageJ和SPSS软件进行分析,Hoxa5与BMP6共转染后的Hoxa5蛋白表达量极显著低于单转染过程(P<0.01),而共转染的BMP6蛋白表达量却极显著高于单转染过程(P<0.01)(图12),这与mRNA相对表达量的结果一致。

不同大写字母表示差异极显著(P<0.01)。图12同。Different capital letters indicate extremely significant difference(P<0.01).The same as Fig.12.

图11 Hoxa5、BMP6蛋白表达 Fig.11 Hoxa5 and BMP6 expression protein
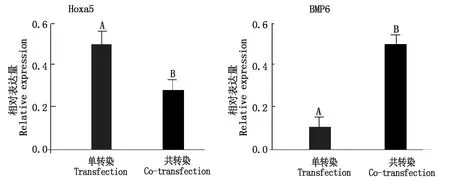
图12 Hoxa5、BMP6蛋白相对表达量Fig.12 Relative expression of Hoxa5 and BMP6 protein
3 讨论
许多研究表明,毛囊的发育依靠一系列的信号分子,这些信号分子在真皮细胞和上皮细胞间穿梭着,介导了这2个细胞群体间的相互作用,毛囊能够稳定的进行发育全靠这两者的介导。毛囊的形成过程中离不开所谓的原始信号,此信号来源于真皮下[18],并且在真皮下去激活Wnt信号[19-20]。目前,许多信号通路都参与毛囊的发育,最常见的有Wnt通路、FGF家族、BMP家族、TGF家族[21]等。Botchkarev等[22]利用小鼠来研究BMPs在皮肤中的表达位置以及表达时期,表明BMPs家族基因对毛囊的发育存在着一定的抑制作用。BMP6基因和BMP4一样同属于BMP家族,是一种抑制毛囊发育的信号分子,Hoxa5基因是TNF家族中尤为重要的基因,同样也是一种抑制毛囊发育的信号分子,两基因对毛囊的发育均有抑制作用[23]。在信号通路中,BMP家族中的信号分子对TNF通路中信号分子有干涉作用,有些是辅助基因的表达,有些是抑制基因的表达。现在对单个基因功能的验证普遍存在,多个基因相互作用还是尤为少见,本研究通过利用同源重组手段来验证多基因相互之间的作用,帮助筛选相关基因,有助于后期育种和羊毛生产。
为探讨Hoxa5、BMP6基因在细胞水平上是否存在互作效应,本研究利用同源重组技术,快速构建了pc-DNA3.1-Hoxa5、pc-DNA3.1-BMP6表达载体,并通过共转染、单转染后基因mRNA、蛋白表达量的比较分析,发现Hoxa5基因有促进BMP6基因表达,BMP6基因有抑制Hoxa5基因表达的现象。本研究在构建表达载体过程中所用同源重组技术较传统的T克隆技术节约了时间,减少了碱基突变;同时由分子水平到细胞水平得到了Hoxa5和BMP6基因的互作关系,一方面验证了与羊毛生长有关的基因,为信号通路的解析添加了论证,另一方面为进一步在个体水平上验证其功能奠定基础。

