基于能量分析的天然气新型利用方式研究
卢添天 闫秋会 侯彦万
西安建筑科技大学建筑设备科学与工程学院
0 引言
天然气在世界能源结构中占据重要地位[1]。本文研究了天然气超临界水氧化这一新型技术。利用超临界水体系中,氧气、空气、过氧化氢、水及绝大多数有机物可以任意比例互溶,气液相界面消失这一特性[2-3],消除了传质传热阻力,加快了反应速度,可在几秒至几分钟内将有机物彻底氧化降解为CO2,H2O,N2及其他化合物[4]。因而与传统直接氧化技术相比,超临界水氧化技术具有节能、高效、环境友好等特点。
本文对比了天然气的直接氧化和超临界水间接氧化这两个反应过程,基于能量品位理论,利用图像火用分析法研究了甲烷的间接氧化能量梯级释放过程,并与实际应用进行热效率、火用效率进行对比,以期为甲烷在超临界水氧化这种新技术的进一步发展提供理论依据。
1 天然气的直接氧化和间接氧化过程
1.1 天然气的直接氧化
天然气的直接氧化指天然气在空气中燃烧,一般用于燃汽轮机。天然气分子按自线轨迹不断运动,运动速度和温度成正比,温度越高分子量碰撞越频繁剧烈。温度上升到650 ℃左右时,分子获得足够的速度与能量,破坏氧的双键结合,并使天然气分子的氢与中心碳的连接断开,此时处于一种很不稳定的状态,由于碳、氢对氧都有很高的亲和力,从而开始燃烧[5]。反应式如下

甲烷作为天然气的主要成分,虽是一种优质洁净燃料,但在燃汽轮机发电过程中,燃烧的绝热温升由初始的空气/燃料决定。在甲烷常规燃烧的可燃范围内(5%~15%),火焰绝热温度超过2000 ℃,将促使空气中的N2与O2发生反应,导致大量热力NOx的生成。同时由于空/燃较低,甲烷不能完全燃烧,还将产生大量的CO。另外,燃气轮机也难以长时间承受如此高的温度[6]。同时天然气中的其他成分H2S 和N2也会在直接燃烧时生成SO2和NO2污染大气。
1.2 天然气的间接氧化
Brock[7]等构建了C、H 化合物在超临界水氧化中的动力学模型,其中就涉及了甲烷的氧化动力学模型。超临界水间接氧化装置通过外部热源提供能量使反应温度达到超临界状态,天然气在此环境下与氧化剂发生氧化反应。Brock 等认为反应过程中,天然气的C 先转化成CO,再转化成完全的CO2。天然气中的N2则与超临界水相融,不会产生NOx和N2O。
超临界水间接氧化装置示意图如图1:

图1 超临界水间接氧化装置原理图
天然气超临界水间接氧化过程相比传统直接燃烧天然气过程具备以下几个优点:
1)反应温度低,并且速度快。
2)可回收过程中的CO2再次利用,从而不造成大气污染。
3)不会产生传统燃烧中NO2或者H2S 等污染物。
4)产生的高温高压产物可用于发电。
Brock 等建立了甲烷超临界水氧化的模型,详细的分析了反应生成的自由基。具体主要自由基反应为以下:
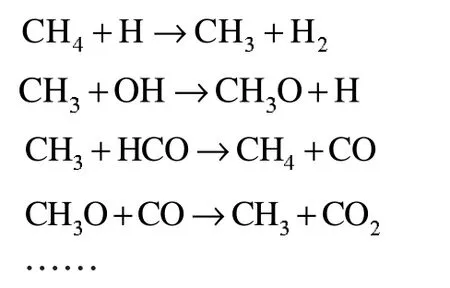
为了计算方便,本文将其简化为:
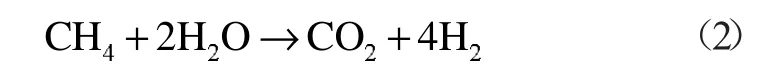
产生的H2与氧气发生简单的氧化反应:
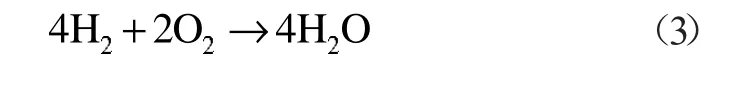
2 直接氧化与间接氧化过程能量梯级利用原理
为了明确天然气在不同氧化氛围的能量释放规律,采用能量梯级利用原理进行分析[8]。
2.1 能量梯级释放理论
Ishida 等[9]于1982 年提出图像火用分析法(EUD 分析法),以揭示内部火用损失现象。EUD 分析法中横坐标表示能量转换过程中的能的“量”,而纵坐标A 表示由能量转换过程中能的“质”,即能的品位。通过图像分别描述能量释放侧与能量接收侧能的品位随能量转化过程的变化趋势,将能量利用过程中各个子过程清晰地展现出来[10]。
本文假设化学反应均在定温条件下发生,对于氧化反应过程,可视为反应温度为T 的定温放热反应过程和反应释放出的热与工质之间的传热过程,其中环境温度T0为25 ℃。可以得到定温放热反应的Gibbs自由能变化ΔG 和火用变化ΔE[11]。

联立式(4)和(5),并引入卡诺循环效率定义式,可得ηc=1-T0/T

式中:ΔHηc表示热的最大做功能力;ΔG(1-ηc)代表燃烧火用损失,其意义为相对环境温度T0的反应的最大做功能力,即氧化反应火用损失[11]。
式(6)两边同除以ΔH 得到:
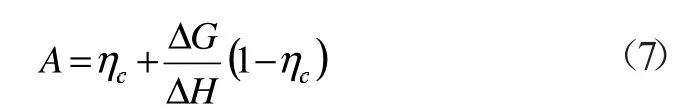
式中:A=ΔE/ΔH,表示燃料化学能品位[11-12]。
2.2 直接、间接氧化过程火用分析比较
假设甲烷在直接氧化过程中,将化学能释放给温度为1200 ℃的恒温热源(即烟气),则恒温热源热火用品位ηc1=0.798,甲烷的超临界水间接氧化将化学能释放给600 ℃的超临界水,则外热源热火用品位ηc2=0.659。
甲烷在直接氧化氛围中反应方程式:

该化学反应热ΔH1(T0)=-890.34 kJ/mol。
按式(4)、(5) 和(7) 计算反应火用变ΔE1=ΔH-T0ΔS=-817.97 kJ/mol;化学能品位A1=1;ΔG1=ΔH-TΔS=-532.63 kJ/mol。
甲烷在间接氧化氛围中的反应方程式:
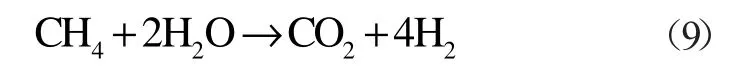
该化学反应热ΔH2(T0)=253.02 kJ/mol。
同理可得反应火用变ΔE2=ΔH-T0ΔS=130.89 kJ/mol;化学能品位A2≈0.51 ;Gibbs 自由能变化ΔG2=ΔH-TΔS=-104.75 kJ/mol。
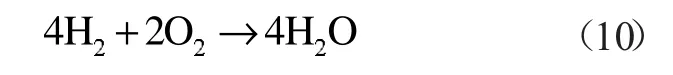
该化学反应热ΔH3=-967.32 kJ/mol。
同理可得反应火用变ΔE3=ΔH-T0ΔS=-772.83 kJ/mol;化学能品位A3≈0.80;Gibbs 自由能变化ΔG3=ΔH-TΔS=-397.54 kJ/mol。
图2 为甲烷在直接和间接氧化氛围中的能量品位和火用损失比较。甲烷的直接氧化中化学能与热火用品位之差A1-ηc1=1-0.798=0.202,而甲烷的间接氧化化学能与热火用品位之差A3-ηc2=0.80-0.659=0.141,两种氧化氛围的化学能与热火用品位之差:A3-ηc2<A1-ηc1,表明甲烷的间接氧化相比于直接氧化减少了化学能与热火用品位的差值,可以将更多的化学能转化为物理能,化学能得到梯级释放。比较火用损失,甲烷超临界水间接氧化的火用损失171.51 kJ/mol(即面积ding+面积hglm),甲烷直接氧化火用损失为179.86 kJ/mol(即面积abke)。与甲烷直接氧化过程相比,甲烷间接氧化反应火用损失减少了约4.6%。

图2 甲烷在直接和间接氧化氛围中的能量品位和火用损失比较
3 天然气的间接氧化与实际应用的对比
为证明此间接氧化确实可以减少燃烧过程中的火用损失,本文对超临界水间接氧化装置进行火用分析,并与实际燃气锅炉进行比较。
3.1 天然气超临界水间接氧化装置及热效率、火用分析
本文拟采用陕北长庆天然气,具体参数见表1[13]:

表1 氧化反应器中天然气和空气的质量平衡
本文采取水碳比为5[14]的天然气与水进行反应,即1 kg 天然气与5 kg 水进入氧化反应器。
3.1.1 氧化器能量分析
图3 为氧化反应器能量分析模型。

图3 氧化反应器能量分析模型
氧化反应器能量平衡式:
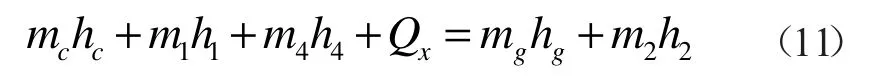
式中:mc为氧化反应器入口天然气的质量,kg;hc为氧化反应器入口天然气的焓值,kJ/kg;m1为输入氧化反应器的水的质量,kg;h1为氧化反应器入口水的焓值,kJ/kg;m4为输入氧化反应器的氧气的质量,kg;h4为氧化反应器入口水的焓值,kJ/kg;Qx为氧化反应器入口处的高压水转变为超临界水时吸收的热量,kJ;mg为反应产气的质量,kg;hg为反应产气的焓值,kJ/kg;m2为输出氧化反应器的超临界水的质量,kg;h2为氧化反应器出口超临界水的焓值,kJ/kg。
热效率η=mghg/Qx,计算得η=95.9%。
3.1.2 氧化器火用分析
图4 为氧化反应器火用分析模型。
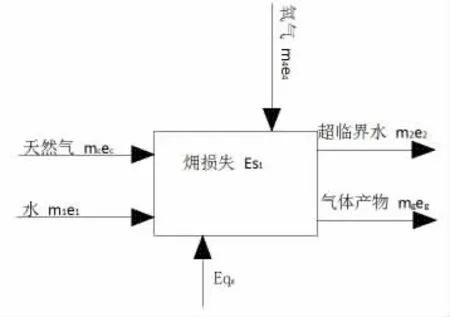
图4 氧化反应器火用分析模型
氧化反应器火用平衡式:
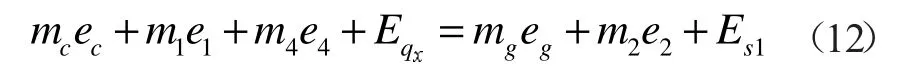
式中:ec为氧化反应器入口天然气的化学火用,kJ/kg;e1为氧化反应器入口水的物理火用,kJ/kg;Eqx为氧化反应器内高压水吸收的热量火用,kJ;eg为反应产气的火用,kJ/kg;e2为氧化反应器出口水的火用,kJ/kg。
火用效率η=mghg/eQx,计算得η=54.5%
3.2 实际燃气锅炉效率以及与超临界水氧化效率的对比
本文采用国内某油田注汽锅炉蒸汽参数[15]分析,利用“黑箱”模型分析方法,建立锅炉火用分析模型,得出某油田注汽锅炉的热效率和火用效率如图5:
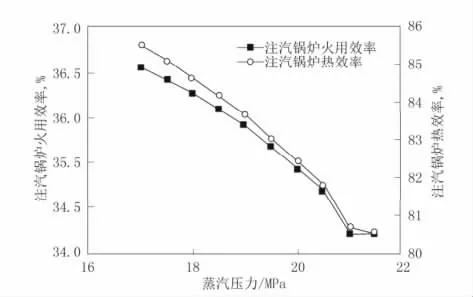
图5 蒸汽压力与锅炉火用效率、热效率的关系
从图5 中可得出,若压力高于20 MPa 后,锅炉热效率可达到82%,而火用效率仅为35%。而本文中所采用的超临界水氧化装置,热效率可达到95%,火用效率为54.5%,可见热效率和火用效率都能大幅提升。实际燃气锅炉效率低的原因是:在燃烧过程中需要考虑排烟火用损失、散热火用损失和传热火用损失,以至于整个过程中火用效率大幅降低。而本文所采取的超临界水氧化装置,通过天然气水相氧化减少了化学能品味和热源品位之差,改变了普通能量释放方式,从而可以释放更多的化学火用。
4 结论
1)分析了天然气在超临界中水氧化的反应机理,这种间接氧化过程改变了传统的氧化能量释放途径,减少了天然气化学能品位与热能品位之差,使更多的化学能转化成热能,实现了能量的高效利用。
2)根据EUD 分析法,对天然气的气相氧化和水相氧化进行了能量计算,得到天然气的气相氧化火用损失为179.86 kJ/mol,而水相氧化火用损失为171.51 kJ/mol。可见天然气水相氧化火用损失相比气相氧化减少了约4.6%。
3)分析计算超临界氧化装置的热效率与火用效率,并与普通燃气锅炉的参数比较。前者热效率为95.9%,火用效率为54.5%,而后者热效率大致为82%,火用效率仅为35%。结果表明了天然气的超临界水氧化这一过程虽热效率提高的程度不大,但大幅度减少了火用损失,从而有效地提高了火用效率。

