新疆阿魏RNA提取的不同方法比较
刘欢欢 赖晓辉

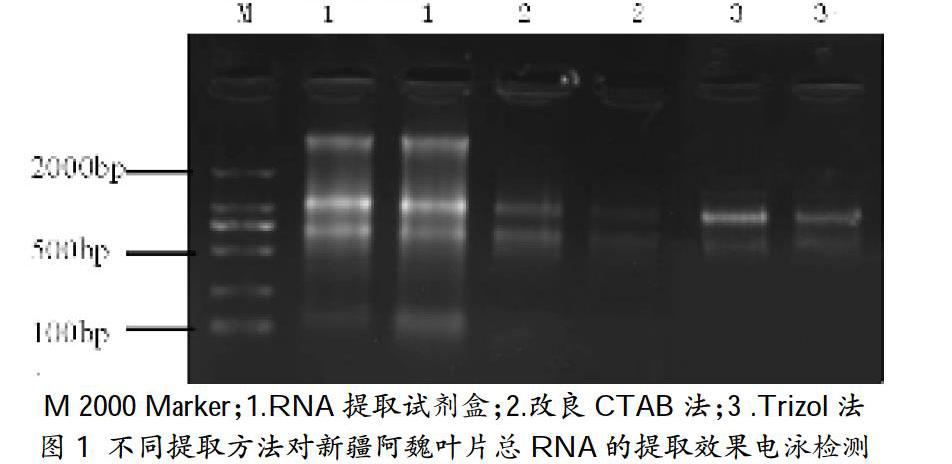

摘 要:以新疆阿魏叶片为材料,采用3种不同的方法分别提取其总RNA,用核酸蛋白检测仪、琼脂糖凝胶电泳方法检测其浓度、纯度及完整性,旨在建立提取新疆阿魏总RNA的最适方法,为后续深入研究新疆阿魏生物合成途径及机制奠定基础。结果表明:3种方法均能提取出新疆阿魏叶片总RNA。试剂盒法提取的总RNA质量最好,28S RNA亮度是18S RNA的2倍,条带清晰,操作简单,耗时短;Trizol法提取的RNA质量次于试剂盒法,且过程中无法判断次级代谢产物对RNA提取的影响,Trizol裂解液存在毒性物质;改良CTAB法提取的总RNA质量较差,无法满足下一步试验的要求,操作复杂,耗时较长。因此,试剂盒法为提取新疆阿魏RNA最佳方法。以试剂盒法提取的总RNA为模板进行PCR检测,得到的扩增条带清晰,与目的片段大小一致,进一步证明此方法提取的总RNA质量能够满足后续试验的要求。
关键词:新疆阿魏;RNA提取;比较
新疆阿魏(Ferula sinkiangensis K.M.Shen)系伞形科阿魏属植物,多年生一次结实类短命草本[1-2]。 生长于内陆干旱荒漠地区,中国仅见于新疆西部地区(现仅分布于伊犁市伊宁县喀什乡),主要用作镇静、镇痛及关节疼痛,治疗肠胃气胀等其它神经疾患。是具有重要药用价值的珍稀植物资源,为国家二级保护植物[3-4]。由于人们长期过度开采及农牧民过度放牧、偷伐盗割,加之植物种子本身存在休眠且繁殖率低,种群数量连年减少,现已极度濒危。
目前, 已经建立了不同植物的多种RNA提取方法[5-7],但关于新疆阿魏总RNA提取的研究尚未见报道。通过现代生物技术手段深入了解新疆阿魏特殊的生长规律及药用成分的生物合成途径,从而达到药用成分增产或植物保护的目的。对于特定的材料和不同的实验环境,需要从材料内次级代谢产物对总RNA提取质量产生的影响、可利用的试剂、资金等方面考虑从而做出不同的选择,对于现有的实验室条件,本试验所选取的试剂盒法,Trizol法和CTAB法仍然是提取新疆阿魏RNA不同方法的最佳对比选择。建立新疆阿魏总RNA提取的最适方法,提取高质量的新疆阿魏叶片RNA是对植物组织进行分子水平研究的必要前提,可为后续深入研究新疆阿魏生物合成途径及机制奠定基础。
1 材料与试剂
1.1 材料
4月下旬在伊宁县喀什镇拜石墩农场北向砾石质山坡新疆阿魏生长地采样,剪取新疆阿魏叶片,暂时保存在冰盒中,带回实验室立即液氮速冻,置于-80℃冰箱备用。
1.2 试剂
通用植物总RNA提取试剂盒(离心柱型)RP3301,液氮,Trizol提取液、DEPC、改良CTAB缓冲液、β-巯基乙醇、琼脂糖等及分析纯试剂。检测引物AL/AR由华大基因(北京)公司完成。
为防止RNA降解,离心步骤均在4℃下进行,提取RNA全程使用无RNA酶枪头、离心管;枪头盒、研钵、钥匙、量筒等玻璃器皿均需用0.1%的DEPC水浸泡过夜,之后121℃灭菌30min备用,实验仪器需75%酒精消毒,使用实验室提取RNA专用的电泳槽、梳子等。
2 方法
2.1 总RNA提取法
2.1.1 通用植物总RNA提取试剂盒(离心柱型)。采用北京百泰克生物技术有限公司生产的通用植物总RNA提取试剂盒(离心柱型)RP3301,RNA提取方法步骤参考说明书进行。
2.1.2 改良CTAB法。㏑1.5mL离心管中加入1mL CTAB裂解液65℃提前预热20min;②称取0.2g新疆阿魏叶片在液氮中研磨至粉末状后迅速转移至盛有1mL CTAB裂解液(加入2%β-巯基乙醇)的离心管中,震荡30~60s;③65℃温浴40min,期间晃动3~4次,4℃,12000r/min,离心15min;④取上清液,转移至新离心管中,加入等体积的氯仿/异戊醇(24︰1),抽提,4℃,12000r/min,离心15min;⑤取上清液,重复步骤③;⑥取上清转移至新离心管中,加入等体积的4mol/L LiCl,4℃沉淀过夜。⑦4℃,12000r/min离心30min后弃上清液,加400μl无水乙醇清洗2次;⑧加入40μl的RNAse-free水溶解沉淀,转移至新离心管中,加入等体积的氯仿/异戊醇(24︰1),4℃,12000r/min,离心15min;⑨取上清液,转移至离心管中,加入1/10体积3mol/L NaAc(pH=5.2)和2倍体积无水乙醇,-80℃放置30min,4℃,1200r/min,離心30min;⑩弃上清液,沉淀用400μl无水乙醇清洗2次,干燥,加入20μl的RNAse-free水溶解沉淀,并迅速放置在-20℃下保存。
2.1.3 Trizol法。操作步骤参照胡小蓉等[8]以及Trizol说明书进行。
2.2 RNA检测方法
2.2.1 微量核酸蛋白仪测定RNA浓度。分别取3种方法提取的待检测RNA 1μl,并以1μl RNase-free水为空白对照,用微量核酸蛋白测定仪测RNA浓度及OD260/OD280比值。OD260/OD280比值范围在1.8~2.1表示提取RNA质量良好;小于1.8时,RNA溶液中存在蛋白或者其他有机物的污染;大于2.1时,说明RNA出现降解。
2.2.2 总RNA电泳检测。分别取3种方法提取的待检测RNA 2μl,加入6×loading buffer 1μl,混匀后用1%琼脂糖凝胶电泳检测(电压120v,电泳15~20min),在紫外成像仪下检测完整性。条带28S和18S清晰锐利,并且28S的亮度在18S条带的2倍以上,由此认为RNA的质量良好。

