黄连素对阿尔兹海默症大鼠Th17、Treg亚群比例及脑组织炎性细胞因子的影响
周晶 董笑克 马青科 金香兰 张志辰
阿尔兹海默症(Alzheimer’s disease,AD)患者标志性病理改变为神经斑块和神经纤维缠结的产生,主要由β淀粉样肽(beta-amyloid,Aβ)沉积和磷酸化的微管蛋白Tau(p-Tau)组成,这些病理改变周围往往存在过表达的炎性细胞因子,抗炎治疗可延迟AD的进展,因此,认为AD病理损伤主要与脑内炎性反应有关。黄连素是中药黄连的主要有效成分之一,具有显著的抗炎作用,团队研究发现150 mg/kg黄连素能显著降低AD模型大鼠p-Tau表达,并改善大鼠认知及记忆功能[1],其作用机制是否与改善外周辅助性T细胞(T helper cell,Th)细胞比例,进而减轻脑组织炎性水平相关,目前尚无报道。本研究旨在探究黄连素对AD模型大鼠外周血Th17及调节性T细胞(regulatory T-cell,Treg)细胞比例的调节作用,及其对大鼠脑海马组织炎症细胞因子表达的影响。
1 材料与方法
1.1 实验动物
SPF级雄性Wistar大鼠36只,6周龄,体重220±20 g,购自北京维通利华实验动物技术有限公司,许可证编号:SYXK(京):2019-0013。饲养于北京中医药大学东方医院动物中心,饲养级别为SPF级,5只/笼,保证正常光照节律、温度适度、环境安静,正常大鼠生长繁殖饲料饲养,自由进食和饮水。
1.2 药物及试剂
盐酸小檗碱(成都锦华药业有限公司,批号:180613);Aβ25-35(美国Sigma公司,批号:053M4804V),注射前用生理盐水将Aβ25-35配制为10 μg/μL的溶液,在37℃孵育1周。大鼠抗CD3 APC(Ebioscience,货号:17-0030-82)、CD4 FITC(Ebioscience,货号:11-0040-82)、CD8 PerCP(Ebioscience,货号:46-0084-82)、CD25 APC(Ebioscience,货号:17-0390-82)、FoxP3 PE(Ebioscience,货号:12-4774-42)、IL-17A PE(Ebioscience,货号:12-7177-81)。
1.3 主要试验仪器
流式细胞检测仪(BD公司,型号:LSRⅡ);大鼠数显脑立体定位仪(北京众实迪创科技发展有限公司,型号:ZS-B/S);微量注射针(Trajan Scientific and Medical,规格:10 μL);实验动物饮水机(北京木牛流马净化工程技术有限公司,型号:MN-LM500J);酶联免疫检测仪(Bio-Tek,型号:Synergy H1)。
1.4 造模与给药方法
所有大鼠适应性饲养1周后,随机分为假手术组、模型组,黄连素组,每组12只。假手术组大鼠注射生理盐水,其余大鼠腹腔注射射D-半乳糖,100 mg/kg,每日1次,共注射6周。注射第3周时,1 %戊巴比妥钠腹腔注射40 mg/kg麻醉大鼠。在大鼠脑立体定位仪下,自颅顶前囟向后4.4 mm、旁开 2.2 mm,硬脑膜下3.0 mm,微量注射泵缓慢注射 Aβ25-3510 μg于一侧海马,留针5分钟,同样方法将等剂量Aβ25-35注入对侧海马[2]。假手术组大鼠同方法注射等量生理盐水。注射后大鼠伤口缝合,术区消毒。术后每天碘伏消毒伤口,连续3天。术中假手术组、模型组各死亡1只,死亡原因为麻醉因素。术后模型组、黄连素组各死亡1只,死亡原因为手术损伤。造模7周后进行水迷宫学习记忆能力测试,以第5天假手术组大鼠逃避潜伏期均值为参考值,若各造模大鼠平均逃避潜伏期与参考值之差占该鼠平均逃避潜伏期的比值>20%则表示造模成功[3]。模型组及黄连素组各剔除未成模大鼠2只。注射第3周开始,黄连素组大鼠给予黄连素150 mg/kg灌胃,其余大鼠给予等体积生理盐水灌胃,连续干预4周。具体流程见图1。
1.5 观察指标与检测方法
1.5.1 流式细胞计数检测外周血Th17、Treg细胞比例 末次给药结束后,大鼠禁食不禁水10小时以上,戊巴比妥钠溶液40 mg/kg腹腔注射麻醉,打开腹腔,留取新鲜抗凝血液样本,裂解红细胞,快速提取分离T淋巴细胞,CD3+、CD8-、IL-17A+标记Th17细胞,CD4+、CD25+、FoxP3+标记Treg细胞,用流式细胞仪检测各抗原的表达情况,检测Th细胞亚群比例。
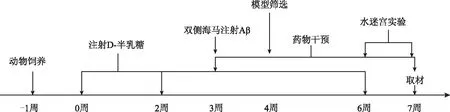
图1 动物实验操作部分流程图
1.5.2 实时荧光定量PCR(real-time PCR,RT-PCR)检测海马组织炎性细胞因子mRNA转录水平 快速摘取大鼠新鲜海马组织置于液氮中,后转移至-80 ℃冰箱保存备用。每组随机选择6例海马组织,采用RT-PCR法检测海马组织白细胞介素(interleukin,IL)-1β、IL-6、IL-17、IL-22、肿瘤坏死因子(tumor necrosis factor,TNF)-α、转化生长因子(transforming growth factor,TGF)-β mRNA转录水平,运用 2-△△CT相对定量法比较各组目标mRNA表达差异。引物序列见表1。

表1 引物序列表
1.6 统计学分析
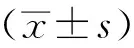
2 结果
2.1 各组大鼠外周血Th17、Treg细胞比例
用CD3-SSC设门,分析CD8-、IL-17A+细胞群比例,计算Th17细胞在总淋巴细胞中所占的比例,用CD4-SSC设门,分析CD25+、FoxP3+细胞比例。与假手术组相比,模型组Th17、Treg细胞比例升高(P<0.05),与模型组相比,黄连素组Th17、Treg细胞比例一定程度下降,其中Th17降低有统计学差异(P<0.05)。见表2、图2。

表2 各组大鼠外周血T淋巴细胞亚群比例
2.2 各组大鼠海马组织炎性细胞因子含量检测
与假手术组相比,模型组海马组织IL-1β、IL-6、IL-17、IL-22、TNF-α mRNA转录水平均显著升高(P<0.01),TGF-β mRNA转录水平显著降低(P<0.01);与模型组相比,黄连素组IL-1β、IL-6、IL-17、TNF-α mRNA转录水平均降低(P<0.05),TGF-β mRNA转录水平升高(P<0.05)。见表3。
3 讨论
现代医学研究发现,神经炎症是阿尔兹海默症的重要致病因素。促炎细胞因子的高表达也是AD的主要特征之一[4],大量研究已证实炎性细胞因子IL-1β、IL-6、TNF-α与AD病理损伤相关[5]。IL-1β是响应组织损伤首批分泌细胞因子之一,介导炎症反应、细胞增殖、分化和凋亡,在淀粉样斑块位点附近高表达[6]。 IL-1β驱动β-淀粉样前体蛋白的合成,导致β-淀粉样蛋白斑块的产生,并沉积在阿尔茨海默氏病患者的脑组织[7]。IL-1β也参与Tau蛋白磷酸化[8]。IL-6与AD的发病同样密切相关,在AD患者血清、脑脊液、皮质均可检测到IL-6升高,神经胶质细胞培养物暴露于Aβ之后也可检测到IL-6水平升高。TNF-α参与诱导急性期炎症细胞因子,在AD血清,脑脊液和皮质中升高,过表达TNF-α转基因小鼠表现出脑神经严重的炎症、神经退行性病变,甚至死亡[9]。近些年科学家逐渐发现,AD患者外周血同样存在促炎性细胞因子IL-1β、IL-6和TNF-α等高表达[10],同时AD 患者Th细胞可能参与脑组织炎性反应,Th17在AD患者外周血中比例显著高于对照组,同时在脑组织中也发现了T淋巴细胞,认为外周Th细胞可能通过受损的血脑屏障迁移进入脑组织加重中枢神经系统炎性反应[11-13]。Th17细胞可通过Fas/FasL凋亡途径直接作用于神经元。在AD模型大鼠海马组织中,IL-17水平也显著升高。Treg细胞是一类调节机体免疫耐受的T淋巴细胞亚群,在AD患者外周血中比例降低[14],在AD模型大鼠的皮层和海马中被抑制。研究表明,Treg细胞耗竭会加重AD模型大鼠认知障碍,而全身性Treg给药可改善疾病进展。TGF-β是Treg细胞合成的主要细胞因子,TGF-β表达也显著下降[15]。以上研究均提示了AD不仅与脑内炎性反应相关,与外周免疫功能同样具有重要的关系。
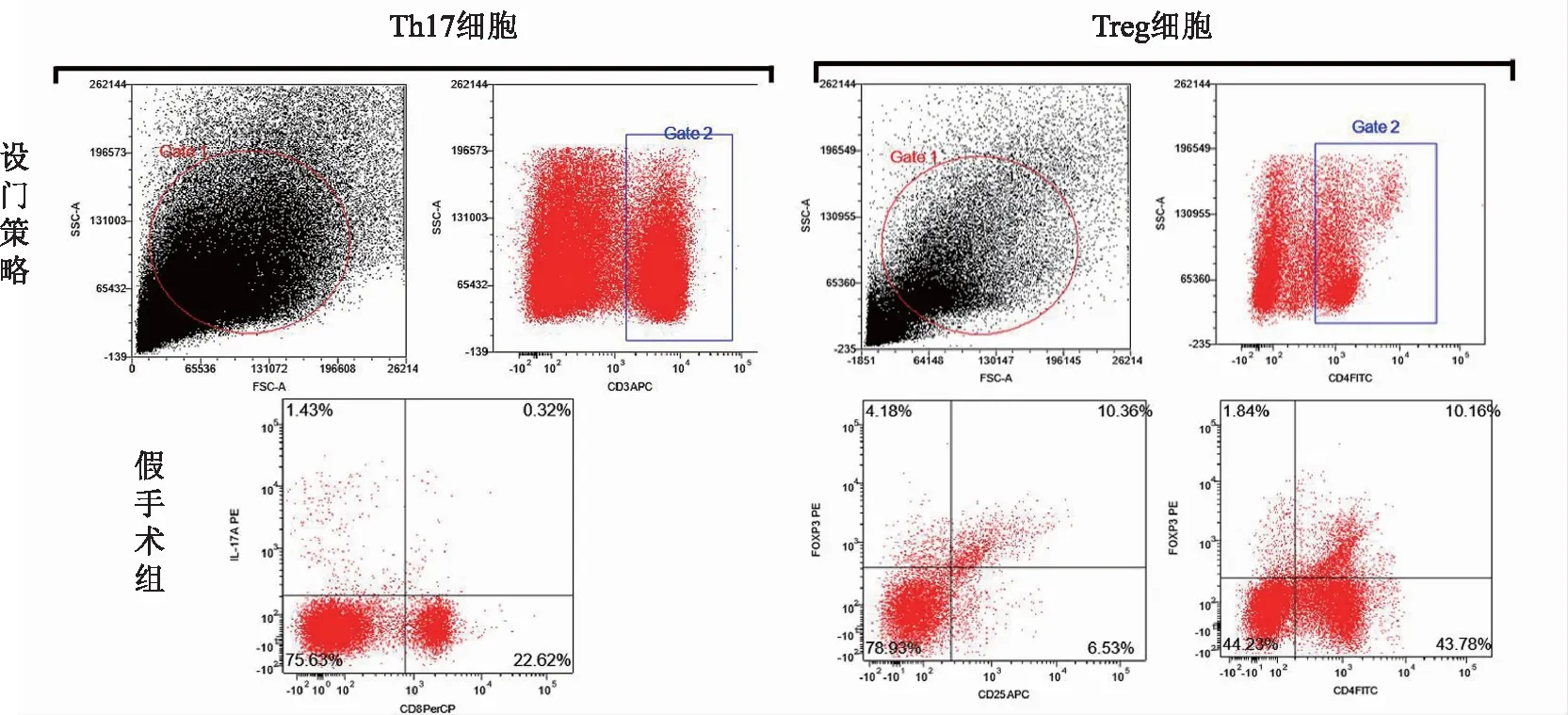
图2 大鼠外周血Th17、Treg细胞流式细胞检测结果

表3 各组大鼠海马组织炎性细胞因子含量比较
阿尔兹海默症属于中医“痴呆”“呆症”“郁证”等范畴,其主要病机为“髓海不足,神机失用”。黄连素是中药黄连提取物,黄连具有清热燥湿、泻火解毒的功效。黄连素是黄连的生物碱成分,是黄连发挥抗菌作用的主要物质成分,被广泛用来治疗肠道感染性腹泻。随着研究的深入,黄连素逐渐被证实具有降糖、降压、降脂、抗肿瘤、抗AD等作用,其作用机制与改善炎症,减少组织炎性损伤密切相关[16]。
团队在前期研究中已经发现黄连素对AD大鼠具有改善认知障碍的作用,并能显著下调p-Tau蛋白表达。结合黄连素的药理作用,及国内外AD发病机制研究进展,团队推测其治疗AD的机制可能与改善脑组织炎性状态密切相关,而黄连素并不能吸收入脑直接调控中枢神经系统的炎症状态,团队推测黄连素极有可能改善外周Th细胞比例。因此本研究中,课题组结合流式细胞检测技术,检测外周Th17、Treg细胞比例,并选择AD脑组织内具有代表性的促炎性细胞因子,以期发现外周及中枢炎症在黄连治疗AD中的作用。本研究发现,AD模型大鼠外周Th17细胞比例显著升高,Treg细胞比例显著下降,存在免疫失衡,给予黄连素后能一定程度纠正Th17/Treg免疫失衡,特别是能显著降低Th17细胞比例。与此一致的是,大鼠海马组织促炎性细胞因子转录水平显著下调,TGF-β转录上调,提示了黄连素可以调节外周Th17、Treg细胞免疫平衡,降低脑组织炎性细胞因子IL-1β、IL-6、TNF-α、IL-17基因转录,增加TGF-β基因转录,从而起到改善AD的作用。然而,黄连素作为一种口服吸收度差的药物,是如何起到调节外周和中枢炎症的,仍需进一步探索研究。团队推测黄连素可能通过改变肠道菌群,介导肠道相关淋巴组织影响外周淋巴细胞稳态,外周T淋巴细胞迁移进入脑组织,影响中枢神经组织细胞因子表达,最终起到减少炎症介质,改善AD脑损伤的作用,后续将展开一系列相关研究以进一步阐释黄连素治疗AD的机制。

