血浆同型半胱氨酸、脂联素水平与阿尔茨海默病患者认知功能障碍程度的相关性
黄勉,李琳,李芬,刘超强,邓雪梅,杨淑殷,万埝
我国65岁以上人群中痴呆患病率约为5%,其中阿尔茨海默病(Alzheimer’s disease,AD)为常见类型[1]。β-淀粉样蛋白(β-amyloid,Aβ)沉积构成的老年斑是其主要病理学特征,根据AβC末端结构将其分为Aβ40和Aβ42,于脑脊液和血液中均能检测出,脑脊液Aβ42水平下降是AD患者病理改变的重要证据[2]。高同型半胱氨酸(homocysteine,Hcy)对神经元有直接毒性,并可增强淀粉样蛋白的神经毒性[3]。脂联素(Adiponectin,APN)是一种由脂肪细胞分泌的内源性生物活性多肽,对神经元有保护作用,是痴呆的重要保护因子[4]。因此,本研究对AD患者血浆Hcy、APN水平与认知功能障碍程度之间的相关性展开分析。
1 资料与方法
1.1 一般资料
选择2014年3月至2018年3月我院收治的AD患者96例纳入AD组;选择同期在我院体检的健康志愿者30例纳入对照组。纳入标准:符合《实用内科学》[5]中AD诊断标准者;入组前未使用抗精神病药物或抗胆碱酯酶药物;知情同意者。排除标准:合并严重心血管疾病、肝肾功能异常、恶性肿瘤、颅脑外伤等疾病者;合并其他神经、精神疾病者;临床资料不全者。AD组中,男65例,女31例;年龄65~79岁,平均(76.27±5.94)岁;受教育程度为文盲36例,小学36例,中学及以上24例;根据临床痴呆评定量表(clinical dementia rating,CDR)[6]将其分为轻度AD亚组38例、中度AD亚组39例及重度AD亚组19例。对照组中,男19例,女11例;年龄65~80岁,平均(76.63±6.52)岁;受教育程度为文盲11例,小学12例,中学及以上7例。AD组与对照组的性别、年龄、受教育程度等一般资料差异无统计学意义(P>0.05)。
1.2 方法
所有受试者于入组时采集清晨空腹静脉血6 mL,离心分离血浆,采用雅培I2000化学发光免疫分析仪检测血浆Hcy水平;采用双抗体夹心酶联免疫吸附法检测血浆APN水平,试剂盒购自北京艾德莱生物科技有限公司;采用酶联免疫吸附法检测血浆Aβ40、Aβ42水平,试剂盒购自上海润裕生物科技有限公司;均严格按照试剂盒说明书的操作步骤进行。采用简易精神状态检查量表(mini-mental state examination,MMSE)[7]评估受试者认知功能障碍程度,该量表涵盖11个条目总计30分,评分越高表示精神智力状态越好。
1.3 统计学处理
采用SPSS 19.0软件,血浆Hcy、APN水平及MMSE评分等连续性资料均用平均数±标准差(±s)表示,多组间比较采用单因素方差分析,组内两两比较采用Dunnett-t检验;血浆Hcy、APN水平与MMSE评分相关性采用Pearson相关分析;以P<0.05提示有统计学意义。
2 结果
2.1 各组受试者血浆Hcy、APN水平比较
各组血浆Hcy、APN水平差异均有统计学意义(P<0.05);血浆Hcy水平重度AD亚组高于轻、中度AD亚组和对照组,中度AD亚组高于轻度AD亚组和对照组,轻度AD亚组高于对照组(均P<0.05);血浆APN水平重度AD亚组低于轻、中度AD亚组和对照组,中度AD亚组低于轻度AD亚组和对照组,轻度AD亚组低于对照组(均P<0.05),见表1。
表1 各组受试者血浆Hcy、APN水平差异(±s)
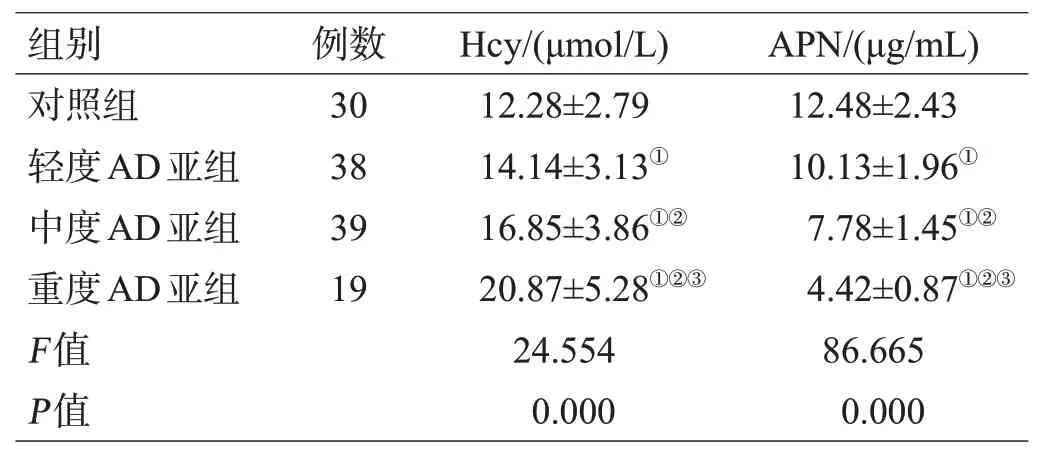
表1 各组受试者血浆Hcy、APN水平差异(±s)
注:与对照组比较,①P<0.05;与轻度AD亚组比较,②P<0.05;与中度AD亚组比较,③P<0.05
?
2.2 各组受试者血浆Aβ40、Aβ42水平及MMSE评分比较
各组血浆Aβ40水平无显著性差异(P>0.05),血浆Aβ42水平及MMSE评分差异有统计学意义(P<0.05);血浆Aβ42水平及MMSE评分重度AD亚组低于轻、中度AD亚组和对照组,中度AD亚组低于轻度AD亚组和对照组,轻度AD亚组低于对照组(P<0.05),见表2。
表2 各组血浆Aβ40、Aβ42水平及MMSE评分比较(±s)
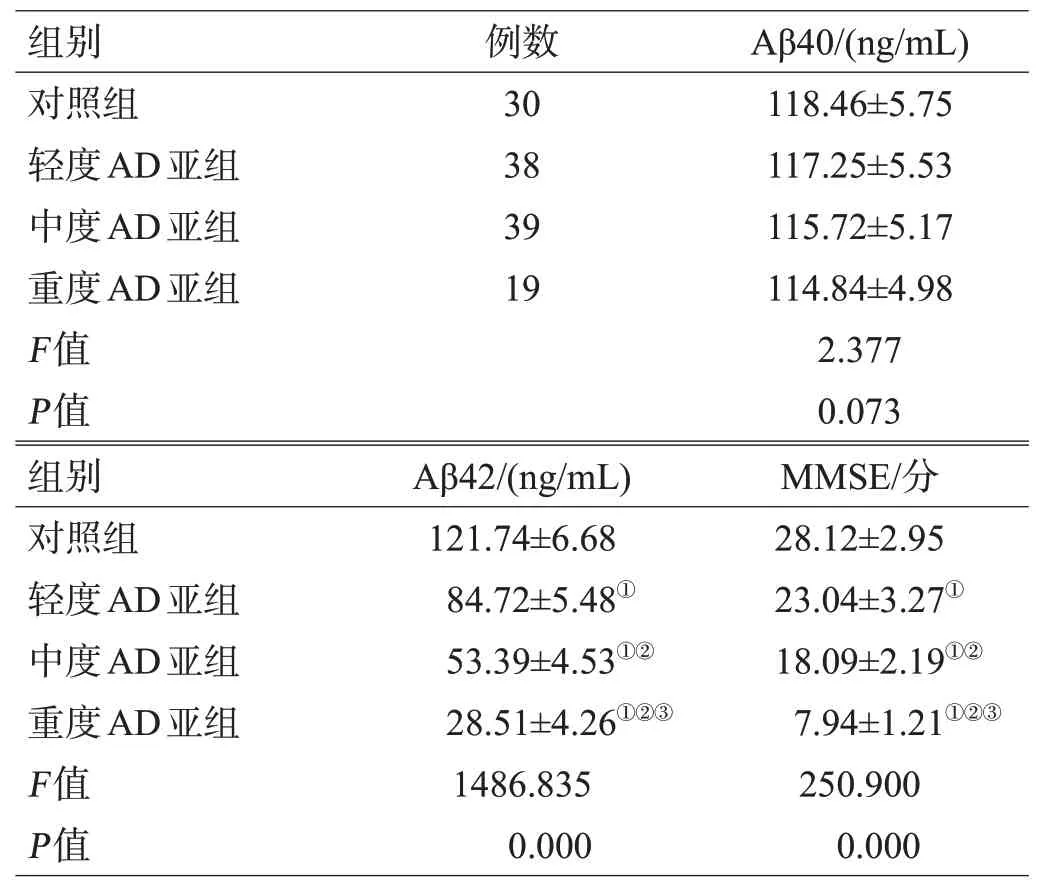
表2 各组血浆Aβ40、Aβ42水平及MMSE评分比较(±s)
注:与对照组比较,①P<0.05;与轻度AD亚组比较,②P<0.05;与中度AD亚组比较,③P<0.05
?
2.3 血浆Hcy、APN水平与AD患者MMSE评分、血浆Aβ42水平的相关性
Pearson相关分析表明,AD患者血浆Hcy水平与其MMSE评分和血浆Aβ42水平呈显著负相关性(P<0.05);血浆APN水平与其MMSE评分和血浆Aβ42水平呈显著正相关性(P<0.05),见表3。
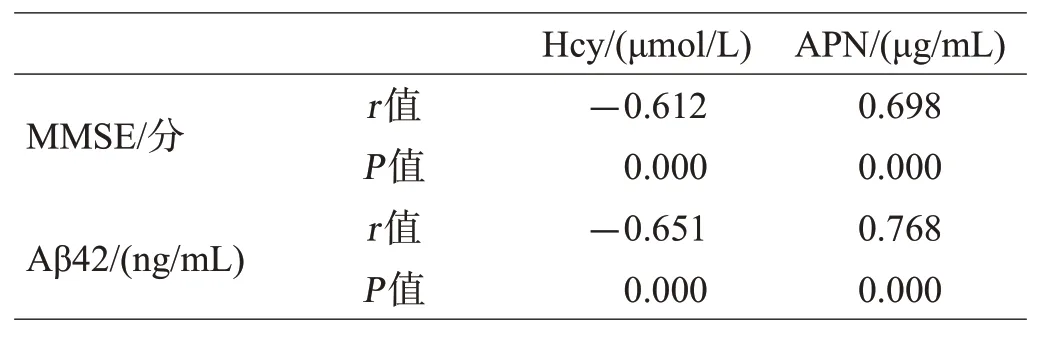
表3 血浆Hcy、APN水平与AD患者MMSE评分的相关性分析
3 讨论
AD是一组多见于老年人的中枢神经退行性疾病。Hcy是一种含硫氨基酸,是甲硫氨酸脱甲基的代谢产物[8]。APN是脂肪细胞分泌的一种对人体有保护作用的细胞因子。APN对脑神经元具有保护作用,其可通过激活腺苷酸活化蛋白激酶(AMP-activated proteinkinase,AMPK)途径降低体内的活性氧水平,明显减轻海仁酸引起的小鼠海马神经元兴奋性中毒[12]。本研究中,血浆Hcy水平重度AD亚组高于轻、中度AD亚组和对照组,中度AD亚组高于轻度AD亚组和对照组,轻度AD亚组高于对照组;血浆APN水平重度AD亚组低于轻、中度AD亚组和对照组,中度AD亚组低于轻度AD亚组和对照组,轻度AD亚组低于对照组;表明血浆Hcy水平升高及APN水平降低与AD病情进展存在一定联系。
Aβ为呈β型折叠的三维空间结构,具有较强自聚性,极容易形成难溶解的沉淀,其主要有Aβ40、Aβ42 2种形式,脑内Aβ42水平虽低于Aβ40,但更容易聚集形成沉积,是AD脑组织内老年斑形成的主要病理因素[9]。本研究也显示,AD患者血浆Aβ 42水平及MMSE评分随病情加重逐渐降低,显著低于对照组。Aβ产生增加沉积将导致或加重老年斑的形成,海马神经元对Aβ诱导的脑损伤的敏感度及对兴奋毒性和氧化损伤的易感性增加将导致海马神经元损害,造成认知、记忆等功能损害,引起AD及导致AD病情进展。
同时,本研究显示,AD患者血浆Hcy水平与其MMSE评分和血浆Aβ42水平呈显著负相关性,血浆APN水平与其MMSE评分和血浆Aβ42水平呈显著正相关性,表明血浆Hcy水平升高、APN水平降低与AD患者认知功能障碍加重密切相关。Dayon L等[10]研究发现,Hcy可通过诱导Herp蛋白和PS1、PS2反应使Aβ产生增加,并可增加海马神经元对Aβ诱导的脑损伤的敏感度。动物实验研究表明,Hcy可能参与神经变性病发病机制,高血浆Hcy可导致大鼠海马神经元的凋亡并显著提高海马神经元对兴奋毒性和氧化损伤的易感性[11]。Yoon G等[13]研究还发现,APN通过参与脂质代谢,调节脂质代谢异常引起的具有神经表型特点的溶酶体储存障碍,从而减少Aβ的产生和堆积。APN对海马神经元的保护作用以及对Aβ的产生、堆积的抑制作用均对AD病情改善有重要意义。Pákáski M等[14]研究也发现,服用多奈哌齐的AD患者血浆ANP显著升高,认知功能显著改善,亦说明血浆ANP水平升高对AD患者认知功能具有保护作用。
综上所述,AD患者随病情加重血浆Hcy水平显著升高,血浆APN水平显著降低,其与AD患者认知障碍程度密切相关,检测该指标对评估患者病情、指导临床治疗有一定价值。

