质量控制对免疫检验的应用效果
迟 玥 寇筱囡
(大庆油田总医院,黑龙江大庆 163001)
免疫系统的组成部分包括免疫器官、细胞与分子等,免疫细胞经由血液循环传递至各个组织与器官,维持正常的免疫功能。免疫检验是多种疾病类型的常规检验技术,通过对T 细胞抗原受体的定性与定量分析,评价免疫应答能力,进而帮助疾病的诊断[1]。其检验环节复杂,检验结果受多种因素影响,需要严格执行质量控制。通过对检验过程的质量控制能够全面评估结果的准确性。常规检验仅根据相关标准执行检验操作,需加用系统性质量控制。本研究选取207 例免疫检验患者,分析质量控制应用于免疫检验的价值。
1 资料与方法
1.1 一般资料
选取大庆油田总医院 2017 年 1 月至 2019 年2 月接受免疫检验的207 例患者为研究对象,按照随机数字表法分为A 组(102 例)和B 组(105 例);A 组行常规检验,B 行质量控制。A 组患者男性55 例,女性47 例;年龄26 ~67 岁,平均年龄(39.54±0.42)岁;体质量42 ~89 kg,平均体质量(56.24±1.57)kg。B 组患者男性57 例,女性48 例;年龄24 ~68 岁,平均年龄(39.41±0.34)岁;体质量44 ~87 kg,平均体质量(56.18±1.34)kg。2 组患者一般资料比较差异无统计学意义(P >0.05),具有可比性。本研究经大庆油田总医院伦理委员会批准。
1.2 方法
2 组的检验方法均为酶联免疫吸附法(ELISA),A 组采用常规检验:将标本置于无菌玻璃试管内,选用真空分离胶采血管和一次性抗凝管,将标本置于室温环境下,用全自动生化分析仪对其进行免疫检测。所有操作根据仪器和配套试剂说明进行。B 组行质量控制。
(1)标本采集等质量控制
标本采集时,应控制标本质量。询问患者有无激素用药史,因为激素水平与时间具有相关性,如甲状腺激素的血液峰值时间是夜间10~11点,而谷值时间为日间10点。若医生过早采集血清,则会出现误差。为此,应将时间因素纳入到标本采集和保存规范中。若标本无法立即检测,则应预处理,合理保存,具体保存方式与时间根据检验目的、标本类型而定。检验分析前,规范标本采集时间,正确使用止血带,保持正确的采血姿势。
(2)仪器设备核定
核对与校正免疫检验仪器,如水浴箱、温度计和酶标仪等,定期检查吸管或是稀释棒等设备的功能性,减少检验误差。
(3)检测环境控制
检验室内的温度和湿度需合理调整,根据标本情况而定。待测标本需与标本基质一致,药物检测浓度需与实验水平一致。期间应保证检验过程严格按照说明书进行,避免污染等危险因素。
(4)试剂选择质量控制
检查试剂的保存条件与日期,不可频繁使用多个厂家试剂盒。配置好试剂后,对其进行鉴定,保证试剂合格。选购试剂时严格执行验收制度,禁止采购多家试剂盒。若必须更换厂家,则要进行比对试验,检查试剂的有效期,并根据要求保存试剂。定期组织检验人员接受业务培训,优化其专业能力,最大化规避认为因素对检验结果的影响。
(5)操作流程质量控制
检验期间出现失控现象,需中止检验,查明失控原因是偶然误差还是操作因素,再对标本进行重新检验。重测后,检验结果误差大,则再次检验,需校正仪器,或直接联系专业人员予以处理。将失控原因明确填写至报告单上,反馈给上级。检验后审查检验数据,并进行评价,若有异议则立即核对。
1.3 观察指标
计算血清胰岛素(INS)、胰岛素抗体(IAb)、C 肽(CP)、甲胎蛋白(AFP)、钙125(CA125)、癌胚抗原(CEA)、CA199、人绒毛膜促性腺激素(β-HCG)等变异系数,算法为标准偏差/平均值×100%。变异系数低,则结果稳定性好。记录2 组患者的标本合格率。质控管理效果优:免疫检验指标正常;良:免疫检验指标基本正常;中:免疫检验指标轻度异常;差:免疫检验指标严重异常。
1.4 统计学分析
数据经由SPSS 21.0 软件统计学进行处理分析,计量资料以()表示,采用t 检验,计数资料以[例(%)]表示,行χ2检验。P <0.05 为差异有统计学意义。
2 结果
2.1 检验指标变异系数比较
A 组 患 者 中 的INS、IAb、C-P、AFP、Ca125、CEA、Ca199、β-HCG 等变异系数均高于B 组,组间比较差异有统计学意义(P <0.05),见表1。
2.2 标本合格情况比较
B 组的标本合格率为95.24%(100/105),显著高于A 组的87.25%(89/102),组间比较差异有统计学意义(χ2=7.071,P=0.008)。
2.3 对比管理效果优良率
A 组的管理效果优良率为88.24%,B 组为94.29%,B组显著高于A 组,组间比较差异有统计学意义(P <0.05),见表2。
3 讨论
免疫检验是辅助性、应用率较高的诊断手段,其内容复杂,程序繁琐,人为或是标本因素均会导致结果误差[2]。有学者发现[3],控制检验环节质量可以保证诊疗效率。检验过程中,免疫细胞分泌的免疫物质是标志物,通过对其定量、细胞因子定性等分析,可检出多种白细胞或是血液抗体的异常改变。结果误差会导致诊断错误,严重者会引发医疗事故[4]。有研究报道[5],检验结果的影响因素为:(1)外源性,仪器校准、合理存储、标本采集、试剂盒保质期等。严格监管标本采集或保存工作,注意采集时间与手法等操作要点,评估激素的分泌峰值,并在转送标本时防震、防污染与密闭,可规避外源性因素[6]。此外,应严格检查仪器设备,确保其功能正常和参数正确,检验后需审核结果,禁止错漏和误漏,做好记录工作,便于查询[7]。(2)内源性,高水平免疫球蛋白、类风湿因子等因素均会影响检验结果,其控制难度较大,需要在检验前全面评估患者的疾病史、用药史等资料[8]。为规避内源性因素,需定期培训检验人员,使其具备高超的应变能力,可发现检验影响因素,并正确应对。更为主要的是,检验科应引进先进设备,指导检验人员学习新设备用法,保证检验质量[9]。
表1 检验指标变异系数比较()
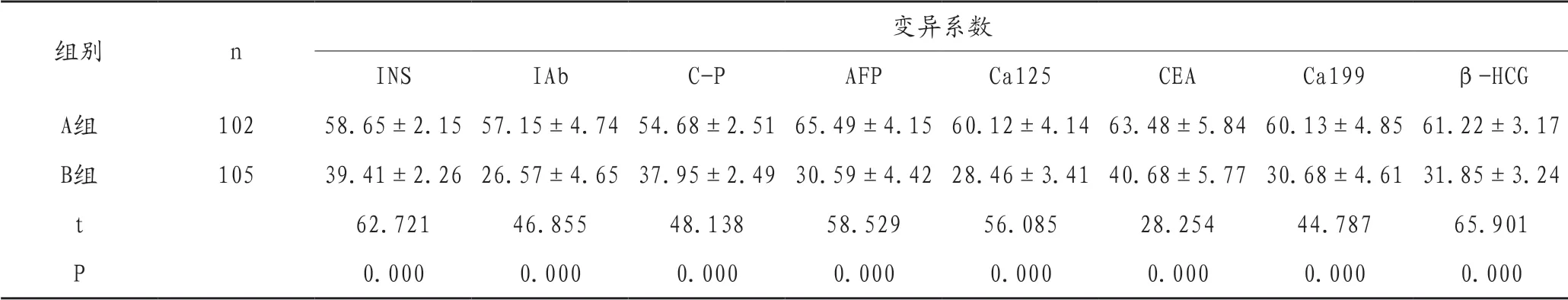
表1 检验指标变异系数比较()
组别 n 变异系数INS IAb C-P AFP Ca125 CEA Ca199 β-HCG A组 102 58.65±2.15 57.15±4.74 54.68±2.51 65.49±4.15 60.12±4.14 63.48±5.84 60.13±4.85 61.22±3.17 B组 105 39.41±2.26 26.57±4.65 37.95±2.49 30.59±4.42 28.46±3.41 40.68±5.77 30.68±4.61 31.85±3.24 t 62.721 46.855 48.138 58.529 56.085 28.254 44.787 65.901 P 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000

表2 组间管理效果优良率比较[例(%)]
研究结果显示,A 组的各项检验指标变异系数均高于B 组;A 组标本合格率87.25%,低于B 组95.24%;A 组的管理效果优良率88.24%低于B 组94.29%(P <0.05)。说明质量控制可降低检验指标的变异系数,最大化保证检验结果的准确率,可获得理想的管理效果,应作为免疫检验的常规管理模式。
总之,免疫检验在临床工作中的作用显著,随着设备或仪器的更新换代,应持续性改进质量控制方法,符合临床检验现状,提高质量控制的可行性。讨[J].中国医药指南,2018,16(36):173-174.

