TiO2基催化剂还原CO2研究进展
尉伊莉,黄娟茹,张 阳,马登省,陈鑫雨
(天津工业大学环境科学与工程学院,天津300387)
随着现代社会能源需求的不断增加,不可再生的化石能源正以不断增长的速率消耗,其终将被消耗殆尽。因此寻找一种新型能源替代化石燃料已成为亟需解决的关键问题。其中,随着化石能源燃烧释放了大量CO2,其将为合成新能源提供了充足的碳源,然而CO2很难被活化。目前,大多采用高温高压协同催化来实现其活化,包括协调激活、路易斯酸-碱协同活化、光电激活、生物酶催化激活和等离子激活等。
光催化技术因反应条件温和、环境友好和无污染等优点,受到了广泛关注。近年来,越来越多国家采用光催化技术将CO2还原为CH4、HCHO、CH3OH、HCOOH、CH3CH2OH等重要的化工原料,来缓解 CO2排放带来的“温室效应”,并有望解决化石能源短缺的壁垒。基于此,本文在光催化还原CO2机理基础上,结合近年TiO2在光催化还原CO2应用研究进展,总结光催化还原CO2的研究现状并展望未来发展前景。
1 TiO2光还原CO2机理
光催化CO2还原是基于植物光合作用的人工光合技术,其实质是光诱导的氧化还原过程。当催化剂受光激发后产生光生电子-空穴对,其分离后分别迁移至催化剂表面的活性位;同时被吸附在活性位上的CO2与迁移来的光生电子(e-)发生反应生成低碳的有机化合物,水分子则被光生空穴(h+)氧化释放出O2。因此,要实现CO2还原反应,催化剂必须满足:第一,催化剂的带隙能量与吸收光能相匹配;第二,催化剂的导带位置与价带位置匹配;第三,催化剂表面能吸附更多CO2,并增大其与催化活性位的有效接触。
研究表明热化学法、电化学法、光催化法、光电催化法等可对CO2进行还原。以水为还原剂,半导体光还原CO2时,催化剂表面的光生空穴与水发生反应生成·OH和H+[1-2];光生电子则将CO2还原为低碳的有机化合物,根据获得电子数目得到相应的产物[3]。其反应过程如下。
2H++ 2e-→ H2-0.41 eV
(1)
H2O → 1/2O2+2H++2e-0.82 eV
(2)
CO2+ e-→ CO2--1.90 eV
(3)
CO2+ H++ 2e- → HCO2--0.49 eV
(4)
CO2+ 2H++ 2e-→ CO + H2O-0.53 eV
(5)
CO2+ 4H++ 4e-→ HCHO + H2O-0.48 eV
(6)
CO2+ 6H++ 6e-→ CH3OH + H2O-0.38 eV
(7)
CO2+ 8H++ 8e-→ CH4+ 2H2O-0.24 eV
(8)
TiO2有金红石相、锐钛矿相、板钛矿相和单斜相TiO2(B)四种晶型[4-5]。其中板钛矿相和单斜TiO2(B) 相结构不稳定,锐钛矿相经高温易转变成金红石相。目前,TiO2光催化研究大多集中在锐钛矿相。锐钛矿相TiO2受光(λ<380 nm)激发成为激发态后,其价带上的光生电子发生跃迁到导带,同时在价带上产生空穴,这样形成了光生电子-空穴对。这一过程中一部分光生电子-空穴对将会在TiO2体内外发生电荷迁移,并在催化剂表面发生CO2还原(CO2与光生电子、水中H+发生反应生成CH4、CH3OH、HCHO、HCOOH等),其反应机理见图1。还有一部分光生电子-空穴对将会快速发生复合,此复合将极大降低催化反应的量子效率,并以光和热的形式释放出能量。

图1 TiO2光催化还原CO2(电子空穴对形成及反应过程)Figure 1 Photocatalytic reduction of CO2 on TiO2(electron-hole pair formation and reaction process)
2 TiO2基还原CO2的研究进展
光催化反应最早可追索到1972年,Fujishima与Honda发现光照TiO2可分解水产氢,开创了半导体非均相光催化的新里程[6];1978年,Halmann光激发GaP电极后,发现其能将水溶液中CO2还原为CH3OH,从而开辟了光催化CO2的新方向[7];1979年,Fujishima等也发现TiO2、CdS、GaP和SiC等可光还原CO2为HCOOH、HCHO、CH3OH和CH4等,并首次提出了光还原CO2的反应机理[8]。随着研究进行,研究者发现光俘获、光生电子-空穴的分离与复合、CO2吸附与活化是影响光还原CO2的关键因素。为此,通常采用元素掺杂、窄带隙半导体复合与染料敏化、高活性晶面调控、低维纳米结构设计、助催化剂、Z型结构设计和单原子催化等手段来提高CO2还原的反应效率和选择性。
2.1 元素掺杂
锐钛矿相TiO2带隙为3.2 eV,仅对太阳光谱中不到5%的紫外光发生响应。最早研究采用N[9]、C[10]、S[10]、F[11]等阴离子代替TiO2中部分O原子,提升价带顶电位并减小其带隙,实现光谱的宽范围吸收[9]。以N掺杂来解释其机理,当 N掺杂TiO2时,N2p与O2p轨道发生杂化,使得TiO2价带顶电位上升从而窄化其带隙,实现可见光的吸收。同时,Cu[12]、Ni[13]、Ce[12]和Ag[14]等阳离子掺杂,则能在TiO2禁带中形成杂化能级,改变其能带结构,从而加速光生电荷的转移并提高量子产率[15]。
2.2 半导体复合与染料敏化
与窄带隙半导体复合或与染料敏化是实现宽带隙半导体在可见光激发下还原CO2有效手段之一。此过程中,窄带隙半导体或染料分子主要是受可见光激发后产生光生电子-空穴对,其中光生电子转移至宽带隙半导体的导带并参与还原反应[16]。CdS 或 Bi2S3负载复合TiO2纳米管制备CdS/TiO2/Bi2S3复合物,以Na2SO3为空穴牺牲剂进行光还原CO2得到 CH3OH(见图2a)。AgBr/TiO2经可见光激发后,所形成的光生空穴与吸附在其上的H2O形成-OH和H+,从而将CO2还原成CH4[17]。染料分子往往易吸附或连接在氧化物表面,利用染料对可见光吸收激活TiO2产生光生载流子进行CO2还原。[Ru(Bpy)3]2+染料敏化TiO2后,受可见光激发发生气相反应将 CO2还原为 CH4[18]。同时,空气稳定存在 [Cu(bpy)2]+敏化TiO2后,能充分利用可见光还原CO2成CH4[19]。
不同宽带隙半导体间发生复合,使得该异质结中受光激发产生的光生电荷从高导带向低导带转移发生还原反应,与此同时光生空穴则从低价带跃迁至高价带发生氧化反应,上述异质结界面能有效促使光生电子-空穴对的分离,减少其复合几率[20](见图2b)。TiO2/ZnO[21], TiO2/SrTiO3[22], TiO2/CaTiO3[23]等异质结还原CO2相继被报道,且其活性均高于本体TiO2。另外,在裸露锐钛矿TiO2{010}晶面的纳米棒上负载金红石相TiO2构成同质的异相结,受光激发后促进光生电子从锐钛矿相到金红石相的转移,有效提高CO2光还原为CH4的活性[24]。
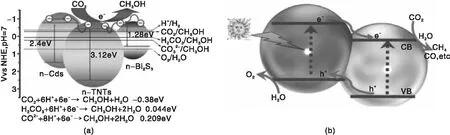
图2 窄/宽带隙(a)[16]和宽/宽带隙(b)[20]异质结光还原CO2的反应机理Figure 2 CO2 photoreduction mechanism on the low-wide bandgap heterojunction(a)[16]and the wide-wide bandgap heterojunction(b)[20]
2.3 高活性晶面调控
纳米TiO2的物化特性是由自身电子结构和形貌结构、尺寸大小和表面特性共同来决定的。某些特性如吸附、光催化和选择性等则主要依靠表面原子结构和高活性取向晶面的裸露程度。因此,在TiO2生长过程中可通过调控其表面原子组成和结构,优化其催化活性和目标产物的选择性[25]。由Wulff结构和密度泛函理论可知,锐钛矿相TiO2不同晶面的表面活化能大小顺序为{101}(0.44 J·m-2)<{100} = {010}(0.53 J·m-2)<{001}(0.90 J·m-2)[26]。TiO2活性晶面最早是由杨化桂教授合成47% {001}的TiO2单晶,这一报道开辟TiO2活性晶面的研究热潮[27]。随后,高活性取向晶面组成、形貌和尺寸等可控的高活性TiO2相继被报道[28]。与相同比表面积TiO2立方块相比,95%裸露的高活性{100}超薄TiO2纳米片具有更高CO2还原为 CH4的催化活性。这是因为在{100}晶面上5 配位 Ti5c原子为100%,而在{101}面上Ti5c原子仅为50%,Ti5c是锐钛矿相TiO2表面的活性位点,更有利于CH4形成[29]。共裸露{001}和{101}晶面的蓝色缺陷位TiO2可见光下还原CO2成CO,其量子产率为0.134%。可能是因为未配位Ti原子和O缺陷暴露的活性位促使光生载流子在{001}和{101}晶面间的转移,且TiO2能带间形成新能级Ti3+拓宽光响应范围至可见光(见图3)[30]。

图3 TiO2-x{001}-{101}光生电荷跃迁及其可见光还原CO2活性[30]Figure 3 TiO2-x {001}-{101} photogenerated charge transition to reduce CO2under visible light[30]
2.4 低维TiO2纳米材料设计
低维TiO2纳米材料设计主要是指一维TiO2纳米管、纳米棒、纳米线、纳米带等的设计合成及其催化应用[31-32]。通常,一维单相TiO2避免了多晶材料中缺陷位及晶界对光生电荷传输的影响,从而抑制光电电子-空穴对的再复合;同时,一维TiO2纳米结构特点有利于光生电荷的径向传输,限制其横向传输,因而提高光生电子-空穴对的分离与传输速率。通过研究阳极氧化TiO2纳米管阵列薄膜沉积Cu或Pt颗粒用于光还原CO2生成CH4,发现一维纳米管阵列结构便利光生载流子传输,金属颗粒有利于反应物种吸附并促进还原反应,进而提高生成CH4的反应速率[32-33]。ITO上TiO2单晶通过沉积Pt颗粒制备Pt-TiO2纳米棒,其还原CO2选择性生成CH4[最大产率为136μmol·(gcat·h)-1]。分析认为其快速的光生电荷转移归因于Pt颗粒尺寸和独特的一维纳米结构(见图4)[34]。二维材料因为其处于热力学不稳定状态,一直被认为是不存在的。直到2004年,安德烈和康斯坦丁成功制备出单原子层的石墨烯纳米片,引发了二维纳米材料石墨烯、g-C3N4、黑鳞、MoS2和TiO2等的研究热潮。一步水热法合成纤铁矿结构的二维TiO2纳米片,其带隙约为1.84 eV,对光响应范围拓宽至670 nm,极大提高其对光利用效率并促进其光催化活性[35]。
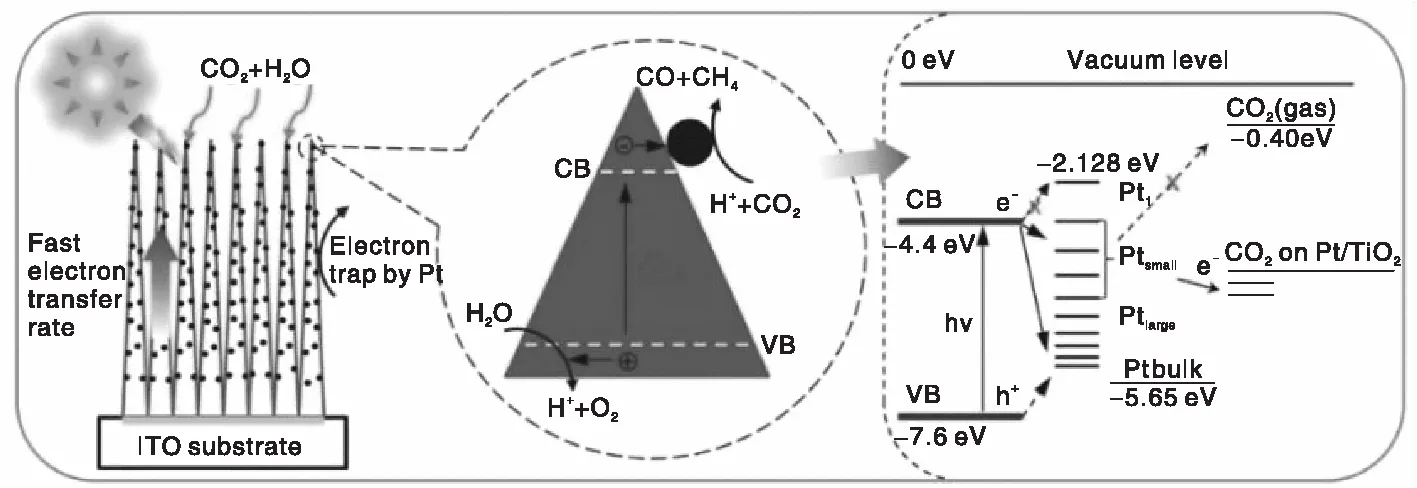
图4 Pt-TiO2纳米棒上光还原CO2反应机理[34]Figure 4 CO2 photoreduction mechanism on Pt-TiO2 nanostructured films[34]
2.5 助催化剂
助催化剂在TiO2催化体系中发挥着至关重要的作用。助催化剂与TiO2形成肖特基势垒促进光生载流子的分离和迁移,降低光生电荷的再复合。当Pt、Pd、Au、Ag等纳米粒子负载在TiO2上,由于金属费米能级通常低于TiO2导带,在热力学上允许其上的光生电子迁移至金属助催化剂上。同时,金属的化学价态、粒度大小等也影响TiO2还原CO2的能力。Pt负载在一维单晶TiO2纳米棒上,当粒度介于(0.5~2) nm时,Pt-TiO2表现出极高的催化活性和选择性。较小粒度可能由于量子尺寸效应分离出更高的能级,较大粒度则可能表现出类体相Pt,同时俘获光生电子和空穴成为再复合的中心[33]。助催化剂RuO2和 Pd协同TiO2催化还原CO2为HCOO-,其高活性可能是因为受光激发后产生的光生电子从TiO2转移至Pd上,而光生空穴则转移到RuO2上,进一步强化了光生载流子分离和传输[35]。
2.6 Z型结构设计
人工Z型结构体系是模仿自然界中绿色植物的光合作用,为人工光还原CO2为低碳的有机化合物提供了一个有效的解决方案。该体系中包含两种不同的催化剂和可逆的氧化还原介质,通过对两种催化剂进行双光子激发分别产生还原/氧化能力更强的电子/空穴[36]。Z结构异质结其优势在于光生电子将在较高能级上积累,而空穴将在较低能级上积累,这样的电荷转移使得氧化还原能力更强。而在前文中的异质结均为光生电荷迁移至氧化还原能力较低的能级上(见图5)。Z型异质结Cu2O/TiO2能实现CO2还原并同时阻止Cu2O光腐效应。由紫外光电子能谱计算知Cu2O导带、价带位置分别为-1.27 eV和0.76 eV,而TiO2则为-0.57 eV和2.59 eV。假定反应机理为图5a,氧化反应和还原反应分别发生在Cu2O价带和TiO2导带上,而H2O分子氧化产生·OH的氧化还原电势为 2.27 eV,则Cu2O 价带上h+不足以氧化H2O产生·OH。通过对羟基香豆素的荧光光谱探测到·OH存在。因此,其催化机理只能为图5b。综上,区别Z型结构和上文中异质结,其关键点在于光生电子的传递方向和发生氧化还原反应能带位置的差异[37]。据此,主要采用氧化还原反应电势[38],能带弯曲[39]和XPS偏移方向[40]等进行甄别。
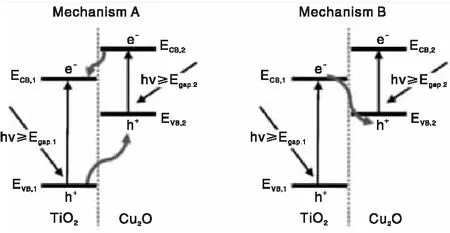
图5 光子激发下异质结上电荷转移机理(a)双电荷转移(b)Z型结构电荷转移[41]Figure 5 Photon excitedcharge transfer mechanism of heterojunction(a) Double-charge transfer(b)direct Z-scheme mechanism.[41]
2.7 单原子催化

3 结论与展望
光催化还原CO2是一项将光能转化为化学能的新型绿色技术,在解决环境污染和能源危机方面表现出广阔的应用前景。TiO2基催化剂在本体催化研究基础上,以提高太阳光的俘获效率,强化光生载流子的分离与传输,并增强CO2在催化剂表面吸附与活化为目标,采用元素掺杂、半导体复合与染料敏化、高活性晶面调控、低维纳米结构设计、助催化剂、Z型结构设计和单原子催化等方法或途径来提升CO2还原的反应效率和选择性。鉴于上述,虽然在TiO2基催化剂设计合成及应用等方面取得了一定的进展,但仍存在以下问题:(1)TiO2基催化剂的光还原CO2机理认识有限,缺乏有效方法和手段去进一步解析CO2还原的反应本质;(2)光还原CO2反应体系中,光生电子-空穴对的分离效率依然不高,导致催化活性较低;(3)如何建立TiO2基催化剂可控合成与还原目标产物间的专属性关系,使其目标产物为CH3OH、CH3CH2OH、HCOOH、CH3COOH等附加价值高的化学品,仍是一项巨大挑战。
——潘桂棠光生的地质情怀

