单分子电泳:纳米孔道电化学的新认识
张伟为, 应佚伦, 龙亿涛,*
(1. 华东理工大学化学与分子工程学院, 上海 200237;2. 南京大学化学化工学院, 生命分析化学国家重点实验室, 江苏 南京 210023)
电泳是指带电粒子在外加电场作用下以一定速度向电荷相反方向迁移运动的现象[1]。混合物中分析物的电荷量、分子大小、形状等不同,其在外加电场下的泳动速度也不同,从而实现混合物的分离[2-4]。以毛细管电泳为例,其以石英毛细管为分离通道,以高压直流电场为主要推动力。毛细管的内径通常为25~100 μm,长度一般为20~100 cm,由于其比表面积大,易于散热,故可承受电场高达1 000 V/cm。毛细管内壁界面的特殊结构产生双电层效应,使得待测物分子同时受到电渗流和电泳力的共同作用。待测分子在如此高的电场强度下,经过一个几十厘米长的毛细管道,分子之间运动的相对速度差异将更加明显,从而使毛细管电泳的分离效率、分离能力相比于传统电泳显著提高。
若将毛细管的长度缩短,同时内径也进一步缩小,达到纳米尺度,则其孔道内限域空间将与单个待测分子尺寸相匹配,在外加电场下,可达到极高的电场强度,有望实现单分子水平上的电泳分离。例如,将毛细管长度缩短为10 nm,孔径缩小为1 nm,这种独特的限域空间,极大地增强了毛细管内电动力行为,仅需100 mV的施加电压,即可达到约100 kV/cm的超高电场强度。在这样的电化学限域空间内,就可以实现单分子水平上的分离分析,如可以分析识别单个碱基长度[5,6]、单个氨基酸差异[7],乃至单核苷酸甲基化[8]。为实现“单分子电泳”这一想法,亟须设计构建与单个分子尺寸匹配的分离测量界面。天然生物孔道蛋白,如Aerolysin[9-11],α-Hemolysin[12-14]等,其由一个蛋白质分子组成的限域孔道界面与单个生物分子如DNA,多肽等尺寸类似,且其孔道内壁可以看作是由氨基酸组成的具有调控电迁移能力的特异性孔道界面。在电场力的作用下,单个待测分子逐一进入生物纳米孔道内部,孔道内的每一个氨基酸残基都相当于一个传感基元,待测物分子逐一穿过纳米孔道时会与内壁多个氨基酸残基发生时序性地相互作用。相互作用方式、程度与时长具有单分子特性,从而使得每一个待测分子在生物纳米孔道内的特征迁移速度和迁移运动轨迹不同,形成特征离子流阻断信号。每秒可以有上千个分子穿过孔道,通过对其进行统计分析,读取每一个离子流阻断信号的阻断电流、阻断时间、阻断频率以及信号特征,可以从单分子电泳水平对单个生物分子实现高通量的分辨与识别[15]。
纳米孔道技术是基于80年代人们受到的流式细胞仪的启发而提出的用单分子进行DNA测序的思想而发展起来的一种单分子分析技术[16]。在接下来的近10年里,研究者一直在寻找合适的界面材料,即只能允许单链DNA通过,而不能允许双链DNA通过的界面材料,直到α-Hemolysin的出现才正式让人看到这一设想可能变成现实的希望[12,17-21],由于分子穿过孔道的速度特别快,当时还难以准确捕获DNA穿孔过程中的单个碱基序列信息。随着对孔道分辨能力的提高以及对仪器设备的不断更新,经过20多年的科研投入,已研究出采用纳米孔道技术进行核酸测序的仪器并且实现商品化,进一步应用于新冠病毒核酸的检测,大幅提升了病毒阳性检出率[22]。
本文基于Aerolysin生物纳米孔道构建了“单分子电泳”分离体系,应用其实现了对仅有一个腺嘌呤脱氧核糖核苷酸差异的寡聚核苷酸分子5′-CAA-3′(CA2)、5′-CAAA-3′(CA3)、5′-CAAAA-3′(CA4)的分离识别,从电泳角度重新认识和理解了纳米孔道电化学单分子分析技术。
1 实验部分
1.1 仪器、试剂与材料
纳米孔道检测池(Warner Instruments公司,美国); ChemClamp电流放大器(Dagan Corporation公司,美国); Digidata1440A数模转换器(Axon Instruments公司,美国); Clampex 10.3数据记录软件(Axon Instruments公司,美国)[5,23,24]。
实验所用溶液均采用超纯水(其电导率为18 MΩ/cm, 25 ℃)进行配制。Aerolysin蛋白通过大肠杆菌体系表达纯化所得;实验所用磷脂1,2-二植烷酰基磷脂(1,2-diphytanoyl-sn-glycero-3-phosphocholine, 200 mg)购自Avanti Polar Lipids公司(美国);正癸烷购自Sigma-Aldrich公司(美国);乙二胺四乙酸(EDTA, ≥99.995%)和三羟甲基氨基甲烷(Tris, ≥99%)购自阿拉丁(中国);氯化钾(KCl, ≥99.0%)购买Sigma-aldrich公司(美国);单链DNA均购自生物工程有限公司(中国),本研究所涉及DNA片段均在5′端不含磷酸基团[5,23,24]。实验所用直径为1.0 mm的银丝购自Alfa Aesar公司(英国),本实验采用电镀法进行Ag/AgCl电极的制备。
1.2 纳米孔道检测体系的构建
如图1a所示,两个检测池紧紧地组装在一起,分别盛有1.0 mL的电解质溶液(1.0 mol/L KCl, 10 mmol/L Tris, 1.0 mmol/L EDTA, pH=8.0),其相连接处隔板中央有一个约50 μm的小孔可以将其连通,两检测池通过一对Ag/AgCl电极施加电压构成电化学回路。通过笔刷蘸取一定浓度的磷脂正癸烷溶液,在连通两检测池的小孔处构建一层磷脂双分子层膜,此时两检测池被完全阻断,电流趋于0。在本研究中定义:接通电源负极的一端为cis端,正极的一端为trans端,在cis端溶液中加入一定浓度的Aerolysin蛋白,在施加电压(200~350 mV)条件下,Aerolysin蛋白单体在磷脂双分子层膜上自组装为单个孔径约为1 nm,直径约为10 nm的七聚体生物纳米孔道,成为两检测池的唯一通道。如图1b所示,此时连通两检测池的孔径由50 μm减小到1 nm。当获得稳定的单个Aerolysin纳米孔通道时,在100 mV的施加电压下可产生约50 pA的开孔电流。
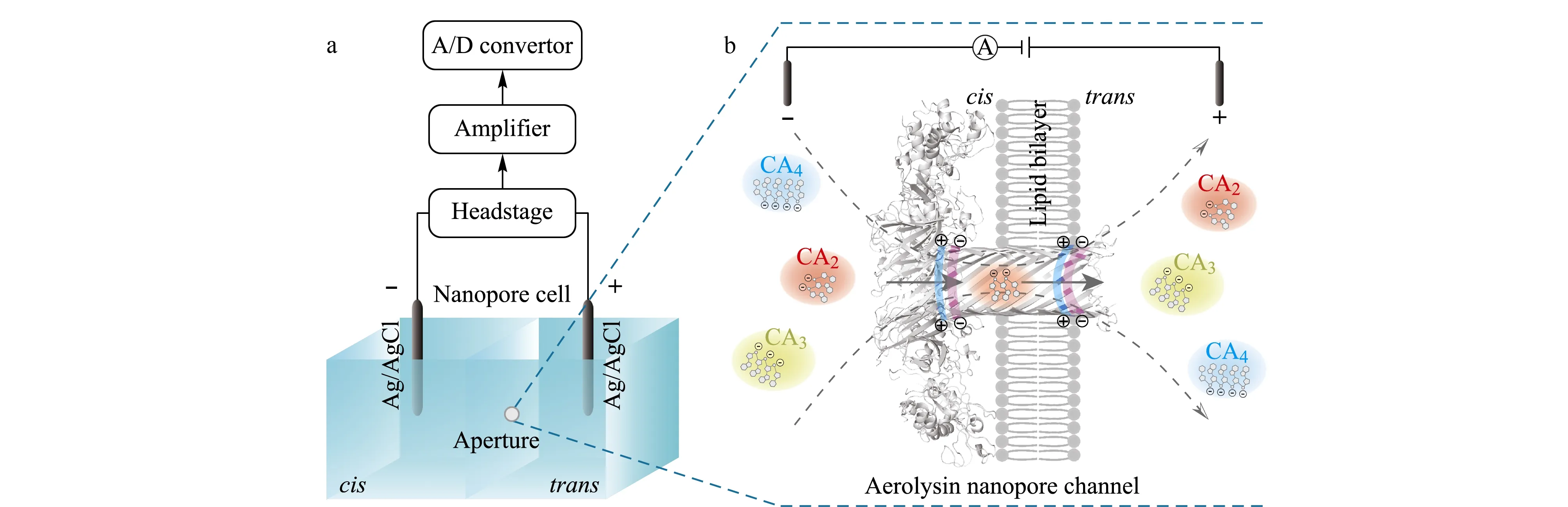
图 1 (a)纳米孔道电化学单分子分析技术原理图及(b) Aerolysin生物纳米孔道分离识别CA2、CA3、CA4Fig. 1 Illustration of (a) the nanopore electrochemical measurement and (b) discrimination of CA2, CA3 and CA4 by an Aerolysin nanoporeCA2: 5′-CAA-3′; CA3: 5′-CAAA-3′; CA4: 5′-CAAAA-3′; A/D convertor: analog-digital convertor.
1.3 分析物检测
在获得稳定的Aerolysin纳米孔道之后,在cis端溶液中加入待测物分子。在电泳力和电渗流的共同作用下,待测分子从cis端溶液穿过孔道到trans端溶液中,穿孔过程中会因体积排阻效应排开孔道内的部分电解质离子,从而使电流幅值下降,并且待测物分子穿孔过程中与孔道内壁的氨基酸残基产生相互作用,导致离子流呈现特征性变化。这些离子流信号由放大器放大,通过模数转化器转换成数字信号并记录。不同分子穿过纳米孔道时会引起不同阻断程度、阻断时间、阻断频率、阻断形状的离子流信号。通过对每一个阻断电流信号进行统计分析,可以获取单个待测物的成分、结构、尺寸、浓度、电性等信息。
本文的待测物是一组仅有一个腺嘌呤脱氧核糖核苷酸长度差异的寡聚核苷酸,分别为CA2、CA3、CA4。在cis端溶液中加入预混后的上述3种待测物分子,施加80 mV,实现实时监测3种不同的分子穿过Aerolysin纳米孔道的特征离子流信号。
2 结果与讨论
本实验中所采用的缓冲体系为pH=8弱碱性环境,可使核苷酸的磷酸基团发生电离。因此,每个磷酸基团都将带有一个负电荷,CA2、CA3、CA4分别带有2、3、4个负电荷。由于Aerolysin纳米孔道孔径仅为1 nm,孔长仅为10 nm,故80 mV的施加电压即可造成约80 kV/cm的电场强度。带有不同电荷的CA2、CA3、CA4分子在孔道内将受到不同大小的电泳力,由cis端溶液迁移到trans端溶液中。由于Aerolysin纳米孔道对阴离子具有选择性,通过纳米孔道的电渗流方向与阴离子流动方向一致,故在Aerolysin纳米孔道中电渗流的方向也是由cis端到trans端[7]。所以,单个CA2、CA3、CA4分子在电泳力和电渗流共同作用的驱动下穿过单个Aerolysin纳米孔道。由于待测分子的带电荷量不同、分子尺寸不同,将会造成分子的迁移速度不同,导致分子的过孔持续时间不同,即电流阻断信号的阻断时间不同。此外,单个分子在纳米孔道限域空间内产生的离子流体积排阻大小不同,使得单个分子电流阻断信号具有特征阻断程度。更重要的是,Aerolysin纳米孔道内壁界面含有两处含有极性氨基酸的灵敏区域[25](见图1b),其与带负电荷的分子间具有强烈的静电相互作用,故而导致单个分子穿孔过程中迁移运动轨迹具有差异,即对电流阻断信号的阻断程度和阻断时间造成影响。
本实验结果表明,CA2、CA3、CA4分子在穿过Aerolysin纳米孔道时产生了3种阻断程度具有明显差别的电流阻断信号,其阻断电流值差别约为3~5 pA(见图2a)。混合样品阻断电流和阻断时间散点图具有3个特征分布,分别可对应这3种相差一个核苷酸的CA2、CA3、CA4分子穿过Aerolysin纳米孔道时所引起的电流变化情况(见图2b)。此外,散点图还显示出不同待测分子与孔道的作用时间也有较大差异,具体表现为CA3、CA4的阻断时间是CA2阻断时间的5倍,这表明CA2、CA3、CA4穿孔的迁移速度有较大差异,即待测分子带电荷量越高,所受电泳力将越强,故而在孔道内的迁移速度越高。

图 2 (a)3种分子穿过Aerolysin纳米孔道时产生的原始电流轨迹图、(b)阻断时间和阻断电流的散点图和(c)阻断电流直方图Fig. 2 (a) Continuous raw current traces generated by the three analytes traversing through an Aerolysin nanopore, (b) scatter plots of the duration and residual current (Ires) and (c) histogram of Ires
本研究定义Ires为单个分子在Aerolysin纳米孔道内时所造成的特征阻断电流值,对其进行高斯拟合,可以得到3种待测物分子穿过Aerolysin纳米孔道时对应的特征阻断电流值,拟合高斯峰电流分别为20.7、15.7、12.7 pA(见图2c)。本课题组之前的研究表明,位阻效应使得长度不超过14个核苷酸的寡聚核苷酸穿过Aerolysin纳米孔道时所造成的电流阻断程度随链长的增加而增加[5,11],即Ires越小,分子的尺寸就越大,据此可以根据Ires依次分辨出CA2、CA3、CA43种分子。
3 结论
本文从电泳技术的角度重新理解了纳米孔道电化学单分子分析技术,将其看作为纳米孔道单分子电泳技术。这种技术的特征在于孔道尺寸与分子尺寸相匹配,并且孔道内含有多个灵敏位点,分子在电泳力和电渗流的共同作用下逐一进入孔道,与孔道内多个灵敏位点发生有时序性的相互作用。由于分子运动速度、相互作用方式不同,从而产生不同阻断时长、阻断程度的特征性离子流信号,对其进行统计分析可以在单分子水平上实现仅有一个核苷酸差异的分辨。根据待测生物分子的电性和尺寸差异,Aerolysin纳米孔道单分子电泳技术已应用于识别检测仅相差一个净电荷的多肽序列[15]、DNA及多肽分子的多个磷酸化位点[26,27],以及磷酸酶和激酶的催化活性[26,28]。进一步,通过调控电解质阳离子种类,增强了单个待测分子进入孔道的能力,从而实现对小分子化合物(例如环二核苷酸)的超灵敏检测[29]。
生物纳米孔道可认为是一个由单个蛋白质分子组成的单分子界面,也是一个分离利用效率最高的界面。通过定点突变孔道内氨基酸技术可进一步调控孔道内壁电荷和与待测分子间相互作用[30],从而实现在混合样品中对带有同种电荷且电量相同的生物分子进行高灵敏性识别分析。更重要的是,待测分子与纳米孔道的相互作用具有时序性信息,结合微流控、阵列孔技术,未来有望从单分子水平上进行单个分子的分离识别。
致谢 特别感谢“毛细管电动分离分析前瞻研讨会”和中科院化学所陈义研究员在纳米孔道电泳理解方面对我们研究的指导和帮助。

