黄芪根腐病病株和健株根围微生物菌群变化分析
闫欢 高芬 王梦亮 秦雪梅

摘要 通过分析黄芪根腐病病株和健株根围微生物菌群的变化, 探究根腐病的发病机理, 寻找预警病害发生的生物指示因子, 为土壤微生态的生物调控提供依据。试验通过菌落计数、PCR-DGGE和16S rRNA V3区基因测序的方法, 分析不同年限下黄芪根围病/健土中微生物区系、多样性及群落结构的变化。结果表明:细菌作为黄芪根围土中的优势种群,是影响病土中微生物数量升高的关键因子, 其多样性降低是影响病害加重的主要原因之一。假单胞菌属Pseudomonas和无色杆菌属Achromobacter为土壤中的优势菌群, 健土中的1号和4号特异条带分别为未培养的假单胞菌Uncultured Pseudomonas sp.和荧光假单胞菌P.fluorescens;6号未培养假单胞菌Uncultured Pseudomonas sp.的丰度与根腐病发病率负相关,16号无色杆菌Achromobacter sp. 的丰度则在3年生土壤中显著升高,随后急剧下降。上述4个菌可作为潜在的土壤健康或发病指示因子进一步研究。
关键詞 黄芪; 根腐病; 微生物区系; 细菌多样性; 群落结构
中图分类号: S 435.67
文献标识码: A
DOI: 10.16688/j.zwbh.2019184
Changes of microbial community in root zone soil of Astragalus membranaceus suffering from root rot disease
YAN Huan2,3#, GAO Fen1#, WANG Mengliang1, QIN Xuemei3*
(1. Institute of Applied Chemistry, Shanxi University, Taiyuan 030006,China; 2. College of Chemistry and
Chemical Engineering, Shanxi University, Taiyuan 030006, China; 3. Modern Research Center for Traditional
Chinese Medicine, Shanxi University, Taiyuan 030006, China)
Abstract
By analyzing the changes of microbial community in root zone soil of Astragalus membranaceus diseased and healthy plants, the study aimed at exploring the pathogenesis mechanism and biological warning indicators for the root rot disease occurrence so as to provide a theoretical basis for the biological regulation of soil micro-ecology. The microbial community in the diseased and healthy soil samples was examined through plate colony counting, PCR-DGGE and 16S rRNA V3 gene sequencing to probe into the changes of the microflora, microbial diversity and community structure in different planting years. The results showed that bacteria, as the dominant flora in the soil, were a key factor resulting in significant increase of microorganism quantity in diseased soils. The significant decrease in the bacterial diversity was one of the main causes for the increase of root rot disease incidence. Pseudomonas and Achromobacter were the dominant genera in the root zone soil. The specific bands No.1 and No.4 in the healthy soil were Uncultured Pseudomonas sp. and P. fluorescens, respectively; the abundance of No.6 Uncultured Pseudomonas sp. was negatively correlated with the root rot incidence, and No.16 Achromobacter sp. increased remarkably at the 3rd year and then began to decrease sharply. The four strains were worth further study as the potential biological indicator of soil health and disease occurrence in the future.
Key words
Astragalus membranaceus; root rot disease; microflora; bacterial diversity; community structure
黄芪为豆科植物蒙古黄芪Astragalus membranaceus (Fisch.)Bge.var. mongholicus (Bge.)Hsiao或膜荚黄芪A.membranaceus (Fisch.)Bge.的干燥根,具有提高免疫力、保护肝脏、滋养补益、利尿消肿、抗糖尿病等多种药理功效,以其为原料的中成药多达200余种,是中医药学公认的道地大宗药材和保健品原料[1],素有“十药八芪”之称。根腐病作为一类毁灭性的土传病害,近年来在黄芪种植中发生逐年加重。山西作为道地黄芪的重要产区,一般移栽黄芪田块的发病率为10%~30%,重者高达60%,3年或3年以上植株发病更为严重[2],这对黄芪产业的可持续发展产生了严重影响。目前,引起山西黄芪根腐病的致病菌已基本明确,包括锐顶镰刀菌Fusarium acuminatum、腐皮镰刀菌F.solani、尖孢镰刀菌F.oxysporum、芬芳镰刀菌F.redolens、链格孢菌Alternaria sp. 以及Ilyonectria torresensis,其中锐顶镰刀菌和腐皮镰刀菌为优势致病菌[3]。对于该病害的防治,生产上最常用的方法是化学防治,但病菌抗药性的产生,以及化学农药高毒高残留的特性,使得防治效果并不理想,并且对黄芪的临床安全性产生了很大的负面影响,而传统的农业防治措施受限因素多、成本高,实施非常困难。基于此,亟待发展新的有效防治措施。近年来,生物调控和生物防治因其绿色环保、不易产生抗性、发展潜力大等优势日益受到人们重视。
研究发现,土壤微生态特别是根际微生物系统结构失调与土传病害发生有很大关联[4]。通常土传病害发病土壤的微生物区系与健康土壤明显不同。如三七病株根际土和根系土中细菌数目的大量增加是急性青枯型根腐病最明显的特征[5],而丹参红叶病病株根区土细菌数量较健株减少41.3%,真菌和放线菌数量分别较健株增加156.6%和189.5%[6]。为了明确病/健土中差异性微生物类群发生了怎样的变化,科研人员通过分析其多样性来更清晰地反映土壤中微生物的动态。Wang 等[7]对烟草青枯病的研究发现,与感病土壤相比,健康土壤表现出更高的细菌多样性,但Wu等[8]却发现对香草枯萎病的抑制性与较高的真菌多样性和较低的细菌多样性有关。可见微生物多样性是土壤健康的一个指标,但哪类微生物的多样性起主导作用却随植物和病害的不同而不同。进一步研究发现,土壤微生物群落结构变化也会对植物土传病害产生明显影响[9],且从该角度切入还可以寻找到有效的土壤抑病或感病指示因子。如陆晓菊等[10]发现伯克氏菌属Burkholderia,芽胞桿菌属Bacillus,链霉菌属Streptomyces等细菌是三七健康土壤中的优势种群。Xu等[11]发现苜蓿茎点霉Phoma medicaginis和P.pinodella的丰度与豆科植物根腐病的病情指数正相关,而柄孢壳菌Podospora spp.、Pseudaleuria spp.和Veronaea spp.的丰度与病情指数负相关,这表明上述真菌与豆科植物根部病害的发生关系密切,是潜在的土壤生物指示因子。借助这些指示菌株不仅可以评价土壤健康状况、预测病害的发生,同时也可为病害的生物调控提供依据。但针对黄芪根腐病的相关研究目前还未见报道。
本研究采集1~6年的健康和发病黄芪根围土壤样品,通过菌落计数、PCR-DGGE和16S rRNA V3区基因测序的方法,分析比较黄芪根围病土和健土之间微生物菌群的变化,旨在从土壤微生态的角度探究根腐病的发生机理,寻找病害发生的预警生物指示因子,为黄芪土壤微生态的生物调控提供理论依据。
1 材料与方法
1.1 病害调查及土样采集
样品采自山西省大同市浑源县仿野生黄芪种植基地,地处113.72°E~113.76°E, 39.41°N~39.48°N,海拔1 708.80~1 989.40 m。根据当地发病情况,定向选择1~6年生的黄芪健康地块和发病地块进行样品采集,各地块管理方法完全一致,且土质均为砂质土。5点取样法采集根围病/健土壤样本,根据地块大小,每个取样点的间隔距离约为5~8 m。每点采集3~5株黄芪根围半径10 cm、深度10 cm之内的土壤,去除草根、石砾等杂物后,装入无菌自封袋作为试验子样品。带回实验室后取子样品各100 g混合均匀得最终试验样品,一部分保存于4℃冰箱,用于微生物类群分析;另一部分保存于-80℃冰箱,用于分子试验。采样的同时调查该地块根腐病的发病率。
1.2 细菌、真菌和放线菌的分离计数
根据田间调查结果选取代表性土壤进行计数分析,包括发病率较低的1、2年生病/健土和发病率较高的3、4年生病/健土。参考周永强等[12]的方法
分离各类微生物:取土样5 g,置于盛有45 mL无菌水(内置30粒灭菌玻璃珠)的三角瓶内,摇床振荡(160 r/min,28℃)30 min得土壤悬浮液,梯度稀释至10-4。每梯度取200 μL涂布平板,每浓度涂布3次。细菌平板32℃恒温培养,48 h时计数;真菌和放线菌平板28℃恒温培养,分别在72 h和120 h时计数。细菌:肉汁胨培养基(BPA);真菌:马铃薯葡萄糖琼脂培养基(PDA),同时加入适量(0.1 g/L)氯霉素;放线菌:高氏1号培养基(GA)。试验设3次重复。采用Microsoft Excel 2016处理数据,SPSS 16.0进行方差分析。
1.3 细菌DNA的提取及16S rDNA V3区的PCR扩增
参考徐岩等[13]的方法提取土壤中的细菌DNA,所得DNA溶液保存于-20℃冰箱中。以提取的DNA为模板,338F(GC): 5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGCCTACGGG-AGGCAGCAG-3′和518R: 5′-ATTACCGCGGCTGCTGG-3′为引物[14]进行PCR扩增。50 μL反应体系:DNA模板1 μL;Taq PCR Master Mix 25 μL;引物各1 μL;ddH2O 22 μL。PCR程序:94℃预变性5 min;95℃变性1 min,55℃退火1 min,72℃延伸1 min,30个循环;最终72℃延伸10 min。
1.4 变性梯度凝胶电泳(DGGE)及条带的回收
采用Bio-Rad公司DcodeTM基因突变检测系统(Bio-Rad Lab,LA,USA)电泳分离PCR反应产物。聚丙烯酰胺胶浓度为8%(m/V),变性梯度为35%~60%。电泳运行条件:1×TAE电泳缓冲液,75 V电压,60℃恒温、恒压电泳11.5 h。采用4S Red Plus Nucleic Acid进行染色、成像,并保存DGGE图谱。图谱经软件Quantity One 4.6.2分析后,输出各样品中每个条带的丰度值。以丰富度指数(S)、均匀度指数(J)和香农多样性指数(H′)为指标比较各样品的细菌多样性。多样性计算公式[15]如下:
H′=-Σ Piln Pi;
J =H′/Hmax=H′/lnS
式中:Pi=ni/N,ni是第i条条带的丰度,N为样品中所有条带的总丰度;Hmax=lnS,S为样品中总的条带数。
DGGE图谱中主要的共有及特异性条带采用SIMCA软件进行主成分分析(PCA)分析。
1.5 16S rRNA V3区基因测序及系统进化分析
切取DGGE图谱中共有及特异性的优势条带,放入2 mL灭菌离心管中。50 μL无菌水冲洗3次,加入30 μL无菌水,4℃过夜,上清液作为模板用于PCR扩增,反应体系同1.3,引物为338F(无GC夹)和518R。PCR产物由英潍捷(上海)贸易有限公司完成测序,将有效序列在NCBI上进行比对,同时取同源性高的典型菌株的基因序列作為参比对象,通过MEGA 6.0软件,邻接法(neighbor joining method)构建系统进化树。
2 结果与分析
2.1 病情调查
对山西浑源黄芪的根腐病发病情况进行调查发现,1、2年生黄芪发病率最低,3年时发病率明显升高,4、5年时逐渐加重,6年时又开始降低,且此时若不发病,以后则基本不会发病。本研究中1~6年生黄芪采样地块的发病率分别为:3.33%、10.00%、26.67%、36.67%、43.33%、33.33%。
2.2 黄芪根围土壤的微生物区系分析
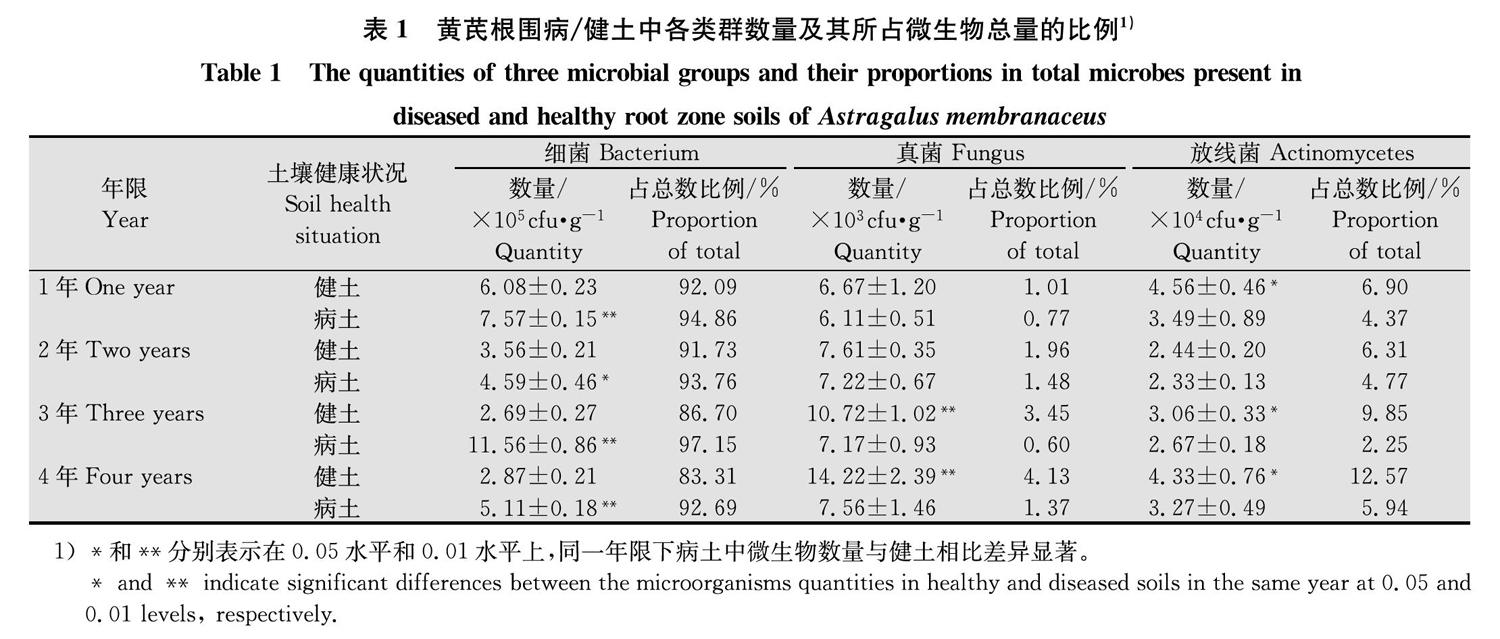
1~4年生黄芪根围土中,病土的微生物总量均显著高于健土。其中,细菌总量均显著高于健土且3年生差异最大;真菌总量1、2年生无显著改变,3、4年生显著低于健土;放线菌总量均低于健土,且除2年生外都差异显著。同时,无论病土还是健土中,细菌的数量和占总量的比例均远远高于真菌和放线菌,具体顺序为细菌>放线菌>真菌(表1)。可见,细菌为黄芪根围土中的优势菌,是影响病土微生物数量显著高于健土的关键因子。
2.3 基于DGGE的黄芪根围病/健土细菌多样性比较
试验提取了黄芪根腐病发病的代表性阶段(1~6年生)根围病/健土的细菌DNA,其条带大小为15 kb左右,16S rRNA V3区扩增的PCR产物为230 bp左右。对该产物进行DGGE分析,发现各样品中条带的数量和亮度明显不同,表明不同样品中细菌的种类和量有所差异(图1)。
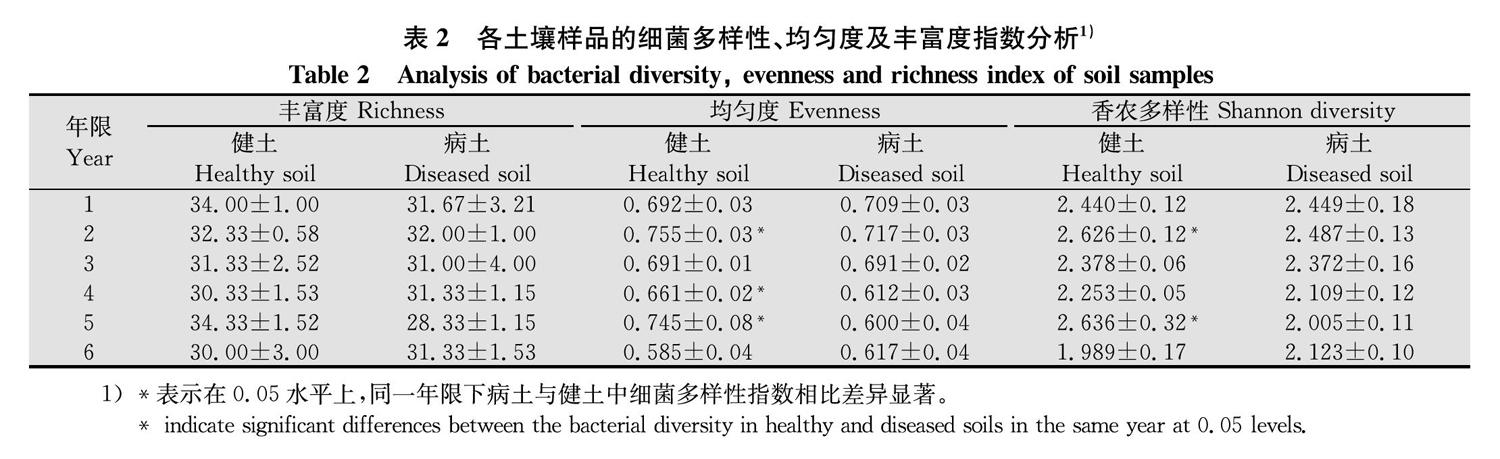
根据图谱中每条条带的信息,综合分析样品中细菌的丰富度指数(S)、均匀度指数(J)和多样性指数(H′)。
物种丰富度指一个群落或生境中物种数目的多少,物种均匀度指一个群落或生境中全部物种个体数目分配的均匀程度,而物种多样性是物种丰富度和物种均匀度的综合指标。结果显示,1~6年生黄芪根围病土与健土的丰富度指数无显著差异;1年生黄芪根围病土与健土的均匀度指数和多样性指数也均无显著差异;2~5年生病土中除3年生的均匀度指数和健土持平外,2、4、5年生均显著小于健土;此期间香农多样性指数则全部小于健土,且2年和5年生病健土之间差异显著;6年生黄芪根围病土均匀度和多样性指数均略有恢复并高于健土,但差异不显著(表2)。结合发病情况分析可知,2~5年生黄芪发病率逐年上升,病土中的细菌多样性指数随之逐渐降低,而6年时发病率开始降低,多样性又有所回升,说明细菌多样性的降低是根腐病发生加重的原因之一。此外,病土中细菌的多样性低于健土,其原因主要在于某些细菌的分配均匀度发生了改变。
对各样品的DGGE条带进行PCA分析发现,1年生病/健土在PC2水平上呈分离趋势,2~6年生病/健土则均在PC1水平上明显分离(图2),表明从主要的共有和特异性条带的种类及丰度来看,1年生病/健土间细菌多样性差异较小,2~6年生病/健土间差异逐渐加大,进一步印证了田间调查和多样性分析的结果。
2.4 黄芪根围土壤的细菌群落结构分析
多样性分析明确了黄芪根围病土中细菌多样性的降低因均匀度改变而引起,但无法确定是哪些菌的数量与分布发生了变化。因此,需对共有条带和特异性条带进行测序和鉴定。本试验共回收条带17条,其中优势条带16条(除1外)(图1)。所有样品的共有条带为6和16,健土中特异性条带为1和4,病土中无特异性条带,其他均为部分样品共有条带。
将17个条带的测序结果进行BLAST比对,与比对菌株同源性大于98%的暂定为相似种,大于90%而小于98%的暂定为潜在新种[10,16]。结果显示条带8、9、10、11、12和13的序列比对同源性大于90%但小于98%,可能为潜在新种。构建其他11个条带的系统发育树,除15号外均属于变形杆菌门Proteobacteria,且主要分布于γ-变形杆菌纲的假单胞菌属Pseudomonas、寡养单胞菌属Stenotrophomonas和β-变形杆菌纲的无色杆菌属Achromobacter(图3)。
在鉴定出的细菌中,7株属假单胞菌属Pseudomonas,2株属无色杆菌属Achromobacter,1株属寡养单胞菌属Stenotrophomonas。上述菌株的数量随发病程度变化而不同。其中,6号未培养假单胞菌Uncultured Pseudomonas sp.和16号无色杆菌Achromobacter sp.在各样品中均有分布。将这二者的丰度与黄芪发病率进行相关性分析,发现6号未培养假单胞菌的丰度与发病率呈显著负相关,相关系数为0.819(P<0.05);16号无色杆菌的丰度与发病率无相关性,但3年生丰度较1~2年生显著升高,呈现特异性变化,4~6年时丰度则又显著下降(表3)。此外,对于健土中的特异条带,1号经鉴定为未培养的假单胞菌Uncultured Pseudomonas sp.,4号为荧光假单胞菌Pseudomonas fluorescens。
3 討论
越来越多的证据显示:根际土壤微生物的数量、种类、代谢活性及微生物间的相互作用决定着植物的健康状况。从土壤微生物区系、多样性和群落结构的角度分析土壤的健康状态,探讨土传病害的发生机理,对病害的生物调控和防治具有很好的指导意义。
与其他微生物区系的研究结果相比,本研究各样品中黄芪根围微生物的数量相对小一些,但与孙窗舒对内蒙古黄芪根际土壤微生物[17]的研究结果相近。有文献报道,根际微生物数量往往大于非根际微生物的数量[18],且砂质土壤的微生物含量也低于壤土[19],而本研究进行试验的黄芪种植地区土壤为砂质土,且采集的样本为根围土,这也可能是导致试验中微生物数量相对较低的原因。
大量文献报道根际土壤微生物多样性与植物健康正相关[20]。本研究也发现黄芪根腐病的发病率与根围土壤中细菌多样性的改变密切相关,多样性降低发病加重,反之发病减轻或植株保持健康,这与Wang等[7]及Yang 等[20]对烟草青枯病的研究结果一致。然而,也有结论与此相反,如陈波等[21]发现香蕉枯萎病发病土壤的细菌多样性比健康土壤更丰富,这一现象可能与作物、土壤种类以及生长环境的差异有关。
群落结构分析表明,假单胞菌属是黄芪根围土壤中的优势种群。作为根际土壤细菌群落的主要成员之一,该属细菌的许多种具有抑制植物病原菌、促进植物生长的作用[22]。本研究中6号未培养假单胞菌的丰度与根腐病发病率呈显著负相关,推测其可能为某种有益拮抗菌,其数量降低导致病原菌侵染加重,发病率上升,故可作为土壤健康和黄芪根腐病发生的潜在指示因子,但其分类归属、在土壤中的作用和动态变化等还有待进一步研究。此外,健康土壤中的4号特异性条带被鉴定为荧光假单胞菌,该菌具有优良的抗病能力[23],是近几十年来研究报道最多、最具应用价值的一类生防菌,其在健康土壤中的特异性存在,也表明其是一种土壤健康的指示因子。另外,16号无色杆菌的丰度在根腐病发病率明显升高的第3年显著升高,但在4~6年时又急剧降低,尽管二者不具有相关性,但文献报道一些无色杆菌属细菌可通过诱导或增强SOD和POD活性、合成ACC脱氨酶、降低叶片中MDA含量来减轻番茄在盐胁迫下的损伤[24]或调节乙烯对根系生长的抑制作用,促进接种植物根系的延伸[25]。据此我们推测,16号无色杆菌也可能作为一种有益菌,在土壤健康状态的保持或黄芪的抗病性中起一定作用,但其与根腐病发生的相关性还需加以确定。
调查中还发现:黄芪连续种植6年后,根腐病发病率不升反降。有文献报道,连续种植小麦全蚀病感病品种可以诱导土壤中产抗生素2,4-DAPG的荧光假单胞菌类群大量增加[26]。连续单一种植草莓15年的土壤再种植草莓,枯萎病的发病率很低,土壤具备了抑制性,且与种植草莓3年的土壤相比,放线菌门Actinobacteria、变形杆菌门Proteobacteria和酸杆菌门Acidobacteria细菌在15年的土壤中更为丰富[27]。由此推测,6年生黄芪发病率的降低也可能预示着连续种植诱导出了土壤的抑病特性,特别是有益拮抗菌的增加,抑制或抵抗了黄芪根腐病菌的侵染。
上述研究初步明确了黄芪根腐病病/健株根围土壤微生物菌群的变化,但通过16S rDNA V3区的PCR扩增鉴定回收条带的分类地位,大部分菌株仅仅鉴定到了属,还有6个菌株由于比对相似性低而难以确定归属,而且所鉴定的条带中,仅有2条属于所有样品的共有条带。这些因素都可能降低寻找土壤健康指示因子的覆盖面和准确度。同时,每个DGGE条带代表的不只是一种细菌,仅凭该技术进行微生物群落结构的研究也有一定的缺陷。因此,目前寻找到的指示菌是否能够真正用于指导病害发生检测和生防调控,还必须深入、全面地研究和验证。
参考文献
[1] LI Aiping, LI Zhenyu, QU Tingli, et al. Nuclear magnetic resonance based metabolomic differentiation of different Astragali Radix [J]. Chinese Journal of Natural Medicines, 2017, 15(5): 363-374.
[2] 高芬, 任小霞, 王梦亮, 等. 中草药根腐病及其微生物防治研究进展[J]. 中国中药杂志, 2015, 40(21): 4122-4126.
[3] 高芬, 赵晓霞, 秦雪梅, 等. 山西省蒙古黄芪根腐病优势致病菌群分析[J]. 植物保护学报, 2018, 45(4): 878-885.
[4] 官会林, 陈昱君, 刘士清, 等. 三七种植土壤微生物类群动态与根腐病的关系[J]. 西南农业大学学报, 2006, 28(5): 706-709.
[5] 寻路路, 赵宏光, 梁宗锁, 等. 三七根腐病病株和健株根域土壤微生态研究[J]. 西北农业学报, 2013, 22(11): 146-151.
[6] 段佳丽, 舒志明, 薛泉宏, 等. 丹参红叶病发生的微生态机制[J]. 应用生态学报, 2013, 24(7): 1991-1999.
[7] WANG Rui, ZHANG Hongchun, SUN Liguang, et al. Microbial community composition is related to soil biological and chemical properties and bacterial wilt outbreak [J/OL]. Scientific Reports, 2017, 7(1): 343. DOI: 10.1038/s41598-017-00472-6.
[8] WU Xiong, RONG Li, YI Ren, et al. Distinct roles for soil fungal and bacterial communities associated with the suppression of vanilla Fusarium wilt disease [J]. Soil Biology & Biochemistry, 2017, 107: 198-207.
[9] LEE C G, IIDA T, INOUE Y, et al. Prokaryotic communities at different depths between soils with and without tomato bacterial wilt but pathogen-present in a single greenhouse [J]. Microbes and Environments, 2017, 32(2): 118-124.
[10]陸晓菊, 官会林, 张正芸, 等. 三七连作根际土壤微生物区系的16S rRNA系统遗传多样性[J]. 微生物学报, 2015, 55(2): 205-213.
[11]XU Lihui, RAVNSKOV S, LARSEN J, et al. Soil fungal community structure along a soil health gradient in pea fields examined using deep amplicon sequencing [J]. Soil Biology & Biochemistry, 2012, 46: 26-32.
[12]周永强, 薛泉宏, 杨斌, 等. 生防放线菌对西瓜根域微生态的调整效应[J]. 西北农林科技大学学报(自然科学版), 2008, 36(4): 143-150.
[13]徐岩, 吴友根, 张军锋, 等. 广藿香根际土壤微生物总DNA提取方法的优化[J]. 江苏农业科学, 2015, 43(2): 45-47.
[14]MUYZER G, DEWAAL E C, UITTERLINDEN A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA [J]. Applied and Environmental Microbiology, 1993, 59(3): 695-700.
[15]刘绍雄, 王明月, 王娟, 等. 基于PCR-DGGE技术的剑湖湿地湖滨带土壤微生物群落结构多样性分析[J]. 农业环境科学学报, 2013, 32(7): 1405-1412.
[16]徐丽华, 李文均, 刘志恒, 等. 放线菌系统学—原理、方法及实践[M]. 北京: 科学出版社, 2007: 202.
[17]孙窗舒. 连作对黄芪品质形成和根际土壤微生物的影响及黄芪轮作换茬方式的研究[D]. 呼和浩特: 内蒙古大学, 2017: 27-29.
[18]张千和, 周立香, 郭荻. 中药材根际和非根际土壤酶和微生物特征[J]. 西北农业学报, 2014, 23(12): 189-196.
[19]蔡燕飞, 廖宗文, 罗洁, 等. 不同质地土壤抑病性和微生物特征[J]. 农业环境科学学报, 2003, 22(5): 553-556.
[20]YANG Hongwu, LI Juan, XIAO Yunhua, et al. An integrated insight into the relationship between soil microbial community and tobacco bacterial wilt disease [J/OL]. Frontiers in Microbiology, 2017, 8: 2179. DOI: 10.3389/fmicb.2017.02179.
[21]陈波, 黄霄, 刘小玉, 等. 不同香蕉枯萎病区土壤细菌群落多样性[J]. 应用生态学报, 2013, 24(8): 2281-2286.
[22]JORQUERA M A, CROWLEY D E, MARSCHNER P, et al. Identification of β-propeller phytase-ecoding genes in culturable Paenibacillus and Bacillus spp. from the rhizosphere of pasture plants on volcanic soils [J]. FEMS Microbiology Ecology, 2011, 75: 163-172.
[23]张亮, 盛浩, 袁红, 等. 荧光假单胞菌PEF-5#18防控番茄枯萎病的定殖机理[J]. 中国生物防治学报, 2017, 33(5): 658-666.
[24]郑娜, 柯林峰, 杨景艳, 等. 来源于污染土壤的植物根际促生细菌对番茄幼苗的促生与盐耐受机制[J]. 应用与环境生物学报, 2018, 24(1): 47-52.
[25]MA Wenbo, PENROSE D M, GLICK B R. Strategies used by rhizobia to lower plant ethylene levels and increase nodulation [J]. Canadian Journal of Microbiology, 2002, 48: 947-954.
[26]WELLER D M, RAAIJMAKERS J M, THOMASHOW L S, et al. Microbial populations responsible for specific soil suppressiveness to plant pathogens [J]. Annual Review of Phytopathology, 2002, 40: 309-348.
[27]CHA J Y, HAN S, HONG H J, et al. Microbial and biochemical basis of a Fusarium wilt-suppressive soil [J]. ISME Journal, 2016, 10: 119-129.
(责任编辑:田 喆)

