负载光敏剂的生物可降解纳米药物载体用于肿瘤的光动力治疗
何艳梅 施文强 蔡胜胜 梅蘅 曹俊

摘 要:探讨了生物可降解纳米药物载体负载光敏剂的光动抗癌疗效。以左旋乳酸为单体,1,6-己二醇为引发剂,采用开环聚合方法合成左旋聚乳酸,再将带正电荷的三苯基膦通过酯化反应键合到聚乳酸末端,核磁氢谱结果表明成功地合成了三苯基膦改性的聚乳酸。该聚合物在水中可自组装形成表面带正电荷的纳米粒子(TppT),光敏剂二氢卟吩e6(Ce6)可通过π-π共轭、疏水等作用负载于TppT中形成表面为负电的纳米粒子(TppT@Ce6)。动态光散射和透射电镜结果表明,TppT@Ce6具有球形结构,且负载Ce6后粒径增加、电位降低。TppT@Ce6在10%的血清中的粒径和分布变化较小,具有良好的稳定性。细胞实验结果表明,TppT@Ce6在无激光照射时细胞生长率大于80%;激光照射后,表现出较强的细胞毒性。以上结果表明,本研究所构建的生物可降解纳米药物载体可实现高效的抗肿瘤效果。
关 键 词:π-π共轭;聚乳酸;光敏剂;光动力治疗;纳米药物载体
中图分类号:TQ 317 文献标识码: A 文章编号: 1671-0460(2020)07-1351-05
Application of Biodegradable Nano-drug Carriers Loaded With
Photosensitizers in the Photodynamic Therapy of Tumors
HE Yan-mei, SHI Wen-piang, CAI Sheng-sheng, MEI Heng, CAO Jun
(Biomaterials Engineering Research Center, Sichuan University, Chengdu Sichuan 610065, China)
Abstract: The photodynamic anti-cancer efficacy of biodegradable nanoparticles drug carrier loaded with photosensitizer was explored. With sinistral lactic acid as monomer, 1,6-diol as initiator, levorotatory polylactic acid was compounded by ring opening polymerization method, then positively charged triphenylphosphine was bonded at the terminal of polylactic acid through esterification reaction.Hydrogen nuclear magnetic spectra results showed that the triphenylphosphine modified polylactic acid was successfully synthesized. The polymer could be self-assembled in water to form positively charged nanoparticles(TppT), and the photosensitizer chlorin e6(Ce6) could be loaded into the TppT by π-π conjugation and hydrophobicity to form negatively charged nanoparticles(TppT@ce6).The results of dynamic light scattering and transmission electron microscopy showed that TppT@ce6 had spherical structure, the particle size increased and the potential decreased after the load of Ce6. The particle size and distribution of TppT@ce6 in 10% serum had little change and good stability. The survival rate of TppT@ce6 without laser irradiation was more than 80%. After laser irradiation, cells showed strong cytotoxicity. The above results indicated that the biodegradable nano-drug carrier constructed in this study achieved effective anti-tumor effect.
Key words: π-π conjugation; Polylaticacid; Photosensitizer; Photodynamic therapy; Nano-drug carriers
癌症是严重威胁人类生命健康的重大疾病之一,《2018 年全球癌症报告》预计全球癌症新发病例近2 000 万,而死亡病例高达1 200 万,中国癌症发病率和死亡率高居榜首[1]。手术切除、化疗、放疗和光动力治疗等是肿瘤治疗最常用的手段。光动力治疗(PDT)因其疗效确切、创伤小、毒性小等优势已广泛应用于肿瘤治疗[2-4]。然而,常用的光敏剂,如卟啉(PpIX),二氢卟吩(Ce6)等,因其水溶性差、半衰期短、靶向性低等缺点导致治疗效果不理想[5-8]。纳米药物载体因其独特的纳米级尺寸,可通过实体瘤的高通透性和滞留效应(EPR)将光敏剂靶向递送到肿瘤部位富集,提高其在肿瘤部位的质量浓度,进而增强光动力治疗效果[9-11]。此外,纳米药物载体可通过疏水或π-π共轭等作用将疏水光敏劑包裹于载体内,进而提高其水溶性[12-14]。生物可降解聚合物,如聚乳酸、聚己内酯等因其良好的生物相容性和生物降解性被广泛用于构建纳米药物载体[15-17]。三苯基膦(TPP)作为常用的线粒体靶向分子,通常被引入到纳米药物载体中用于药物的靶向递送。此外,研究报道,由于TPP具有相对亲水的特性,将其引入到生物可降解高分子中,如聚己内酯(PCL),可形成相对两亲性聚合物[18],在水中自组装形成纳米粒子。除靶向功能外,TPP分子富含的π-π共轭基团,使其可望通过多重作用力,如π-π共轭、疏水等,负载疏水性光敏剂分子从而构建纳米药物载体。
本研究通过将带正电荷的三苯基膦键合到生物可降解的聚乳酸末端,形成具有相对亲疏水性能的聚合物(Tpp-PLLA-HI-PLLA-Tpp)。该生物可降解聚合物可在水中自组装形成表面带正电荷的纳米粒子,同时可通过π-π共轭、疏水等作用力将二氢卟吩负载到纳米粒子中,形成负载Ce6的生物可降解纳米粒子(TppT@Ce6)。系统研究了TppT@Ce6在水中的自组装行为、荧光性能、稳定性及光动力治疗效果。
1 實验
1.1 材料
左旋乳酸(LLA,希恩思),4-羧丁基三苯基鏻(Mw= 443 Da, Sigma-Aldrich),二氢卟吩e6(Ce6,希恩思),三氟乙酸酐(99%, Adamas),辛酸亚锡(99.5%, Sigma-Aldrich), 1,6己二醇(HI,Aladdin),1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC,希恩思), 4- 二甲氨基吡啶(DMAP, Sigma- Aldrich),N-羟基磺基琥珀酰亚胺(Sulfo-NHS,希恩思);甲苯,二甲亚砜,乙醚和二氯甲烷均购于成都科龙试剂公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,Sigma- Aldrich);1640培养基,青霉素-链霉素(双抗100X)和胰酶都购买于美国洛根公司;胎牛血清购买于gibco公司;小鼠乳腺癌细胞(4T1)购买于中国科学院细胞库。
1.2 三苯基膦改性的聚乳酸的合成及表征
准确称取左旋乳酸(LLA,3.23 mg,21.9 mmol)和1,6 己二醇(1.77 g,10 mol)加入聚合管中,真空干燥4 h,快速加入0.1%底物质量的辛酸亚锡甲苯溶液。待真空除掉甲苯后,将封管后的反应瓶置于125 ℃油浴中搅拌反应 48 h。反应结束后,聚合管冷却到室温,加入10 mL二氯甲烷溶解,冰乙醚沉淀得到白色固体物质,真空干燥24 h至恒重,得到左旋聚乳酸(PLLA)。
将4-羧丁基三苯基鏻(147.7 mg,0.33 mmol),EDC(63.9 mg,0.33 mmol),DMAP (40.7 mg
0.33 mmol)和 TEA(0.2 mL,0.002 mmol)溶于二氯甲烷中,真空充/放氮气3次,室温条件下搅拌反应3 h,得到羧基活化后的三苯基膦。将PLLA
(2 000 mg,2 mmol)溶于5 mL的二氯甲烷,并缓慢加入羧基活化后的三苯基膦反应液中,搅拌反应48 h。反应结束后经过透处理得到Tpp-PLLA- HI-PLLA- Tpp。通过核磁共振氢谱(Bruker,AV-40)表征聚合物的结构,以CDCl3为溶剂、四甲基硅烷(TMS)为内标,测试频率为 400 MHz。
1.3 空白纳米粒子及负载光敏剂纳米粒子的制备
将750 μg的Tpp-PLLA-HI- PLLA- Tpp溶于200 μL的四氢呋喃中,超声40 min混和均匀,将其缓慢滴加到2 mL去离子水中,待溶剂挥发完后,静置取上清夜得到空白纳米粒子(TppT)。
将Tpp-PLLA-HI- PLLA- Tpp(750 μg)和Ce6 (75 μg)溶解于200 μL的四氢呋喃中,超声40 min混和均匀。将其缓慢滴加到2 mL去离子水中,搅拌至其溶剂完全挥发完后,静置取上清夜得到负载光敏剂的纳米粒子(TppT@Ce6)。
1.4 TppT@Ce6形貌测试
将TppT@Ce6均匀滴加在场发射透射电子显微镜(FEI,Tecnai G2 F20 S-TWIN)专用铜片上,等待水溶剂完全挥发后,用2%的磷钨酸溶液进行染色3 min,再用滤纸除去多余磷钨酸,再静置一段时间后用于观察形貌。
1.5 粒径、电位及TppT@Ce6的荧光测试
TppT及TppT@Ce6的粒径及电位通过 Nano ZS型动态光散射仪(英国马尔文仪器公司)进行测试,测试温度为 25 ℃,分散介质为水,折射系数 1.33,波长为 633 nm,散射角度为90°。
将Ce6 (5 mg)溶解于5 mL的V (DMSO)∶V(H2O)=9∶1的混合溶液。稀释该溶液至质量浓度为 0.6、0.5、0.25、0.125、0.01 μg·mL-1。通过荧光分光光度计(型号:F-7000, Japanese Hitachi)测试其不同Ce6质量浓度下的荧光发射光谱,其中激发波长为400 nm。同样,将TppT@Ce6 溶解于DMSO 中,测试在波长400 nm的激发下的荧光发射光谱。
1.6 TppT@Ce6的稳定性测试
将TppT@Ce6和TppT于室温放置0、4、8、12 h后,采用Nano ZS型动态光散射仪测试其粒径及分散系数。将TppT@Ce6和TppT分别与10%的胎牛血清共培养0 、4、8 h后测试其粒径。
1.7 TppT@Ce6的光动疗效
选取小鼠乳腺癌细胞(4T1)为细胞株,加入10 %胎牛血清以及 1 %双抗(100 U·mL-1 青霉素和 100 U·mL-1链霉素)的 RPMI 1640 培养基于37 ℃恒温培养箱进行培养。随后利用胰酶消化制得 4T1 单细胞悬液体,用 1640 培养基稀释后,吹打均匀,取 100 μL含4T1细胞的培养基置于 96 孔板中, 37 ℃体积分数为5% CO2的培养箱培养24 h后,去除培养基,分别加入100 μL不同质量浓度的含培养基的TppT@Ce6和TppT(以TppT为标准,Ce6质量浓度依照TppT换算),每个质量浓度均设置3个平行样。空白对照组为单纯的培养基培养。待培养12 h后,激光照射3 min再继续培养12 h。随后去掉纳米粒子,加入100 μL PBS洗涤两次,再加入含有10 μL的5 mg·mL-1噻唑蓝(MTT)的无血清培养基,放入培养箱中孵育4 h。培养结束后,吸除MTT溶液,加入100 μL DMSO,37 ℃恒温摇床震荡20 min。采用酶标仪(型号)测定在波长490 nm处的吸光值,通过下面的公式计算出细胞存活率。无激光照射组,除无激光照射3 min外,其他操作步骤相同。
式中:R— 细胞存活率,%;
Ax— 实验组的吸光度值;
Ab— 对照组的吸光度值;
Ac— 空白组的吸光度值。
2 結果与讨论
2.1 Tpp-PLLA-HI-PLLA-Tpp结构表征
Tpp-PLLA-HI-PLLA-Tpp的合成路线和核磁氢谱图如图1所示。当通过酯化反应将Tpp键合到PLLA 末端时,三苯基膦与羰基相邻的质子特征峰出现在δ=(1.83~1.89)×10-6,δ=(1.96~2.07)×10-6,δ=(2.29~2.39)×10-6;PLLA主链上次甲基特征峰出现在δ=(5.07~5.29)×10-6和δ=(5.07~5.29)×10-6。δ=(1.25~1.65)×10-6为PLLA链段甲基的质子峰。δ=(7.50~7.80)×10-6为三苯基膦上苯环对应的质子振动峰。δ=(1.25~1.41)×10-6,δ=(1.49~1.51)×10-6和δ=(4.1~4.2)×10-6是1,6-己二醇上的质子峰。以上核磁结果表明,成功地合成了目标聚合物(Tpp-PLLA-HI-PLLA- Tpp)。
2.2 TppT@Ce6的粒径、电位及形貌表征
如图2(A)所示,带正电的三苯基膦改性聚乳酸(Tpp-PLLA-HI-PLLA-Tpp)与光敏剂分子Ce6可在水中通过疏水、π-π共轭等作用力自组装形成负载光敏剂的纳米粒子(TppT@Ce6)。图2(B)结果显示Tpp-PLLA-HI-PLLA-Tpp可利用亲疏水性自组装成粒径为137 nm、电位为26 mV纳米粒子,说明Tpp作为相对亲水的链段覆盖于PLLA为内核的纳米粒子表面。当负载了Ce6后,其粒径增加到193 nm、电位降低到-8 mV。粒径的增加主要归因于疏水光敏剂Ce6的引入导致聚合物亲水性比例发生变化,当再次自组装时,疏水内核增大,需以较大的粒径状态才可到达稳定。此外,电位的降低证明Ce6可负载到纳米粒子中。透射电镜的结果如图2(D)所示,纳米粒子呈圆球形,尺寸大小分布均匀,粒径约为200 nm左右,与用DLS所检测到的粒径相吻合。以上结果说明疏水光敏剂Ce6成功地负载到TppT纳米粒子中。
2.3 TppT@Ce6荧光光谱
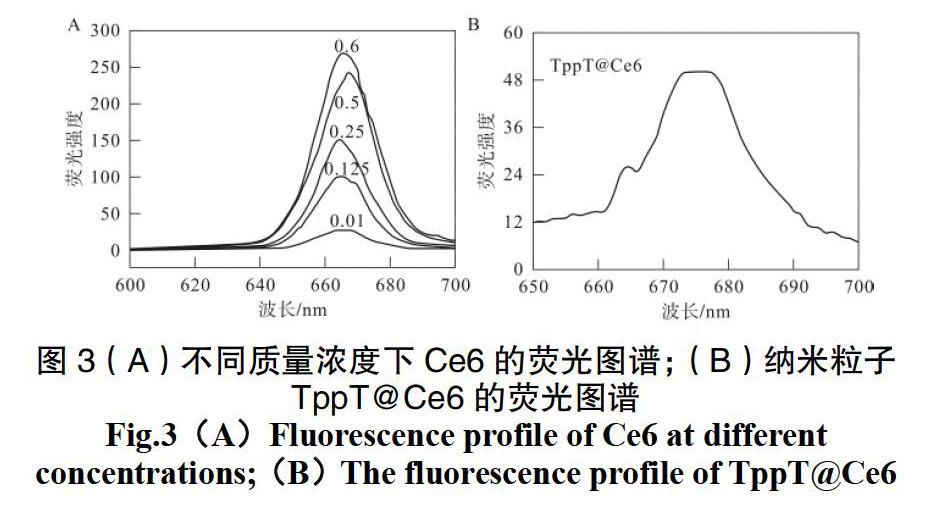
如图3所示,在400 nm的激发下,游离的Ce6在670 nm附近出现了最大发射峰,且随着质量浓度的增加而增加。将Ce6负载于TppT中,荧光光谱结果显示在670 nm附近出现相同的发射峰,说明Ce6成功包裹于TppT中且具有与游离Ce6同样的荧光效应。以上结果表明负载到纳米粒子中的Ce6到达肿瘤部位后,未改变的荧光特性,可展现光动力治疗效果。
2.4 TppT@Ce6的稳定性
纳米药物载体系统因其结构不稳定易在血液循环中泄露药物,进而导致到达肿瘤部位的药物质量浓度降低,影响其抗肿瘤效果,同时对正常组织产生一定的毒性。因此,本研究考察了存放时间及血清对TppT@Ce6稳定性的影响。如图4(A)、 图4(B)所示,TppT@Ce6储存不同的时间粒径和分散系数均变化较小,在0、4、8、12 h时的粒径均为190 nm左右,分散系数0.1左右。
与血清培养后,如图4(C)、图4(D)所示,TppT的粒径在与血清培养4 h后达到1 600 nm,主要是由于带正电荷的TppT易与血清中的蛋白相互作用发生聚集,进而影响纳米粒子的稳定性[19]。
当负载Ce6后,TppT@Ce6的粒径略有增加,说明表面带负电荷的纳米粒子可阻止血清中的蛋白吸附,进而保持纳米结构的完整性[20]。以上结果表明,将Ce6负载到纳米粒子中具有更好的稳定性。
2.5 TppT@Ce6的光动治疗效果
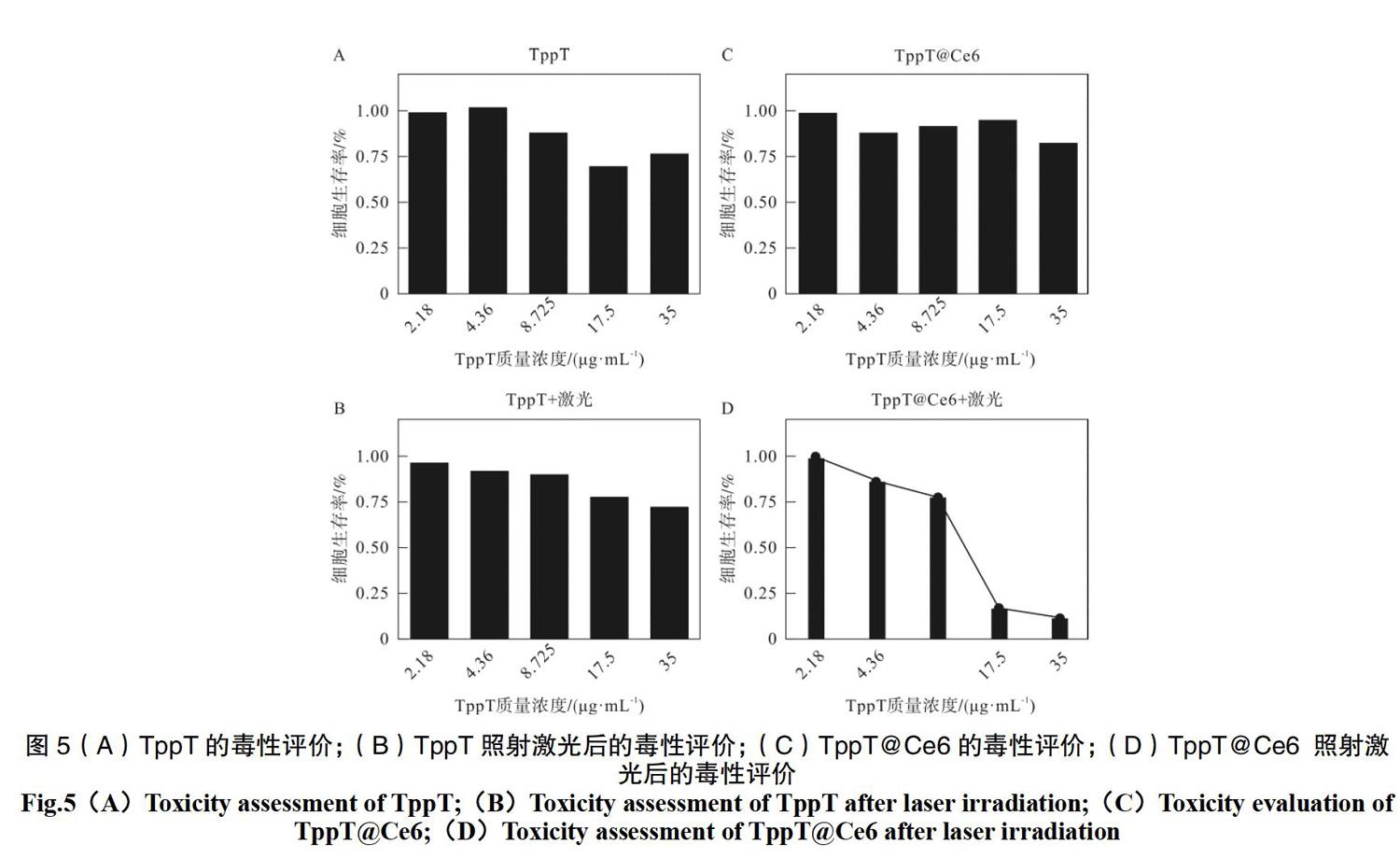
通过MTT法考察TppT和 TppT@Ce6的细胞相容性及光动力治疗效果。将不同质量浓度的TppT和TppT@Ce6与4T1共培养24 h,结果如图5(A)(C)所示。无激光照射时,TppT和 TppT@Ce6在质量浓度低于4.36 μg·mL-1时,细胞存活率都高达80%。当质量浓度增加到8.72 μg·mL-1时,TppT@Ce6的细胞存活率比TppT要高,说明表面带带正电荷的TppT具有一定的细胞毒性,而通过包裹Ce6后形成的表面负电荷纳米粒子,表现出更好的细胞相容性。
当施加激光照射时,TppT在低质量浓度的细胞存活率和未光照时基本一致,均高于80%,说明激光照射对细胞的活性无影响。对于TppT@Ce6组,激光照射后,表现出明显的细胞毒性,当质量浓度为0.32 μg·mL-1,细胞的存活率低于50%,说明具有纳米结构的TppT@Ce6可以进入细胞,并在光照的条件下Ce6产生活性氧,抑制细胞的生长,进而表现出良好的抗肿瘤效果。
3 结 论
本文通过开环聚合和酯化反应成功地合成了三苯基膦改性的聚乳酸。合成的生物可降解聚合物可自组装形成带正电荷的纳米粒子,对疏水光敏剂Ce6具有良好的负载能力且不影响Ce6的光学性能。 负载Ce6后的纳米粒子表现出良好的稳定性及高效的光动力治疗效果。因此,本研究所构建的纳米药物载体系统可实现对疏水药物的高效负载且表现出较好的抗肿瘤效果。
参考文献:
[1]SIEGEL R L, MILLER K D, AJEMAL. Cancer statistics, 2018[J].CA Cancer J Clin, 2018, 68: 7-30.
[2]MANSOORI B, MOHAMMADI A, KAMARI F, et al. Photodynamic therapy for cancer: role of natural products [J]. Photodiagnosis Photodyn Ther, 2019, 26:395-404.
[3]ZHANG Y, YANG Z, ZHENG X,et al. Heavy atom substituted near- infrared BODIPY nanoparticles for photodynamic therapy[J]. Dyes and Pigments,2020, 178:108-348.
[4] 万勃.光动力疗法的研究进展[J].广东化工,2019,46(7):124-127.
[5]王思宇. 非对称轴向卟啉光敏剂的合成及性能研究[D].长春:长春理工大学,2019.
[6]张宏悦.二氢卟吩叶绿素类光敏剂的制备及光动力治疗活性的研究[D]. 哈尔滨:哈尔滨师范大学,2019.
[7]张祚德,王安元,郝建冬,等.二氢卟吩e6脂质体在荷瘤小鼠体内的药动学及靶向性分析[J].中国实验方剂学杂志,2018,24(13):71-77.
[8]刘萍,于雪峰,王玉凤,等.二氢卟吩类光敏剂在光动力疗法治疗恶性肿瘤中的研究进展[J].现代肿瘤医学,2020,28(1):177-180.
[9]秦晓飞,史海涛,崔兴业,等.二氢卟吩e6在艾氏荷瘤小鼠体内的分布[J].中国实验动物学报,2011,19(2):91-94.
[10]蒋小红,黄嬛. 二氢卟吩载药胶团的制备及体外光动力效应研究[J].安徽农业科学,2014,42(16):5034-5036.
[11]张海,张学全,赵明颖,等. 生物可降解聚(己内酯-β-苹果酸内酯)两亲性高分子的合成及作为药物载体研究[J]. 当代化工,2018,47(4):662-672.
[12]WHITESIDES G M,GRZYBOWSKI B. Self-assembly at all scales [J]. Science, 2002, 295: 2418-2421.
[13]WANG C, CHEN Q, WANG Z, et al. An enzyme-responsive polymeric superamphiphile[J]. Angewandte Chemie, 2010, 122: 8794-8797.
[14]LI F Y, PARK S J, LING D S, et al. Hyaluronic acid-conjugated graphene oxide/photosensitizer nanohybrids for cancer targeted photodynamic therapy[J]. Journal of Materials Chemistry B,2013, 1:1678-1686.
[15]XIONG X Y, LI Z L, TAM K C, et al. Comparison between the self-assembling behaviors of PLLA-PEO-PLLA triblock copolymers and PLLA-PEO-PPO-PEO-PLLA pentablockcopolymers[J].Journal of Applied Polymer Science,2009, 5:2445-2451.
[16]王冯喆. 基于聚乳酸—乙醇酸与聚乙二醇纳米诊疗载体构建及表征[D].广州:暨南大学,2018
[17]PARTSEVSKAYA S V, ZHELTONOZHSKAYA T B, PERMYA- KOVA N M, et al. Biocompatible and biodegradable MOPEO-b-PCL diblock copolymer micelles as nanocontainers for drugs[J].Materialwissenschaft und Werkstofftechnik, 2011, 42(2): 123-130.
[18]AVTI P K, MAYSINGER D, KAKKAR A.Alkyne-Azide "Click" chemistry in designing nanocarriers for applications in biology[J]. Molecules,2013, 18(8):9531-9549.
[19]DU J Z, SUN T M, SONG W J,et al. A tumor-acidity-activated charge-conversional nanogel as an intelligent vehicle for promoted tumoral-cell uptake and drug delivery[J]. Angewandte Chemie,2010, 122:3703-3708.
[20]JORALEMON M J, MCRAE S, EMRICK T. PEGylated polymers for medicine: from conjugation to self-assembled systems[J]. Chemical Communications, 2010, 46:1377-1393.
收稿日期: 2020-04-02
作者簡介:何艳梅(1994-),女,新疆自治区库尔勒市人,硕士研究生,研究方向:多功能纳米给药系统。E-mail:heyanmeiedu@163.com。
通讯作者:曹俊(1986-),女,副教授,硕士生导师,研究方向:多功能药物载体。E-mail:caojun@scu.edu.cn。

