虎杖有效成分对DN模型小鼠肾组织病理改变的影响*
王达利,孟凤仙,商学征,王 洁,张承承,白 华,卜祥伟,张正菊,刘豫玥
(1.北京市房山区燕山地区社区卫生服务中心,北京 102500;2.北京中医药大学东方医院,北京 100078;3.北京市顺义区中医院,北京 101300;4.北京市西城区广外医院,北京 100053;5.厦门大学医学院中医系,厦门 361005)
现代研究认为糖尿病肾病(DN)是一种由于代谢紊乱等多因素引起的肾脏慢性炎性疾病[1],已成为一种严重的公共卫生问题。DN晚期可出现严重肾衰竭,是糖尿病患者死亡的主要原因之一。本课题组认为DN发病强调累及肾脏病变,肾消精液枯竭,经络血涩,荣卫不行,热气留滞;肾虚不化,以致湿浊内停;糖尿病久治不愈,湿、热、瘀、浊壅滞化生内毒,损伤肾络。结合多年临床实践经验,认为肾阴亏虚,瘀毒、内热、湿浊互结为本病发病核心,三者既为发病因素又为病理产物。虎杖为草本植物,具有清热解毒、散瘀止痛之效,取其泄“浊”之意,在控制糖尿病肾病方面有一定疗效[2]。现代药理研究,虎杖主要成分是大黄素、虎杖苷,该成分能够抗炎,抗氧化,改变血流变,抑制免疫炎性反应等作用[3]。本研究观察虎杖有效成分大黄素、虎杖苷对DN模型小鼠肾组织病理改变的影响,探讨其对肾小球、肾小管病变,肾间质炎症,肾小球基质相对面积以及肾组织超微结构的影响,以期为临床治疗提供理论依据。
1 材料与方法
1.1 材料 SPF级雄性8~9周龄自发性2型糖尿病模型 KK-Ay小鼠 90只,体质量(30.94±1.67)g(北京华阜康实验技术有限公司,许可证号:SCXK(京)2009-0004)。SPF级雄性8~9周龄 C57BL/6J小鼠 6 只,体质量(24.57±1.60)g(北京华阜康实验技术有限公司,许可证号:SCXK(京)2009-0007)。小鼠饲养于北京中医药大学屏障级动物实验室[SYXK(京)2011-0024],单笼饲养,室温 18~24℃,相对湿度40%~70%。2种配方的高脂饲料,配方1:蛋白质10%,脂肪10%,葡萄糖10%,70%全价营养颗粒饲料;配方2:猪油20%,葡萄糖6%,蛋黄粉13%,酪蛋白8%,基础饲料53%(北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2009-0008)。普通饲料购自北京科澳协力饲料有限公司。虎杖苷(中国药品生物制品检定所,生产批号111575-200502);大黄素(中国食品药品检定研究所,生产批号 110756-200110)。缬沙坦:80 mg×7粒×1盒(北京诺华制药有限公司,生产批号:SC1300)。
1.2 造模及分组 所有小鼠适应性饲养2周后,C57BL/6J小鼠予普通饲料喂养;KK-Ay小鼠给予高脂饲料配方1喂养3 d,配方2喂养3 d,普通饲料喂养3 d,3种饲料交替使用诱导3周。检测KK-Ay小鼠随机血糖≥13.9 mmol/L,24 h尿蛋白高于正常组,DN模型诱导成功。90只KK-Ay小鼠均造模成功,成模率100%。根据血糖及体质量水平随机选择84只小鼠均分为模型组,阳性药组,大黄素高、中、低剂量组,虎杖苷高、中、低剂量组,丙药、丁药高、中、低剂量组,每组6只(本实验不对丙药、丁药进行观察)。
1.3 干预方法 正常组及模型组予去离子水10mL/(kg·d)灌胃,阳性药组予缬沙坦13.33mg/(kg·d)灌胃。大黄素各组分别予13.33、6.67、3.33 mg/(kg·d)大黄素灌胃;虎杖苷各组分别予13.33、6.67、3.33 mg/(kg·d)虎杖苷灌胃。根据体表面积换算,小鼠用药等效剂量为正常人体的10倍。各组小鼠每日灌胃1次,连续干预12周。由于操作失误,灌胃过程中大黄素低剂量组小鼠死亡1只。
1.4 肾脏组织病理学检测 干预12周后,小鼠麻醉取血,处死,迅速摘取双侧肾脏。1/2左肾置于10%中性福尔马林溶液固定,以备光镜观察及免疫检测,取材、脱水、包埋、4 μm切片后,行苏木精-伊红(HE)和高碘酸希夫氏(PAS)染色。HE染色镜下观察肾小球、肾小管及肾间质的病变,对上述病变进行评分;对于PAS,每张切片在40倍物镜下随机选取10个正切的肾小球,测量并计算肾小球基质相对面积,即肾小球基质面积/肾小球面积×100%,取均值(Olympus DP71分析系统)。1/2左肾置于2.5%戊二醛固定,以备电镜检测观察肾组织形态改变。右肾迅速置于液氮中保存。
1.5 诊断标准 参照《肾脏病理学诊断技术》,结合本试验糖尿病肾病模型中肾组织病变的性质及程度制定以下诊断标准(表1):1个+号代表1分,计算每只动物肾脏分类评分及总积分,总积分=肾小球病变评分+肾小管病变评分+炎性坏死评分。
1.6 统计学处理 结果采用SPSS 20.0软件进行统计分析,等级资料组间比较采用非参数检验Kruskal-Wallis H法进行统计处理,组间两两比较采用All Pairwise法进行统计处理。肾小球基质相对面积的结果以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法。P<0.05为差异有统计学意义。
2 各组小鼠肾组织病理改变结果
2.1 光镜下观察HE染色切片 HE染色下,观察正常组小鼠的肾小球及肾小管未见明显病变,肾间质未见炎症细胞浸润,肾组织结构正常。模型组所有小鼠的肾小球均有不同程度的增大,系膜基质轻、中度增生,个别肾小球基底膜增厚;大部分小鼠可见少量的肾近曲小管上皮细胞空泡变性,部分肾小管轻、中度扩张,基底膜增厚;除外1只小鼠均伴有少量炎症细胞浸润,以淋巴细胞为主。与正常组比较,模型组小鼠肾脏肾小球、肾小管具有显著病变,伴有炎症细胞浸润,差异有统计学意义(P<0.05)。阳性药组除外1只小鼠肾脏未见明显病变,大部分小鼠肾脏均有显著病变,与模型组比较未见显著差异(P>0.05)。在改善肾小球病变方面:与模型组比较,大黄素高剂量、虎杖苷高剂量组小鼠的肾小球病变有减轻趋势,差异无统计学意义(P>0.05);在改善肾小管病变方面:与模型组比较,虎杖苷高剂量组小鼠肾小管病变显著减轻(P<0.05),大黄素各剂量组、虎杖苷低剂量组小鼠肾小管病变有减轻趋势,差异无统计学意义(P>0.05);在减轻肾间质炎症方面:与模型组比较,虎杖苷低剂量组小鼠肾间质炎症有减轻趋势,差异无统计学意义(P>0.05),其余各组肾间质炎症与模型组相比未见明显差异。
综合考虑肾脏病变情况,比较各组小鼠肾脏病变总积分。与正常组比较,模型组小鼠肾脏病变总积分显著升高(P<0.01)。与模型组比较,阳性药组,大黄素各剂量组,虎杖苷高、低剂量组小鼠肾脏病变总积分具有减轻趋势,差异无统计学意义(P>0.05)。详见表2,图1。

表1 DN模型小鼠肾脏病变的诊断标准

表2 各组小鼠肾脏病变总积分比较

图1 各组小鼠肾脏组织变化情况(HE,400×)
2.2 肾小球基质相对面积 PAS染色下,测量并计算肾小球基质相对面积。正常组小鼠光镜下可见肾小球结构正常,系膜基质未见增生。与正常组比较,模型组小鼠肾小球系膜基质增生,基底膜增厚,模型组小鼠肾小球基质相对面积显著增高,差异有统计学意义(P<0.01)。光镜下观察可见阳性药组,大黄素各剂量组,虎杖苷中剂量组小鼠肾小球系膜基质可见不同程度的增生。与模型组比较,大黄素高剂量组,虎杖苷各剂量组小鼠肾小球基质相对面积显著降低,差异有统计学意义(P<0.01,P<0.05)。详见表 3,图 2。
2.3 电镜检查 电镜能够观察到光镜下不能分辨的超微病理改变和特殊结构。足细胞受损是DN发生发展的核心事件[4],本研究采用电镜检测小鼠肾组织足细胞的超微结构改变。正常组小鼠肾组织基底膜正常,组织紧密。模型组小鼠肾组织可见基底膜增厚,足突倒伏、融合,肾间质纤维化,符合DN病理表现。与模型组比较,阳性药组小鼠肾组织超微结构病变较轻,基底膜薄厚较均一,足突形状欠整齐,部分足突倒伏、融合,肾小球未见纤维化改变;大黄素高剂量组小鼠肾组织部分基底膜增厚,足突倒伏、融合;大黄素中剂量组基底膜欠均一,足突倒伏、融合;大黄素低剂量组部分基底膜增厚,部分足突倒伏、融合;大黄素各剂量组肾小球均未见固化或纤维化。虎杖苷高剂量组小鼠肾小球损伤较严重,肾小球固化,可见纤维化;虎杖苷中剂量组基底膜较均质,足突基本正常,少量倒伏、融合;虎杖苷低剂量组基底膜欠均一,大量足突倒伏、融合。虎杖苷各剂量组中,虎杖苷中剂量组明显改善小鼠肾组织超微结构病变。
表3 各组小鼠肾小球基质相对面积统计结果(±s)

表3 各组小鼠肾小球基质相对面积统计结果(±s)
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01。
组别 动物数 肾小球基质相对面积(%)对照组 6 0.115±0.044模型组 6 0.197±0.062**阳性药组 6 0.185±0.050大黄素高剂量组 6 0.159±0.058#大黄素中剂量组 6 0.184±0.053大黄素低剂量组 5 0.167±0.045虎杖苷高剂量组 6 0.112±0.057##虎杖苷中剂量组 6 0.135±0.068##虎杖苷低剂量组 6 0.102±0.068##
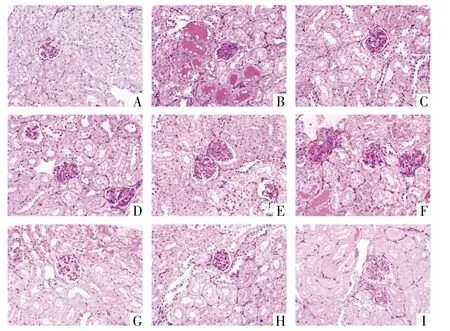
图2 各组小鼠肾小球系膜增生情况(PAS,400×)

图3 各组小鼠肾组织超微结构(电镜,15000×)
3 讨论
目前广泛接受高血糖是导致DN的核心环节[5],而氧化应激、细胞因子相互作用、自噬行为、遗传等因素,加速了DN发生发展[6]。越来越多的研究证明,炎症反应在DN发病机制中的重要作用[1]。
虎杖及其有效成分在抗病毒、抗氧化、抗血栓、改善微循环、消炎镇痛及调节代谢方面的药理作用成为学术界研究的热点之一[7]。现代药理研究发现,其主要的活性成分为大黄素及白藜芦醇(虎杖苷),两者在抑制DN损伤中发挥重要作用。有报道指出,虎杖苷通过抑制了DN的氧化损伤,保护近球肾小管Na+,K+-ATPase活性,进而使肾功能免受高糖环境介导的损害[8]。虎杖苷可以通过调节Toll样受体4(TLR4)/核转录因子(NF-κB)信号通路,下调炎症因子表达水平,改善DN大鼠肾脏的炎性损伤[9]。而大黄素作为虎杖的另一主要成分,在治疗DN损伤中具有重要意义。临床研究发现,大黄素能够抑制DN患者外周血中单核细胞趋化因子(MCP-1)表达水平,降低尿蛋白、改善肾功能。为了进一步明确虎杖的两种有效成分对DN肾脏损伤的改善作用,本实验选用KK-Ay小鼠予高脂饲料诱导3周制备小鼠DN模型,分组后药物干预12周,通过HE、PAS染色后光镜下观察,模型组小鼠肾脏病理改变符合DN,各给药组对DN模型小鼠肾病理损伤有不同程度的改善作用,其中经虎杖苷高剂量干预后可显著减轻模型动物肾小管病变,减缓近曲小管空泡变性、扩张,基底膜增厚病理状态;大黄素高剂量,虎杖苷各剂干预显著降低肾小球基质相对面积,有效减轻肾小球系膜基质增生,抑制肾小球硬化及肾组织纤维化。从病理学角度观察虎杖有效成分对减轻肾间质炎性浸润不明显,需通过对其炎性细胞因子的影响做进一步的研究。
足细胞损伤包括足细胞数量减少及足突的增宽倒伏、融合消失,与蛋白尿的产生和肾小球硬化的发生关系密切。因此减轻DN肾组织足细胞足突融合、消失,可以减轻足细胞损伤,对DN模型小鼠的肾脏具有一定保护作用。本次研究结果显示,大黄素可改善DN模型小鼠肾小球病变,肾小球均未见固化或纤维化。虎杖苷高剂量组肾小球损伤较严重,可能与虎杖苷高剂量药物毒性有关。虎杖苷中剂量可明显改善DN模型小鼠肾组织超微结构病变,足细胞足突结构基本正常。虎杖苷中剂量可改善足细胞足突倒伏、融合情况,对探讨虎杖苷改善肾小球硬化,减少尿蛋白具有重要意义。本文检测了虎杖有效成分大黄素、虎杖苷对改善DN模型小鼠肾脏病理损伤的作用,为研究单味中药发挥临床作用机制提供证据,其肾脏保护作用的调节机制有待更深层次的探索。
由此可见,虎杖有效成分大黄素、虎杖苷可不同程度减轻DN模型小鼠肾组织病理损伤,改善肾小管病变;延缓肾小球细胞外基质增生,改善肾小球病变,抑制肾小球硬化及肾组织纤维化,对其肾脏病变具有保护作用。但具体的作用机制还需进一步探究。

