超声心动图评价感染性心内膜炎累及二尖瓣-主动脉瓣纤维连结
于仲雪,白 洋,杨 军
(中国医科大学附属第一医院心血管超声科,辽宁 沈阳 110001)
二尖瓣-主动脉瓣纤维连结(Mitral-aortic intervalvular fibrosa,MAIVF) 位于二尖瓣前叶与主动脉瓣左、无冠瓣之间,是心脏纤维骨架的组成部分[1],在感染性心内膜炎(Infective endocarditis,IE)发生时该部位亦可能受累,形成脓肿甚至破裂,但由于其结构细微,在超声诊断中容易被忽视。 MAIVF 作为主动脉瓣及二尖瓣的交界点, 其受累往往意味着感染的播散,纤维结构遭到破坏,患者的病情有进一步加重的可能,手术风险大,难度高。 利用超声心动图技术对MAIVF 受累情况进行及早的诊断,能够指导临床尽早的干预治疗,降低患者的死亡风险。
1 资料与方法
1.1 研究对象
选取 2010 年10 月—2018 年9 月于我院超声诊断 IE 累及 MAIVF 的患者, 共 18 例, 其中男 14例,女 4 例,年龄 28~66 岁,平均 43 岁。 其中 8 例接受手术治疗。
1.2 仪器与方法
检查仪器包括Philips EPIC 7C、IE33 超声诊断仪,X5-1、S5-1 经胸探头及 X7-2t 经食道探头,GE E95 超声诊断仪,M5SC 经胸探头。 经胸超声心动图(TTE)或经食道超声心动图(TEE)获得患者全方位心脏图像,图像存储于光盘中。 搜集患者临床信息,总结并分析患者的临床特点, 手术结果与超声心动图表现相对比。
1.3 MAIVF 的测量及受累情况分类
MAIVF 厚度在 TTE 左室长轴切面、TEE 三腔或五腔心切面选取二尖瓣前叶瓣根与主动脉后壁交界处测量。 根据受累MAIVF 的厚度、形状、回声、是否存在血流对IE 累及MAIVF 的图像特征进行回顾性总结分析。
1.4 超声特征与手术所见对比分析
对比超声图像特征与术中所见, 分析不同超声图像特征产生的病理基础。
2 结果
2.1 临床信息
18 例患者中,男 14 例,女 4 例,年龄 15~66 岁,平均43 岁。2 例有人工瓣膜置换史,2 例诊断白塞氏病,1 例诊断干燥综合征。患者临床表现为间断或持续发热,2 周至6 月不等,多伴心悸、胸闷、气短。 11例血培养阳性,草绿色链球菌3 例,葡萄球菌2 例,缺陷乏氧菌2 例,铜绿假单胞菌1 例,其他链球菌3例,7 例血培养阴性。8 名手术患者中,4 例接受了二尖瓣、主动脉瓣置换及纤维连结重建术,1 例接受了Bentall、二尖瓣成形及纤维连结重建术,3 例接受主动脉瓣置换术。
2.2 超声心动图特点
17 例接受 TTE 检查,7 例接受 TEE 检查。
2.2.1 一般超声特点
18 例患者中,13 例(72.2%)合并主动脉瓣瓣叶数目畸形, 其中12 例为主动脉瓣二叶式畸形,1 例为主动脉瓣四叶式畸形,另有2 例(11.1%)为人工主动脉瓣。 多普勒超声显示主动脉瓣瓣叶轻度以上狭窄 3 例(16.7%),轻度以上反流 13 例(72.2%),二尖瓣轻度以上反流6 例(33.3%),所有患者均无二尖瓣狭窄。 17 例(94%)发现主动脉瓣赘生物,10 例(55.6%)发现二尖瓣赘生物。 大部分患者左心内径不同程度增大。
2.2.2 IE 累及 MAIVF 表现
①MAIVF 增厚(图 1a,1b)(8 例,44.4%):超声特征为主动脉根部延续至二尖瓣前叶的增厚((7.0±1.5)mm),一般为等回声,彩色多普勒无血流显示。②MAIVF 区域团块形成 (图 1c,1d)(4 例,22.2%):超声特征为弱回声或等回声的不规则团块, 大小14~22 mm,3 例无血流进入,1 例形成了主动脉-左室、主动脉-左房瘘道。 ③MAIVF 区域囊腔(图 2)(6例,33.3%): 超声特征主动脉根部延续至二尖瓣前叶的无回声或弱无混合回声空腔, 多为圆形或椭圆形,大小10~30 mm,有血流进入者形状略不规则,大小随心动周期变化明显,1 例无明显血流进入,4 例囊腔与左室沟通,1 例形成了主动脉-左室瘘道。
2.2.3 TTE 和TEE 检查结果对比

图1 图1a:左室长轴切面显示主动脉根部-二尖瓣前叶增厚。图1b:大动脉短轴切面显示主动脉后壁增厚。图1c:左室长轴切面显示主动脉根部-二尖瓣前叶处明显增厚,呈不规则团块状,表面回声粗糙。 图1d:大动脉短轴切面显示主动脉后壁不规则增厚。 AO:主动脉;LA:左房;LV:左室;RA:右房;RV:右室。Figure 1. Figure 1a: Thickened MAIVF in the left ventricular long axis view. Figure 1b: Posterior wall of aorta thickening in the aorta short axis view. Figure 1c: MAIVF thickening obviously, rough in the surface like irregular mass in the left ventricular long axis view. Figure 1d: Posterior wall of aorta obviously thickening in the aorta short axis view. AO: aorta; LA: left atrium; LV: left ventricle; RA: right atrium;RV: right ventricle.
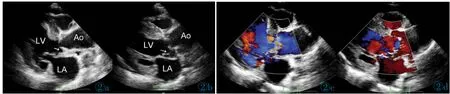
图2 左室长轴切面显示主动脉根部-二尖瓣前叶区域囊腔形成, 图2a,2c:舒张期囊腔塌陷。 图2b,2d:收缩期囊腔扩张。 图2d:CDFI 显示收缩期囊腔有血流进入。 AO:主动脉;LA:左房;LV:左室。Figure 2. Saccular structure formation in MAIVF in the left ventricular long axis view. Figure 2a, 2c: Saccular structure collapsed in diastole period. Figure 2b, 2d: Saccular structure expanded in systole period. Figure 2d: CDFI indicated blood entered saccular structure in systole period. AO: aorta; LA: left atrium; LV: left ventricle.
6 例同时接受了 TTE 和 TEE 检查,4 例患者经TTE 无法确认脓肿灶存在, 经TEE 检查进一步明确,1 例TTE 未发现受累部位存在明显血流信号,经TEE 发现受累部位有血流信号。
2.2.4 超声表现与手术所见对比
超声表现为MAIVF 增厚的患者有3 例经外科手术证实,术中可见MAIVF 区域存在限局小脓肿,1例患者否认MAIVF 脓肿,其增厚可能是局部组织水肿所致。 超声表现为囊腔形成的患者有1 例经手术证实,术中可见右冠瓣脓肿形成,延续至MAIVF 及二尖瓣前叶。 超声表现为区域团块形成的患者有3例经手术证实,1 例术中可见左右冠瓣交界处脓肿已侵袭瓣环,有大量增生炎性组织;1 例可见主动脉瓣与二尖瓣移行处及二尖瓣前叶组织肿胀、 赘生物附着;1 例主动脉瓣二尖瓣均可见大量赘生物形成,无冠窦主动脉壁可见脓肿。
3 讨论
MAIVF 位于二尖瓣前叶与主动脉瓣左、无冠瓣之间,是心脏纤维骨架的组成部分[1]。 由于左右两侧的纤维三角结构,一般情况下其纤维致密不易受累,但是在IE 发生时, 少数情况仍会导致MAIVF 的破坏,如脓肿、假瘤形成,甚至断裂,发生率约1.6%[2]。MAIVF 的受累可能继发瓣膜功能的异常、心腔间的分流甚至是心包填塞。
IE 累及MAIVF 可能与该部位自身的薄弱或结缔组织病变有关。 本组病例中主动脉瓣病变情况明显重于二尖瓣, 提示IE 累及MAIVF 时感染多源于主动脉瓣。 13 例合并了主动脉瓣叶数目异常(先天性主动脉瓣二叶式畸形12 例,四叶式畸形1 例),可能是由于主动脉瓣瓣叶数目异常的患者MAIVF 先天发育薄弱,IE 发生时更易受累[3]。 Tribouilloy 等[4]认为先天性主动脉瓣二叶式畸形的患者主动脉壁的形态异常会导致瓣周结构更易受损。 2 例患者系人工瓣膜置换术后, 尽管主动脉瓣置换术本身会导致MAIVF 的受累, 但是合并IE 会使这种风险大大提高。 Selvin 等[5]对MAIVF 假瘤形成的回顾性分析中发现,人工瓣膜置换的患者约占52%,其中76%的患者合并IE。 2 例患者合并白塞氏病,1 例表现为MAIVF 区域团块形成合并瘘道,伴心内巨大赘生物形成,1 例表现为MAIVF 区域囊腔。 白塞氏病累及心脏往往是预后不良的表现, 其全身性的炎症反应会导致心内膜的纤维化,附壁血栓的形成,瓣膜和大血管的炎症。白塞氏病最常累及主动脉瓣,表现为瓣膜的脱垂和返流,在Lihong 等[6]的研究中合并IE 的白塞氏病患者50%表现为瓣周脓肿。 干燥综合征是一种慢性自身免疫病, 患者不良的口腔状况可能会导致 IE 的发生风险增加[7-8]。 Koichi 等[7]报道了 1 例干燥综合征患者的IE, 出现了严重的主动脉瓣脓肿, 术后病理显示受累的主动脉瓣存在慢性炎症反应。当IE 的患者合并瓣叶数目异常、白塞氏病、干燥综合征及其他结缔组织病时,应该密切关注MAIVF的受累情况。
本研究发现IE 累及MAIVF 可以有多种超声表现:①MAIVF 增厚;②MAIVF 区域囊腔;③MAIVF区域团块。 手术结果证实,MAIVF 增厚的可能是脓肿形成的早期表现,也可能是脓肿体积较小,局限在该区域内,同时,炎症导致的组织水肿也可能表现为该区域的增厚。 表现为增厚时,病变程度相对较轻,MAIVF 结构稳定,不易破坏造成心腔间的分流。 囊腔形成可能是由于脓肿进一步扩大, 或者是局部组织受损在压力作用下形成的,血流的冲击使MAIVF稳定性降低,此时易与心腔形成沟通,可能造成心腔间的分流。MAIVF 区域团块形成往往是感染较重的表现,3 例患者均在术中发现大量赘生物形成,团块的形成可能是由于局部大量组织的坏死,MAIVF 破坏严重,需要及时的手术处理。
MAIVF 区域的脓肿可以破溃或自然引流继发形成二尖瓣-主动脉瓣纤维连结假瘤(Pseudoaneurysm of the mitral-aortic intervalvular fibrosa,P-MAIVF)[9], 或者形成瘘道与主动脉或心腔沟通。P-MAIVF 在超声心动图上表现为主动脉瓣与二尖瓣间的膨出瘤样结构,开口通向左室流出道,大小随心动周期有明显变化,收缩期血流进入,瘤体扩张膨向左房侧,舒张期塌陷。 P-MAIVF 的形成可能进一步导致冠脉的压迫,栓塞事件的发生,破裂后甚至导致心包填塞[5]。P-MAIVF 不是全部继发于MAIVF 脓肿,也可见于外科手术、创伤带来的MAIVF 局部受损,在压力阶差的作用下形成假瘤,也有先天性PMAIVF 的报道[10]。 由于 MAIVF 的特殊解剖位置,该处脓肿破溃可能引起继发的心腔间瘘道, 包括主动脉-左室瘘、主动脉-左房瘘、左房-左室瘘。 瘘道形成时根据两侧心腔压力不同, 彩色多普勒在瘘口处可探及收缩、 舒张期往返或全心动周期五色镶嵌的血流信号,频谱多普勒可探及高速分流信号。瘘道形成会进一步急性加重患者的心衰症状, 增加患者房室传导阻滞等并发症的发生概率[11]。
MAIVF 受累往往意味着感染的播散,但受累自身对二尖瓣瓣膜功能影响较小, 除瓣膜脱垂的患者外,其他患者瓣膜返流或狭窄的情况并不严重,可能与脓肿体积较小有关, 区域团块型患者出现了轻度左室流入道梗阻。 此外,5 例患者出现了二尖瓣前叶的穿孔,这可能由于感染常通过MAIVF 蔓延至二尖瓣前叶,导致该处结构的薄弱,容易形成穿孔。
超声心动图是评价心内结构的有效筛查手段,相较于CT 和MRI,有着灵活、即时的优势,广泛应用于患者术前、术中和术后的评价。超声心动图对于IE 累及MAIVF 患者的评价主要分为3 个部分:①确定IE 累及MAIVF。当超声心动图诊断IE,特别是主动脉瓣IE 时,因注意观察MAIVF 区域,当形成团块状脓肿时不易漏诊,但仅表现为增厚和小囊腔时,应提示临床注意脓肿可能。②观察MAIVF 周围血流信号。可能的血流异常包括脓肿与心腔相通、形成心腔间瘘道或破坏二尖瓣形成穿孔, 存在血流沟通者局部破裂的风险增加, 提示患者可能发生急性心衰加重的风险。③观察IE 的其他并发症。IE 常伴随瓣膜的破坏, 超声心动图能准确判断瓣膜的狭窄或返流程度,赘生物的形成情况,预测栓塞事件的发生。TEE 分辨率高,干扰条件少,可以减少二维和彩色血流伪像,对细小病变的诊断准确率较高,三维超声心动图可以更准确辨别脓肿范围, 明确与周围组织的解剖关系,TEE 和三维超声心动图可以为外科手术提供更具体的信息[12], 因而怀疑IE 累及MAIVF 者应该进一步行TEE 及三维超声心动图检查。
尽早地手术治疗对于MAIVF 脓肿的患者是至关重要的,早期手术可以防止脓肿的扩大、破裂、防止感染的播散, 减少并发症的发生, 提高术后生存率[13]。 该类手术难度极大,需要彻底的清除脓肿组织,置换瓣膜,重建MAIVF,术式复杂,手术时间长,术后死亡率高达52%[2]。 术前需要精细的影像学检查,帮助术者制定详细的手术计划。
总之,MAIVF 受累是IE 的罕见并发症,需要及时手术治疗,对于合并主动脉瓣叶数目异常、人工瓣膜置换及白塞氏病的IE 患者应注意MAIVF 有无异常改变,并进一步进行TEE 检查。 超声心动图可以准确判断MAIVF 脓肿的大小、形态、位置及血流情况,为制定手术方案提供完整的信息。

