植物糖原负载提高姜黄素的稳定性和生物活性
韩兴曼,樊金玲,王 攀,朱文学,任国艳
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
姜黄素(curcumin,CCM)具有多种生理和药理活性,如抗氧化、抗肿瘤、抗人类免疫缺陷病毒作用、抗纤维化作用等,同时也是国内外广泛使用的天然食用色素[1]。CCM的耐热性好、安全性高[2],但CCM的水溶性很低(11 ng/mL、25 ℃)[3],紫外稳定性差[4],中性及碱性条件下易降解[5],跨膜转运率低[6]。这些缺陷不仅影响CCM生物活性的充分发挥,而且极大程度上限制了其在食品、保健品等领域的应用。
植物糖原(phytoglycogen,PG)是由α-1,4和α-1,6-糖苷键连接的、高度支化的可溶性α-D-葡聚糖,是一种具有“外紧内松”球型结构的天然纳米粒[7-8]。PG分子表面和内部存在大量的葡萄糖残基,可参与形成氢键,因此PG易溶于冷水或与其他物质相互作用。PG球型纳米粒的分子分散密度沿半径方向呈梯度变化,即由外至内的分子分散密度由大到小,这使得PG分子内部形成相对疏水的环境,有利于PG与极性较小的物质发生相互作用。
本课题组采用PG负载CCM,制备PG-CCM复合物,使CCM的表观溶解度提高了约2 700 倍;PG-CCM中CCM以无定形非晶体结构存在,氢键和疏水相互作用是二者结合的主要作用力[9]。基于上述成果,本实验着重考查了PG负载后CCM的紫外稳定性以及在不同pH值条件下的稳定性;同时,采用总还原力测定等方法研究了PG-CCM的抗氧化活性,采用噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)法检测了PG-CCM对MCF-7和A549癌细胞的抑制活性。结合PG-CCM复合物中CCM的存在状态、PG与CCM相互作用力以及CCM的分布特征,探讨了负载前后以及不同复合物样品中CCM稳定性和生物活性变化的可能机制,PG负载对于改善CCM的稳定性和提高生物利用率具有重要意义。
1 材料与方法
1.1 材料与试剂
加强型甜玉米‘中甜8号’ 北京金农科种子科技有限公司。
C1386 CCM 美国Sigma公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 上海蓝季生物科技有限公司;DMEM培养基 美国HyClone公司;胎牛血清 江苏恩莫阿赛科技有限公司;胰消化酶 合肥Biosharp科技有限公司;A549细胞 国家实验细胞资源共享服务平台(北京总部);MCF-7细胞ATCC细胞库;其他试剂均为分析纯,购自天津市德恩化学试剂有限公司。
1.2 仪器与设备
L5S紫外-可见分光光度计 上海仪电分析仪器有限公司;H2050高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;Nano-ZS90型动态光散射激光粒度仪 英国马尔文仪器有限公司;紫外灯(253.7 nm) 江阴市飞扬器械有限公司;E191IR恒温培养箱 美国西蒙公司;CKX41SF倒置电子显微镜 日本OLYMPUS公司;SWCJ-2FD双人单面净化工作台 苏州净化设备有限公司;RS-232C酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 PG提取
提取方法参照Bi Lin等[10]报道并作适当修改。取‘中甜8号’玉米样品,经粉碎、冷水浸提后,调节pH值至4.8沉淀蛋白;离心收集上清液,4 ℃冰箱中静置沉淀淀粉;离心收集上清液,调节pH值至7,高温(121 ℃、20 min)处理。离心取上清液,加入3 倍体积乙醇沉淀PG,抽滤得到PG固体粉末。采用3,5-二硝基水杨酸法[11]测得PG中的还原糖质量分数为0.71%,采用考马斯亮蓝法[12]测得PG中的蛋白质量分数为0.12%。
1.3.2 PG负载CCM和负载特征分析
负载方法:分别配制质量分数1%、3%和5%的PG水溶液和4 mg/mL CCM乙醇溶液。取4.95 mL各质量分数的PG溶液,加入0.05 mL的CCM溶液,于摇床中振荡平衡(200 r/min、30 min);离心(10 000×g、15 min),弃去未溶的CCM沉淀,上清液即为PG-CCM复合物溶液。将部分上述溶液冻干成粉,于4 ℃冰箱中保存、备用。复合物因PG质量分数不同,分别记为1% PG-CCM、3% PG-CCM和5% PG-CCM。
负载能力分析:取PG-CCM复合物溶液1 mL,加入4 mL无水乙醇,离心(10 000×g、15 min)。收集上清液,采用分光光度法测定并计算CCM质量,检测波长为425 nm。按式(1)计算负载能力。

CCM分布特征分析:参照Ofokansi等[13]的方法并作适当修改。精确称取一定量不同种类的PG-CCM复合物,分别溶于去离子水中,使CCM质量浓度为20 μg/mL。每种样品取1 mL于离心管中,各两支。摇床振荡20 min(37 ℃、200 r/min);一个样品采用分光光度法测定样液中CCM质量浓度,记为ρA/(μg/mL);另一个经离心(10 000×g、15 min)后用来测定上清液中CCM质量浓度,记为ρB/(μg/mL)。按式(2)计算CCM负载于PG-CCM纳米粒表面的比例。

1.3.3 PG-CCM复合物纳米粒的粒径及表面电位测定
取1.3.2节中所得的PG-CCM复合物溶液,分别用蒸馏水稀释,使PG终质量浓度均为2 mg/mL;漩涡振荡混匀,采用Nano-ZS90型动态光散射激光粒度仪测定平均粒径、聚合物分散性指数(polymer dispersity index,PDI)和表面电位[8]。
1.3.4 PG-CCM复合物的稳定性分析
稳定性实验中,以PG/CCM物理混合物和CCM作为对照,PG/CCM物理混合物制备:将一定量的PG粉末和CCM混合均匀,使二者的质量比分别与1% PG-CCM、5% PG-CCM复合物相等,即得PG/CCM物理混合物。取一定量4 mg/mL CCM乙醇溶液加入去离子水,充分振荡,即得CCM在水中的分散液。实验期间每间隔一定时间取出一组样品,测定CCM质量浓度,计算保留率。
1.3.4.1 紫外稳定性测定
1)加速光解条件下的紫外稳定性:精确称取样品,平铺于25 mL烧杯底面,将烧杯置于紫外灯(30 W)下25 cm处照射。各复合物和相应物理混合物样品中CCM初始质量均为20 μg,CCM样品取5 µL 4 mg/mL CCM乙醇溶液于烧杯中,置于通风橱将乙醇挥干。分别在1、3、5、7、9、12 h各取一组测定CCM保留率,同时比较复合物和相应物理混合物在5 h时的紫外稳定性。2)贮藏条件下的紫外稳定性:精确称取样品,分别置于4 ℃避光、室温避光和室温不避光的环境中贮藏。PG-CCM复合物样品中CCM初始质量均为20 μg。120 d后测定CCM保留率。
1.3.4.2 酸碱稳定性测定
1)贮藏条件下的酸碱稳定性:5% PG-CCM复合物分别溶于pH 3.0~6.6的磷酸盐缓冲液中,置于4 ℃冰箱中。CCM初始质量浓度均为20 μg/mL。第10天和第20天各取一组样品测定CCM保留率。2)在体外模拟胃、肠液条件下的稳定性:按照Maltais等[14]所述方法分别配制不含消化酶的模拟胃液(pH 1.2)和肠液(pH 6.9、7.2)。将5% PG-CCM复合物分别溶于模拟胃、肠液中,同时将CCM和不同质量分数的PG-CCM复合物分别溶于肠液(pH 7.2)中,CCM初始质量浓度均为20 μg/mL,37 ℃水浴。第1、2、4、6、8、10、12小时各取一组样品测定CCM保留率。
1.3.4.3 CCM质量浓度及保留率的测定
1)CCM质量浓度的测定:标准曲线绘制:采用紫外分光光度法绘制CCM标准曲线,CCM质量浓度在0~7 μg/mL的范围内,CCM质量浓度与吸光度呈良好的线性关系,线性回归方程为y=0.172 1x+0.013 7(R2=0.999 7)。固体PG-CCM复合物和PG/CCM物理混合物样品CCM质量浓度测定:加入1 mL去离子水使之充分溶解,加无水乙醇4 mL混匀后离心(10 000×g、15 min),取上清液,测其在425 nm波长处的吸光度,计算CCM质量浓度。液体PG-CCM复合物样品CCM质量浓度测定:1 mL液体样品,加入4 mL无水乙醇,按同样方法测定吸光度并计算CCM质量浓度。固体CCM质量浓度测定:加入5 mL 80%乙醇,测定其吸光度并计算CCM质量浓度。液体CCM质量浓度测定:1 mL液体样品,加入4 mL无水乙醇,测定其吸光度并计算CCM质量浓度。
2)CCM保留率的测定及计算:不同时间点分别取出一组样品,测定该时刻CCM质量浓度,按式(3)计算CCM保留率。

1.3.5 PG-CCM复合物中CCM的释放分析
参照Xie Xiaoxia等[15]的方法并略作修改。按1.3.4.2节配制模拟胃、肠液。称取1%、5% PG-CCM冻干粉分别加入至模拟胃、肠液中,使CCM质量浓度为20 μg/mL。取1 mL于离心管中37 ℃水浴,每隔一定时间取出一组样品,离心(10 000×g、15 min)后,按1.3.4.3节所述方法测定上清液中CCM的质量浓度;按式(4)计算CCM在模拟胃、肠液中的释放率。

式中:ρA为0时刻样液中CCM的质量浓度/(μg/mL);ρB为t时刻经离心处理后上清液中CCM的质量浓度/(μg/mL)。
1.3.6 PG-CCM复合物的抗氧化活性分析
样品准备:分别配制CCM水分散液(按1.3.4节所述方法)、CCM乙醇溶液和PG-CCM水溶液3 组样品,并分别以去离子水、乙醇和相应质量分数的PG溶液为对照。
1.3.6.1 总还原力测定
总还原力检测参考Fan Jinling等[16]的方法并作适当修改:取0.5 mL样液,CCM质量浓度为0~70 μg/mL,加入1.5 mL的质量分数1%铁氰化钾溶液,水浴(50 ℃、20 min),取出冷却后,加入质量分数10%三氯乙酸溶液2.5 mL。取混合液2.5 mL,依次加入去离子水2.5 mL和质量分数0.1%三氯化铁溶液0.5 mL,充分混匀,静置10 min后,在700 nm波长处测定其吸光度。总还原力以样品吸光度与相应对照吸光度的差值表示。
1.3.6.2 ABTS阳离子自由基的清除活性测定
ABTS阳离子自由基的清除活性测定参考Li Gao等[17]的方法并作适当修改:将ABTS(7 mmol/L)和高硫酸钾(2.45 mmol/L)等体积混合均匀,室温避光静置14 h,生成ABTS工作液;用磷酸缓冲液(0.05 mol/L,pH 7.4)稀释至吸光度为0.70±0.02(734 nm)。取0.2 mL样品溶液于试管中,CCM质量浓度为0~30 μg/mL,加入3.8 mL ABTS工作液,漩涡混匀后,室温反应30 min,于734 nm波长处检测吸光度A样品。CCM水分散液和CCM乙醇溶液样品的空白对照分别为水和乙醇,PG-CCM样品的空白对照为对应质量浓度的PG溶液,测得吸光度为A空白。ABTS阳离子自由基的清除率按式(5)计算。
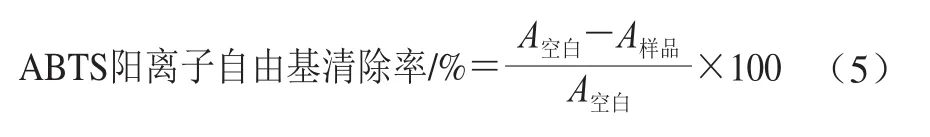
1.3.7 PG-CCM复合物对癌细胞抑制作用率测定
样品准备:将CCM分散至DMEM培养基中配制CCM悬浊液,记为CCM/H2O组;将CCM溶于二甲基亚砜(dimethylsulfoxide,DMSO)中配制1 mg/mL母液,用DMEM培养基稀释得到不同质量浓度样品(DMSO质量分数控制在1%),记为CCM/DMSO组;将PG-CCM复合物冻干粉复溶于DMEM培养基中配制不同质量浓度PG-CCM样品液,记为PG-CCM组;上述3 组样品浓度以CCM计,均为0~150 μmol/L。同时,将PG溶于DMEM培养基配制与PG-CCM组相同PG质量浓度的样品,记为PG组。
MCF-7细胞和A549细胞增殖的抑制作用:采用MTT法研究样品对MCF-7细胞和A549细胞增殖的抑制作用。MCF-7和A549细胞用含10%胎牛血清、100 U/mL双抗的DMEM培养基培养,在37 ℃、含5% CO2气体的恒温培养箱中培养至细胞铺满瓶底面积的80%;用胰酶消化后,以1×105个/mL浓度接种至96 孔板,每孔200 μL,培养6 h。弃去旧培养基,加入200 μL新鲜培养基或样品液,继续培养24 h。弃去旧培养基,磷酸盐缓冲液清洗两次,每孔加入200 μL新鲜培养基和10 μL MTT(5 mg/mL),继续培养4 h。倒掉培养基中液体,吸掉泡沫,加150 μL DMSO反应10 min,酶标仪测定550 nm波长处样品孔吸光度,加MTT的样品孔吸光度记为A2,加等体积培养基的孔吸光度记为A1,不加MTT的孔为记A0,根据式(6)计算抑制率。PG-CCM组抑制率为扣除PG组抑制率之后的数据。
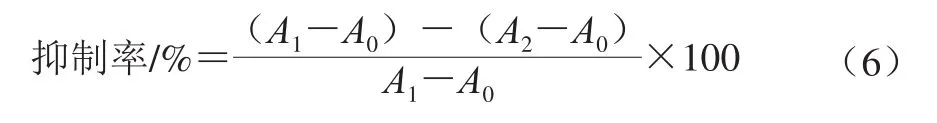
1.4 数据统计与分析
1.3.7 节实验重复6 次,其余所有实验重复3 次,结果以平均值±标准差表示;通过DPS软件采用单因素方差分析法比较各组结果间的差异显著性;用Origin 8.5软件作图。
2 结果与分析
2.1 PG-CCM复合物纳米粒的粒径、表面电位、负载能力和负载分布
PG的平均粒径约为71 nm,PDI小于0.2,呈电中性。以不同质量分数的PG负载CCM,得到1% PG-CCM、3% PG-CCM和5% PG-CCM 3 种复合物。3 种复合物的平均粒径、PDI及表面电位与PG相比无显著变化,彼此之间也无显著差异。但是,伴随载体PG质量分数的增大,负载能力及负载于纳米粒表面的CCM比例均显著下降,当PG质量分数由1%提高到5%时,负载能力由1.887 μg/mg下降为原来的32%,而纳米粒表面的负载比例则由37.5%减小到17.3%(表1)。
PG是一种天然存在的纳米粒[18],具有“外紧内松”的球型结构,即由内至外,分子分散密度由小至大,这使得其分子内部形成相对疏水的环境[7]。将CCM分散于PG的水溶液时,CCM由极性较大的微环境向PG的疏水区域转移[9],优先分布在PG的疏水内核中。载体PG质量分数较大,意味着提供了较多的内核空间,分布在内核的CCM比例高于PG质量分数较小载体。
上述研究结果表明,PG-CCM复合物是一种粒径分布均匀、呈电中性的纳米粒,CCM在纳米粒中的分布因载体质量分数而异。CCM在球形纳米粒载体PG中的分布特征会影响其稳定性、释放特性及生物活性。
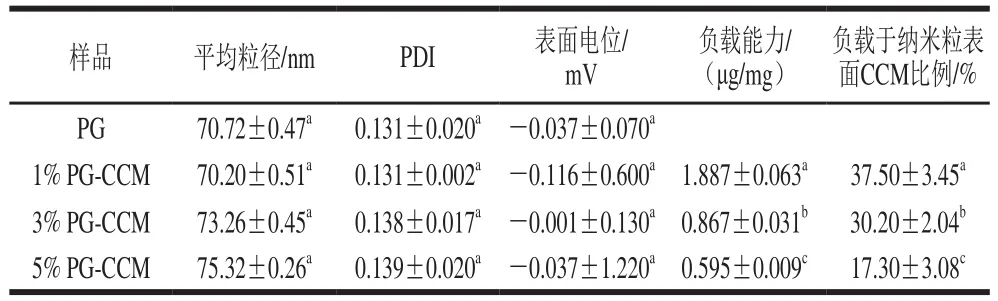
表1 PG-CCM复合物的粒径、表面电位、负载能力和负载分布Table 1 Average particle size, surface potential, loading capacity and loading distribution of PG-CCM complex
2.2 PG-CCM复合物的稳定性
2.2.1 PG-CCM复合物的紫外稳定性
CCM光敏性很强,主要降解产物为香草醛、香草酸和阿魏酸[19]等。Li等[1]报道了CCM暴露于紫外灯光下12 h后的损失率为50%。紫外线照射是一种最常见、有效且简单的灭菌方法;而贮藏过程中自然光条件下样品的稳定性则直接影响其货架期。紫外稳定性是CCM应用于食品等领域时需考虑的问题之一。
2.2.1.1 加速光解条件下的紫外稳定性

图1 紫外光照射条件下PG-CCM复合物中CCM的稳定性Fig.1 Stability of encapsulated CCM in PG-CCM complex under UV irradiation
如图1所示,CCM表现出显著的光解不稳定性;与CCM相比,3 种PG-CCM复合物中CCM的降解速率均显著降低,保留率依次为:5% PG-CCM>3% PG-CCM>1% PG-CCM。为了探究复合物对CCM保护作用可能机制,实验进一步比较了PG-CCM复合物和相应物理混合物(PG/CCM)的紫外稳定性,从表2可看出,PG/CCM物理混合物中CCM保留率均显著高于相应的PG-CCM复合物。5 h时,CCM的保留率为24.90%,5% PG-CCM、1% PG-CCM复合物中CCM的保留率分别提高至79.42%和59.39%,而两种PG/CCM物理混合物CCM几乎不损失。
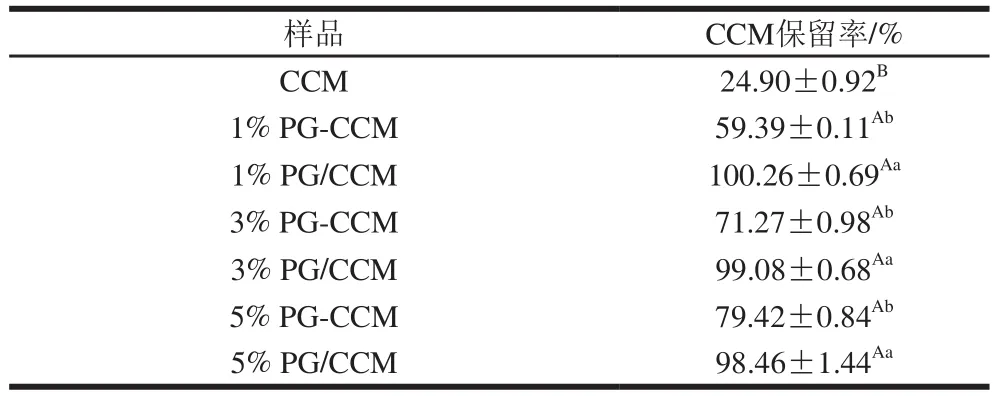
表2 紫外光照射条件下PG-CCM复合物、PG/CCM物理混合物中CCM稳定性的比较Table 2 Comparison of CCM stability in PG-CCM and PG/CCM physical mixtures under UV irradiation
2.2.1.2 贮藏期间的紫外稳定性
贮藏温度和避光处理对不同PG-CCM复合物样品中CCM保留率的影响见表3。贮藏温度对所有PG-CCM复合物中CCM的保留率均无显著影响,但避光处理显著提高了所有PG-CCM复合物中CCM的保留率。在避光条件下,不同PG-CCM复合物的稳定性均较高,彼此无显著差异;在不避光条件下,不同PG-CCM复合物的稳定性差异显著,其保留率依次为5% PG-CCM(65.53%)>3% PG-CCM(48.79%)>1% PG-CCM(29.28%),与加速光解条件下的紫外稳定性研究结果相吻合。

表3 PG-CCM复合物在不同贮藏条件下的保留率(120 d)Table 3 Retention rates of PG-CCM complex under different storage conditions (after 120 d)%
CCM被负载或包埋后,其紫外稳定性的变化屡有报道,但结果不一,其原因也未得到很好的解释。Li Jinglei等[2]用将CCM分散在Eudragit EPO聚合物中,制备得到Cur@EPO,CCM的紫外稳定性得到显著提高。Onoue等[20]利用乙酸琥珀酸羟丙基甲基纤维素制备了非晶固体分散体(ASD-Cur),其紫外稳定性显著下降。通常情况下,晶体状态下物质的稳定性优于无定形状态[20]。另一方面,CCM酚羟基氧原子的未成键电子,如果作为电子供体提供给自身分子的苯环,则CCM分子较稳定;相反,如果参与分子间氢键形成,CCM分子的稳定性就会被破坏[21]。本课题组前期研究表明:PG-CCM复合物中,CCM与PG通过分子间氢键相互作用,且由晶体状态转变为无定形状态[9]。本研究中,CCM的紫外稳定性可因载体PG的物理覆盖效应得到显著提高。但是,由于复合物中CCM的无定形状态以及CCM与PG之间的氢键作用,使得PG对CCM的保护作用在一定程度上被削弱。
不同PG-CCM复合物的紫外稳定性存在较大差异,这可能与CCM在载体PG中的分布不同有关。如上所述,载体质量分数越大,CCM分布于载体表面的比例越小,更多的CCM分布在纳米粒的内核中,从而提高了对CCM的保护作用。因此,本研究中5% PG-CCM的紫外稳定性优于1%~3% PG-CCM。
2.2.2 PG-CCM复合物的酸碱稳定性
CCM在pH 6.8及以上条件快速降解[5,22],Wang等[5]报道了当CCM在0.1 mol/L磷酸盐缓冲液和无血清培养基(pH值均为7.2)中37 ℃孵育30 min时,降解率约90%。CCM在食品加工过程以及在经人体胃、肠道消化时,均可能经历较宽范围内的pH值变化。本实验采用体外模型考察了不同种类PG-CCM复合物在模拟胃、肠液条件下的稳定性,同时研究了5% PG-CCM复合物在不同pH值环境条件下的贮藏稳定性。
2.2.2.1 PG-CCM复合物在体外模拟胃、肠液条件下的稳定性
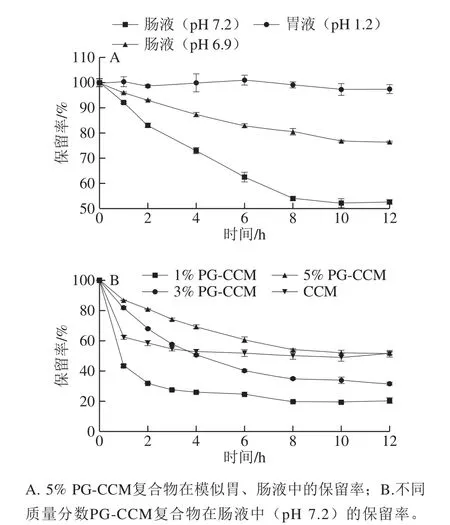
图2 PG-CCM复合物在体外模拟胃、肠液条件下的稳定性Fig.2 Stability of PG-CCM complex in SGF and SIF
如图2A所示,体外模拟胃液(pH 1.2)条件下,5% PG-CCM复合物中的CCM具有良好的稳定性,12 h的保留率高达97%;在模拟肠液条件下(pH 6.9和pH 7.2),CCM的降解速率明显提高,在pH 7.2模拟肠液中尤为明显;2 h和12 h时分别损失了18%和47%。在此基础上,进一步考查了不同质量分数PG-CCM复合物中CCM在pH 7.2模拟肠液条件下的稳定性,并与分散于模拟肠液中CCM的稳定性相比较,结果见图2B。在模拟肠液条件下,3 种PG-CCM复合物中CCM的降解模式与CCM存在明显差异,CCM在2 h内迅速降解,损失率约42%,之后几乎不再降解。3 种PG-CCM复合物均在监测的12 h内发生持续降解,前期降解速率及最终降解程度由低到高依次为5% PG-CCM<3% PG-CCM<1% PGCCM;其中,5% PG-CCM降解速率在整个实验期间均低于CCM,明显提高了CCM的酸碱稳定性。
PG-CCM和CCM在肠液条件下表现出不同的降解趋势,这一现象可能是CCM的存在状态不同造成的。在CCM的固体分散液(20 μg/mL)中,由于CCM水中的溶解度远低于1 μg/mL[4,23];因此,CCM除以极少量游离态分子存在外,大部分分子因相互作用彼此聚集,形成纳米粒或生成结晶沉淀[2,24-25]。不同存在状态的CCM分子稳定性有极大差异,Li Bin等[22]报道了结晶态CCM分子的降解速率远低于溶液中游离的CCM分子。本实验中,在最初的2 h内,溶解状态的游离分子或聚集较少分子纳米粒中的CCM分子发生快速降解;随后体系中的CCM主要以结晶或沉淀形式存在,不容易发生降解。因此,CCM总体降解规律表现为前期快速降解,后期维持稳定。在PG-CCM体系中,CCM由于与PG相互作用,主要以分子状态存在,不发生结晶或沉淀;因此,其降解规律表现为降解速率持续下降。5% PG-CCM降解速率在12 h监测时间内均低于CCM,而3% PG-CCM在监测前4 h内降解速率也低于CCM,对CCM起到较好的保护作用,有利于CCM在肠道的吸收。
2.2.2.2 5% PG-CCM复合物贮藏期间的酸碱稳定性

图3 5%PG-CCM复合物在不同pH值条件下的贮藏稳定性Fig.3 Stability of 5% PG-CCM complex under different pH conditions during storage
由图3可知,随贮藏时间延长,不同pH值条件下5% PG-CCM复合物中CCM的保留率均呈显著下降趋势;20 d时,pH 3.0~5.0之间,CCM保留率差异不明显,约为52%~55%;而pH 6.0和pH 6.6时的保留率明显降低,仅分别为34.91%和16.30%。表明PG-CCM适宜保存在较低pH值的环境中。
2.3 PG-CCM复合物中CCM在胃、肠液环境下的释放率
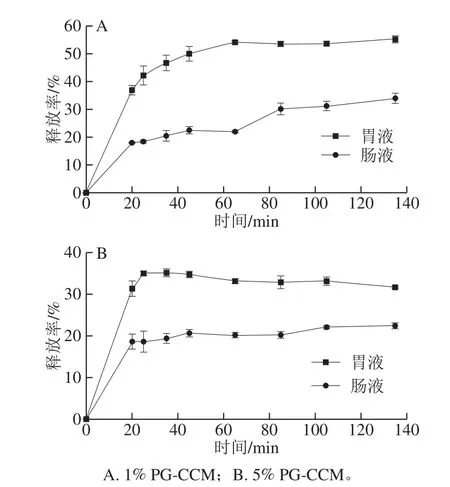
图4 PG-CCM复合物在体外模拟胃、肠液中的释放Fig.4 Kinetic release profiles of encapsulated CCM from PG-CCM complex in SGF and SIF
1% PG-CCM、5% PG-CCM在体外模拟胃、肠液环境中的释放动力学结果如图4所示,两种复合物中CCM的释放特征明显不同:1% PG-CCM复合物中CCM在胃、肠液环境下的释放均表现出“前期突释(0~20 min)、随后持续释放(20 min以后)”的两相特征,且在胃液中的释放率明显高于肠液。20 min时,在胃、肠液的释放率分别达到36.8%和17.8%,而后释放率逐渐增长,至135 min时分别为55.1%和33.9%。5% PG-CCM复合物中CCM在胃、肠液中的释放也存在“前期突释”(0~20 min)现象,但随后释放率在整个实验期间不再增长,保持在15%~20%左右。两种复合物相比,1% PG-CCM复合物中CCM在胃液和肠液中的释放率均显著高于5% PG-CCM。
“突释”部分的CCM通常被认为负载在载体表面,随后持续释放的CCM则代表结合在载体内核中[13,26]。1% PG-CCM复合物中负载于纳米粒表面的比例远高于5% PG-CCM,因此“突释量”更高;随后释放的CCM可认为是从纳米粒内核逐渐向表面转移并释放到介质中。氢键是PG和CCM相互作用的主要作用力之一[9],而pH值影响分子间的氢键作用[2,4,27];因此,本研究中模拟胃、肠液pH值的差异是影响PG-CCM中CCM释放量不同的主要原因。Gangurde等[4]报道了与本研究相类似的CCM释放现象。
2.4 PG-CCM复合物的生物活性
2.4.1 抗氧化活性
分散于水中的CCM总还原力较小,且对ABTS阳离子自由基几乎无清除活性。溶于乙醇的CCM总还原力提高,且表现出较强的ABTS阳离子自由基清除活性。3 种PG-CCM复合物的总还原力和ABTS阳离子自由基清除活性均高于CCM(无论是分散在水中或溶解于乙醇中)。不同的PG-CCM复合物相比,总还原力和ABTS阳离子自由基清除活性差异均明显,但规律相反:总还原力为1% PG-CCM>3%PG-CCM>5%PG-CCM(图5A),而对ABTS阳离子自由基清除能力依次为5% PG-CCM>3% PG-CCM>1% PG-CCM(图5B)。
CCM分子结构中的酚羟基和共轭双键使其具有很强的抗氧化活性。但是,CCM的水溶性低,其在水基质中的抗氧化活性较差,在有机溶剂中的抗氧化活性往往高于分散于水的情况[28-29]。本实验的研究结果也证实了这一点。本研究同时表明经PG负载后,CCM的抗氧化活性得到进一步提高。这可能与下面两个因素有关:1)PG-CCM在水中具有良好的分散性;2)PG的纳米粒结构提供了极大的外表面积。以上两方面因素均有利于在水相发生的反应。类似的现象已见文献[28-30]报道,如Chang Chao等[28]报道了果胶包被的酪蛋白酸钠/玉米醇溶蛋白复合物负载的CCM对ABTS阳离子自由基的清活性显著高于溶于乙醇或分散于水中的CCM。
值得注意的是,不同的PG-CCM复合物对ABTS阳离子自由基的清除活性表现出的规律与稳定性相吻合,即载体质量分数越高,CCM的活性越强。但是,总还原力表现出的规律则正好相反。还原力测定中所用的氧化剂铁氰化物无法透过疏水区域,因此广泛用于测定暴露在水介质中的还原性基团[30-31]。本研究中,载体PG质量分数越大,CCM分布在PG疏水内核中的比例越高,分布于表面的CCM越少。铁氰化物无法透过PG表面进入到疏水的内核中与之反应,因此表现出较低的还原力。
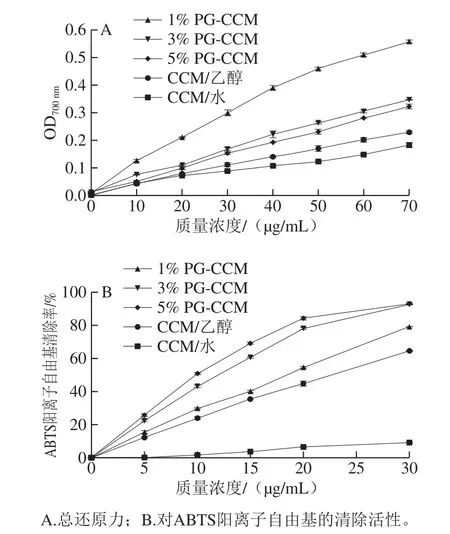
图5 PG-CCM复合物的抗氧化活性Fig.5 Antioxidant activity of PG-CCM complex
2.4.2 对癌细胞抑制作用
CCM具有抑制结肠癌细胞、口腔鳞癌细胞、肺癌细胞、人胰腺癌、肾癌细胞[32]等多种癌细胞增殖的作用。本实验研究比较了CCM/H2O组、CCM/DMSO组和1% PG-CCM、5% PG-CCM组对A549 和MCF-7细胞增殖的抑制作用,结果如图6所示。
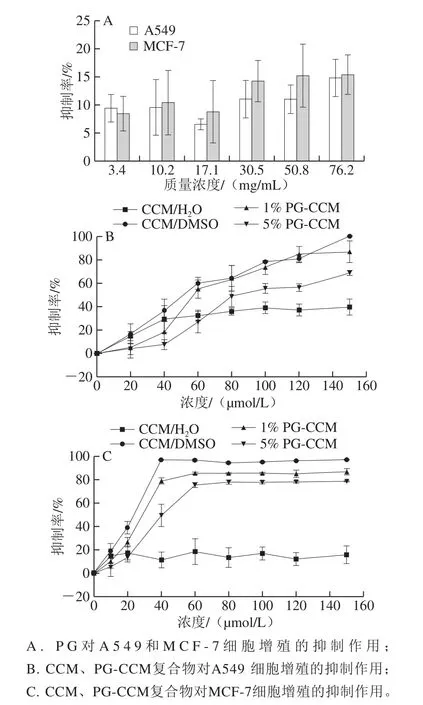
图6 PG和CCM对A549和MCF-7细胞的抑制作用Fig.6 Cytotoxicity of PG on A549 and MCF-7 and cytotoxicity of PGCCM on A549 and MCF-7
PG对两种细胞的抑制率均小于15%,表明其对癌细胞生长的影响可忽略不计(图6A)。如图6B、C所示,CCM/H2O对上述两种癌细胞的抑制作用较小,并且仅在很低的浓度范围呈现剂量依赖关系;当浓度超过某一值后(A549为40 μmol/L,MCF-7为20 μmol/L),抑制率不再发生明显变化,维持在较低水平。CCM/DMSO组对两种细胞均表现出很强的抑制作用,且具有良好的剂量依赖性;其中,对MCF-7的抑制作用更显著。两种PG-CCM复合物对癌细胞的抑制率在多数浓度条件下都明显高于CCM/H2O。1% PG-CCM对两种癌细胞的抑制作用均优于5% PG-CCM,其中对A549的抑制作用在浓度大于60 μmol/L时,与CCM/DMSO无明显差异。
如上所述,CCM水溶性低,达到饱和浓度后,继续增大CCM在水中的量,溶解于水中的CCM分子数量并不会因此增加,故对癌细胞的抑制作用也就不再增强。DMSO和PG负载对CCM均起到增加溶解度的作用,可以提供更多的游离CCM分子与癌细胞接触,因此提高了对癌细胞的抑制作用。与5% PG-CCM复合物相比,更大比例的CCM分布于1% PG-CCM复合物纳米粒的表层;一方面有利于与癌细胞直接接触,另一方面有利于释放,因此对癌细胞的抑制作用也更突出。
3 结 论
CCM负载于PG后的紫外稳定性、抗氧化活性及癌细胞抑制活性均显著增强。PG-CCM制备时使用的PG浓度极大影响CCM的负载特征、释放曲线、CCM的稳定性以及生物活性。5% PG-CCM复合物的紫外稳定性和酸碱稳定性均显著优于1% PG-CCM,其中5% PG-CCM与CCM相比,显著提高了CCM的酸碱稳定性。1% PG-CCM在胃液和肠液中的释放率和对两种癌细胞的抑制作用均高于5% PG-CCM。两种复合物稳定性、释放特性及生物活性的差异与CCM在PG中的分布状态有关。

