珠江三角洲河流饮用水源中的环境内分泌干扰物及其风险
熊小萍 ,龚剑 *,林粲源 ,周永顺 ,杜勇明,吴翠琴
1. 广州大学环境科学和工程学院/广东省放射性核素污染控制与资源化重点实验室,广东 广州 510006;2. 广州大学/珠江三角洲水质安全与保护教育部重点实验室,广东 广州 510006
环境内分泌干扰物(environmental endocrine disruptors,EEDs)是一类能够干扰人类或动物的生殖、神经和免疫系统等功能的外源性化学物质,由于它具有来源广、危害大、毒理危害潜伏期长等特点,成为近年来水环境中备受关注的一类有机污染物(Frye et al.,2012;周开茹等,2018;Sifakis et al.,2017)。类固醇雌激素包括天然雌激素如雌酮(E1),雌二醇(E2)和雌三醇(E3)以及人工合成雌激素如炔雌醇(EE2)、己烯雌酚(DES)等,它们具有较强的内分泌干扰作用,即使在极低的水环境质量浓度下也会对水生生物体产生不利影响(Adeel et al.,2017)。广泛用于工业生产的壬基酚(NP)、辛基酚(OP)和双酚A(BPA)是3种典型的酚类人工合成化合物,也被证实具有雌激素活性(Chen et al.,2008;Sohoni et al.,2001;Servos,1999)。NP和 OP分别是壬基酚聚乙氧基化物(nonylphenol ethoxylates,NPEOs)和辛基酚聚乙氧基化物(octylphenol polyethoxylates,OPEOs)进入水环境后的代谢产物,它们比母体化合物毒性更大(Ying et al.,2002)。上述EEDs可经污水处理厂出水、生活污水及工业废水直排进入地表水中,进而对水生生态系统及人体健康构成严重威胁。目前,在一些饮用水源地和自来水厂中也有部分EEDs被检出(Niu et al.,2018;Padhye et al.,2014)。考虑到饮用受EEDs污染的水容易引起癌症肿瘤、肥胖症和生殖功能受损(Michałowicz,2014;Huang et al.,2012)。因此,有必要从饮用水源头对其污染进行监控。
珠江三角洲地区人口稠密、工业密集、经济发展迅猛,环境负荷也随之增大,电子及工农业等多以EEDs为生产原料的产业较多,大量未经有效处理的工业废水和生活污水直接排放,导致珠江三角洲的水环境污染日益恶化。目前,已有许多学者对珠三角河流中的 EEDs的污染特征进行了报道(Gong et al.,2019;Peng et al.,2017;龚剑等,2011),发现一些河流中EEDs的质量浓度超过一些水生生物的最低效应的质量浓度,对水生生物构成相对较高的风险,存在一定的生态风险。然而,专门针对珠江三角洲饮用水源地EEDs的污染特征及其潜在风险的研究还十分有限(Peng et al.,2017;李向丽等,2010)。另外珠江水系是珠三角地区几个重要城市的主要饮用水源,供水总人口超过3000万,其水体的污染给当地居民的饮用水安全带来潜在的风险。
本文以典型固醇类雌激素 E1、E2、E3、EE2、DES及酚类雌激素化合物NP、OP和BPA为目标物,研究珠江三角洲河流饮用水源地EEDs的时空分布特征和变化规律,并对该类污染物的生态风险进行了评价,以期为珠三角及大湾区饮用水源地水质保障和污染治理提供重要的科学依据。
1 材料与方法
1.1 化学品和材料
所有标准溶液,包括NP、OP、BPA、E1、E2、E3、EE2、DES和衍生化试剂 N-甲基-N-(三甲基甲硅烷基)三氟乙酰胺(MSTFA)均购自 Sigma-Aldrich公司。同位素标记的回收率替代物BPA-d16、E1-d4、NP-d4购自 Cambridge Isotope Laboratories公司。内标氘代三联苯(terphenyl-d14)购自Supelco公司。丙酮、二氯甲烷、正己烷、乙酸乙酯、甲醇和乙腈均为HPLC级,购自德国Merck公司。玻璃纤维膜(GF/F,0.7 μm)和Oasis HLB固相萃取柱(500 mg,6 mL)分别购自Whatman公司和Waters公司。所有玻璃器皿、玻璃纤维滤膜、无水硫酸钠在使用前均在450 ℃下焙烤5 h。
1.2 品采集
分别在2018年1月(枯水期)和7月(丰水期)从西江思贤窖(X1)、金本村(X2),北江宝鸭洲(B1)、顺德水道(B2、B3),流溪河下游石门(S1)以及东江东莞段北干流(D1—D4)、南支流(D5、D6)饮用水取水区采集水样(图1)。用清洁的不锈钢桶从水-气界面下方0—50 cm处收集4 L表层水样装入到5 L清洁过的琥珀色玻璃瓶中,立即加入0.4 g的叠氮化钠混匀,抑制微生物活性。样品运回实验室后立即用玻璃纤维滤膜过滤,滤液在24 h内完成固相萃取。
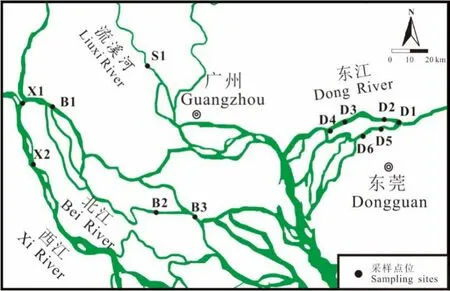
图1 珠三角河流饮用水源地采样点分布图Fig. 1 Sampling sites of the drinking water sources from the Pearl River Delta
1.3 样品预处理和提取
基于Gong et al.(2012)的固相萃取方法,使用全自动固相萃取仪(Auto Trace 280,Thermo公司)和Oasis HLB柱(500 mg,6 mL)富集滤液中的EEDs。将SPE柱依次用5 mL乙酸乙酯、5 mL甲醇和15 mL盐酸溶液(pH=3)活化。向1 L调至pH=3的滤液中加入回收率替代物(BPA-d16100 ng、NP-d4500 ng、E1-d410 ng)后,以 10 mL·min−1的流速通过萃取柱,接着用10 mL纯水/甲醇(9:1,V/V)溶液洗柱,再利用高纯氮气干燥 50 min;之后,用 10 mL乙酸乙酯以 2 mL·min−1的流速洗脱SPE柱。将洗脱液用无水硫酸钠进行脱水,并用旋转蒸发仪浓缩至1 mL,再转移至进样瓶中并用温和氮气流吹至刚干;接着加入50 μL乙酸乙酯和100 μL MSTFA,在70 ℃水浴中反应30 min,对所有目标化合物进行衍生化,然后冷却至室温。最后加入200 ng内标terphenyl-d14,并用乙酸乙酯定容至200 μL,待下一步的仪器分析。
1.4 仪器分析
使用Trace GC-DSQ气相色谱−质谱仪(Thermo,美国)对目标物进行分析。色谱条件:色谱柱为DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm,Agilent公司)。以高纯氦气(99.999%)为载气,恒定流量1.0 mL·min−1不分流进样模式,进样体积为 1 μL,进样口温度设定为250 ℃。GC柱温度从100 ℃(初始平衡时间 1 min)以 30 ℃·min−1上升到235 ℃,再以 4 ℃·min−1升温到 250 ℃,然后以 30 ℃·min−1升温到280 ℃,并在280 ℃的状态下保持10 min。质谱条件:离子源为电子轰击源(EI),能量为70 eV;离子源温度为250 ℃,连接线温度为280 ℃;溶剂延迟时间8 min。采用全扫模式(m/z=50—550)进行样品定性,采用选择离子监测模式(SIM)进行样品定量。基于 3∶1的信噪比确定目标化合物的方法定量限(LOQ),OP、NP、BPA、DES、E1、E2、EE2和E3的LOQ分别为:1.2、3.2、0.9、1.2、0.6、1.0、1.5、1.2 ng·L−1。
1.5 质量保证和质量控制
本研究分析了野外空白、方法空白、加标水样和平行样品。每6个样品设置方法空白、加标水样、平行样品各一个,以监控实验结果的稳定性和可靠性。野外空白水样中检测出酚类化合物OP、NP和BPA的的质量浓度分别为 (2.1±0.8)、(16.5±4.2)、(1.6±0.6)ng·L−1,其他目标物均未检出,此外,方法空白仅检测出 NP,其质量浓度为 (12.0±2.8) ng·L−1。分析加标水样,目标化合物的平均回收率为 82.8%—114%,平行样中所有目标化合物的相对标准偏差(RSD)均小于或等于 12%。此外,水样中回收率替代物 NP-d4、BPA-d16、E1-d4回收率分别为 (87.6%±5.2%)、(106.2%±7.8%)、(113.6%±8.1%)。所有样品结果均扣除空白并进行回收率校正。
1.6 水样主要理化指标的测定
野外采样时,使用 CDT48M 多参数仪(SST,德国)对水样的温度、pH、溶解氧、电导率、叶绿素a等水体理化指标进行现场监测。将吸附有颗粒物的滤膜冷冻干燥48 h后称重,差量法计算水样中的悬浮颗粒物含量。
1.7 风险评估
预测无效应的质量浓度(PNEC)的确定:利用物种敏感曲线分布法(SSD)计算出污染物在水体中对应的 5%物种受到危害时的质量浓度(HC5),根据欧盟风险评估技术导则(ECTGD)提供的评价因子(AF)方法(EC,2003),可通过以下公式计算PNEC:

根据近年相关生态毒理学研究的计算结果,本文中NP、OP、BPA和E1的PNEC分别设定为480、122、860、6 ng·L−1(Gao et al.,2014;Loos et al.,2007;Guo et al.,2015;Caldwell et al.,2012)。
本研究采用风险商(RQ)法对水源地EEDs的生态风险进行了评价(EC,2003),计算公式如下:

式中,RQ为风险商,MEC是化合物的测量环境的质量浓度。该评价标准分为3个风险等级,分别为低风险(RQ<0.1);中等风险(0.1≤RQ<1);以及高风险(RQ≥1)(Yan et al.,2017)。
当多种EEDs共同存在时,以危害指数(Hazard Index,HI)作为EEDs混合物的生态风险的评价指标,代表水体中可能存在的累积环境风险(Yan et al.,2017)。计算公式如下:

2 结果与讨论
2.1 水源地中EEDs的污染水平与组成
研究发现,总 EEDs(ΣEEDs)的质量浓度在26.8—2460 ng·L−1之间,平均值和中值分别为 775 ng·L−1和 325 ng·L−1(表 1)。OP、NP、BPA 和 E1广泛存在于珠三角饮用水源地中,其质量浓度范围为
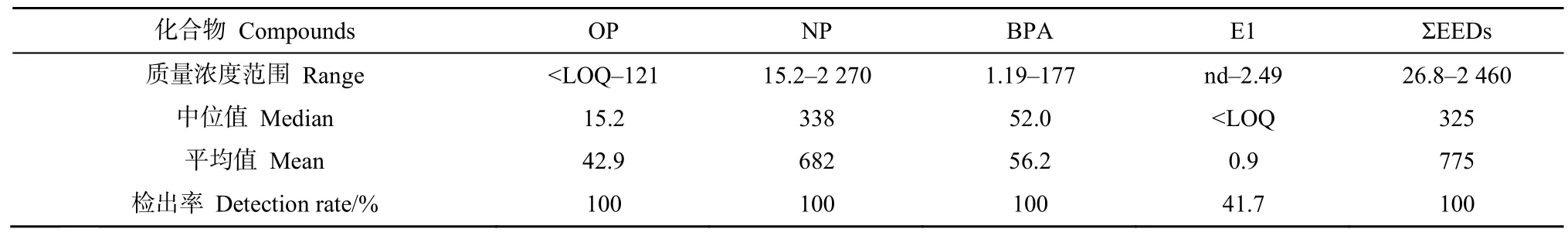
表1 珠三角河流水源地中EEDs的质量浓度Table 1 Concentration range, mean, median and detection frequencies of the EEDs in drinking water ng·L−1
与国内外水源地的EEDs污染水平相比(表2),西江(61.1—313 ng·L−1)和北江(15.1—187 ng·L−1)水源水中的NP的质量浓度远高于中国太湖(0.09—2.47 ng·L−1)、流溪河水库(22.5—25.1 ng·L−1)、广州流溪河从化段水源地(nd—30 ng·L−1)以及德国的水源地(2—15 ng·L−1);流溪河下游(521—961 ng·L−1)和东江东莞段(189—2270 ng·L−1)水源水中 NP的质量浓度略低于淮河水源地(739—2960 ng·L−1),高于其他地区。西江(nd—4.8 ng·L−1)和北江(nd—12.5 ng·L−1)水源水中OP的质量浓度与德国水源地相似(0.15—5 ng·L−1),流溪河下游(20.1—74.2 ng·L−1)和东江东莞段(5.58—120 ng·L−1)水源水中OP的质量浓度与松花江水厂原水(72—154 ng·L−1)和法国水源地(<17—340 ng·L−1)处于同一水平。珠三角河流水源水中 BPA的质量浓度(1.2—177 ng·L−1)与国内外大部分水源地处于同一水平,低于淮河水源地(215—627 ng·L−1)和法国水源地(<25—1430 ng·L−1)。雌激素E1仅在流溪河下游(1.49—2.49 ng·L−1)和东江东莞段(nd—2.28 ng·L−1)检测出,与长江江苏段水源地(nd—6.2 ng·L−1)和松花江水厂源水(nd—7 ng·L−1)的质量浓度水平相当,低于上海黄浦江水源地(12.9 ng·L−1),略高于德国(0.2—0.6 ng·L−1)和美国水源地(0.11—0.29 ng·L−1)。总体上,珠三角河流水源地的NP污染在国内处于较高水平,OP、BPA和E1处于中低污染水平;但都普遍高于国外水源水的污染水平。
2.2 水源地中EEDs的时空分布
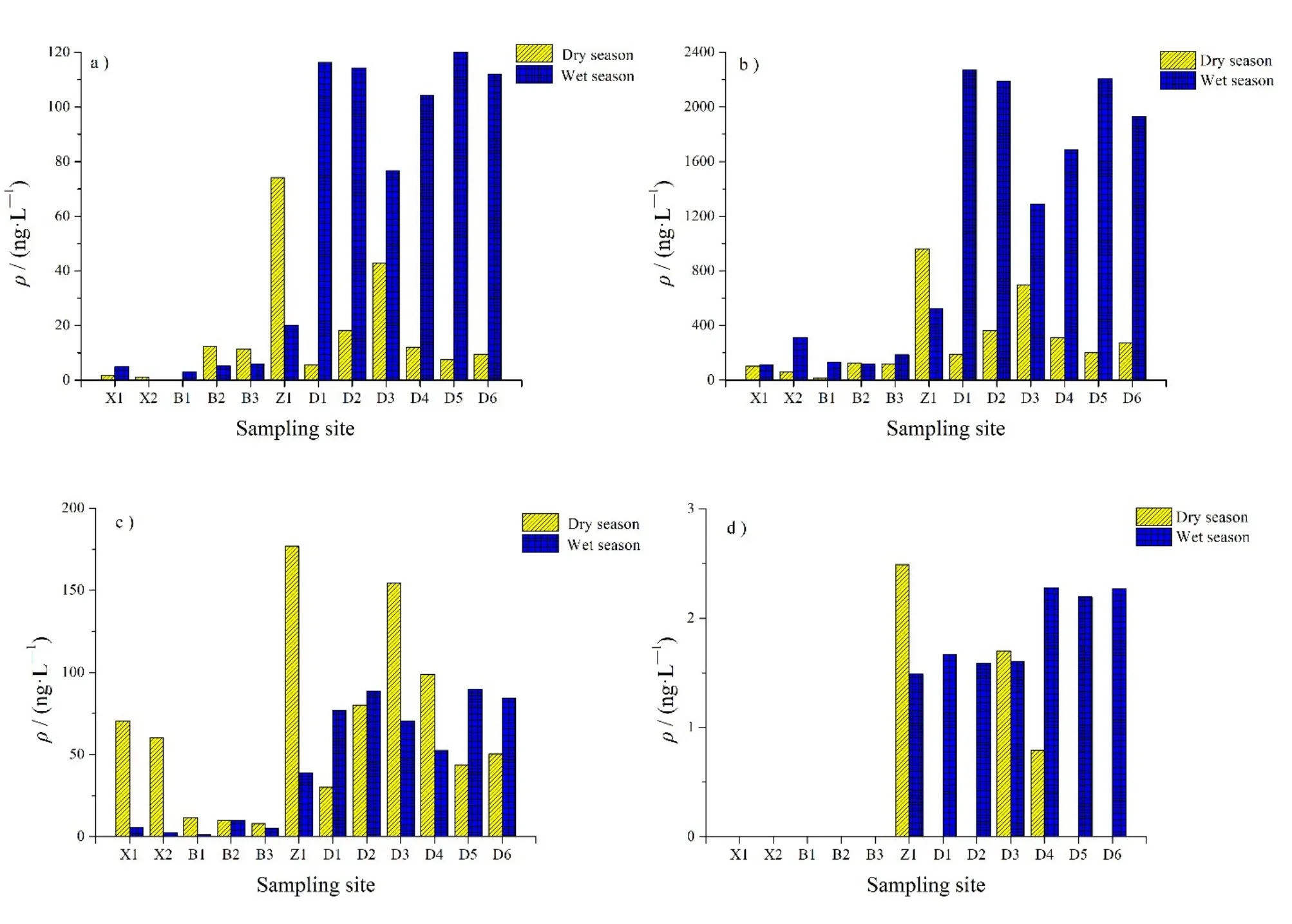
西江、北江、流溪河下游、东江东莞段的水源水中ΣEEDs的两季平均的质量浓度范围(平均值/中值)分别为 149—219 ng·L−1(184/184 ng·L−1)、82.1—168 ng·L−1(130/141 ng·L−1)、582—1220ng·L−1(899/582 ng·L−1)、1130—1430 ng·L−1(1270/1280 ng·L−1),总体污染水平呈现出东江东莞段>流溪河下游>西江>北江的特征(图2)。EEDs的空间分布差异主要体现在高质量浓度的NP上。东江水源水中ΣEEDs平均质量浓度显著高于其他三处水源地,分别是流溪河的1.4倍,西江的6.9倍,北江的8.4倍。考虑到该东江河段流经制造业和加工业极为发达的东莞市和广州的新塘经济开发区,因此沿途接纳的未经处理的工业废水可能是造成东江饮用水源地污染比其他水源地严重的主要原因(Gong et al.,2016)。流溪河下游水源水中ΣEEDs的质量浓度相对较高,则可能与其离广州市区较近,受居民生活污水排放的影响较为明显有关(Peng et al.,2017)。相较而言,西江和北江的饮用水源地大多远离城市,受人类活动影响小,污染程度较低。此外,各流域水源地的EEDs的分布亦有自己的特征:西江(X1、X2)和北江(B1—B3)水源地ΣEEDs质量浓度呈现自上游到下游升高的特征;东江北干流(D1—D4)和南支流(D5、D6)水源水中的ΣEEDs质量浓度则均呈现朝下游河口方向逐渐降低的趋势。

图2 珠江三角洲水源地中EEDs的空间分布Fig. 2 Spatial distribution of EEDs in the water sources of the Pearl River Delta
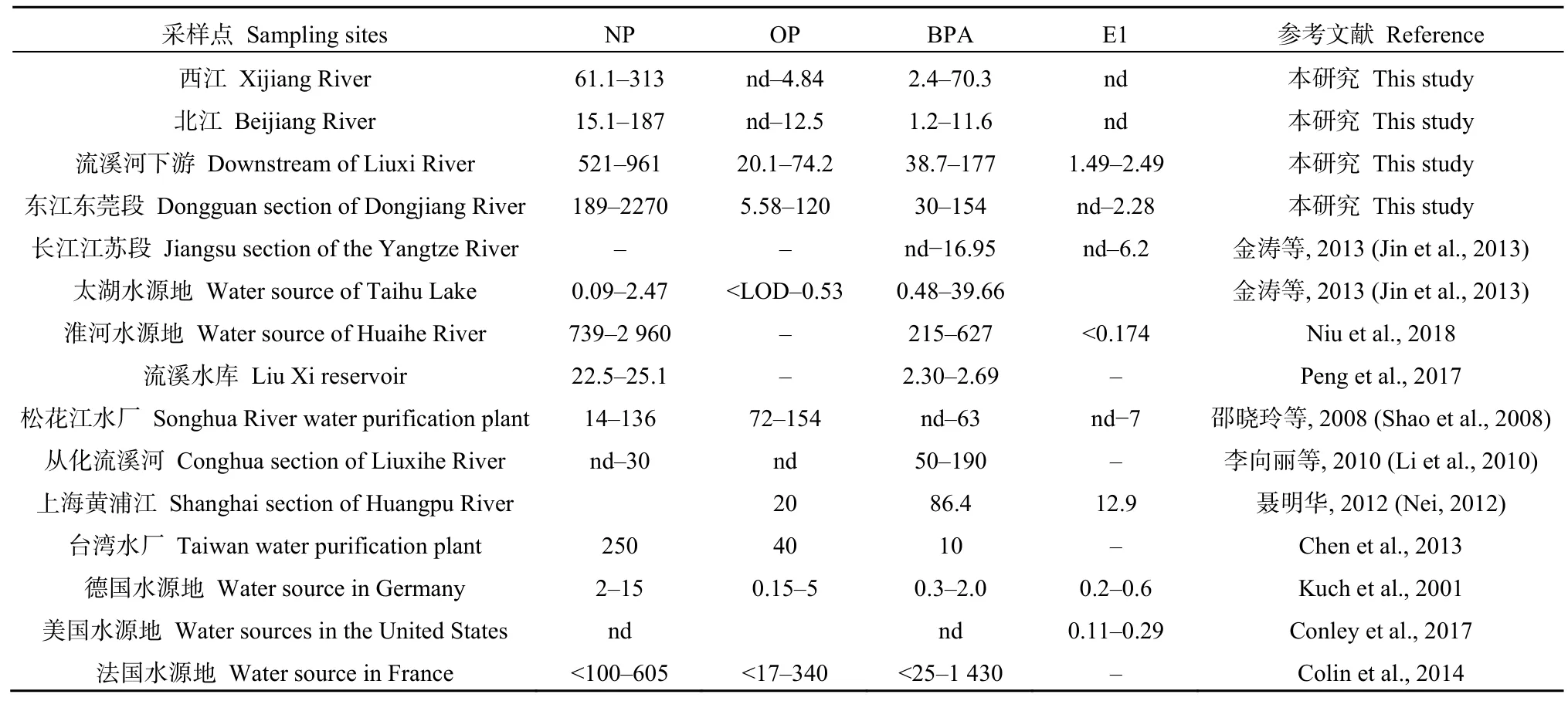
表2 国内外水源水中EEDs质量浓度的比较Table 2 Comparison of EEDs concentration between water sources in the Pearl River Delta and other regions ng·L−1
从季节上看,丰水期和枯水期ΣEEDs的质量浓度范围(平均值/中值)分别为 124—2460 ng·L−1(1180/1010 ng·L−1),26.5—1220 ng·L−1(369/240 ng·L−1)。可见,丰水期水源地ΣEEDs的质量浓度显著高于枯水期(图3),其中OP、NP、BPA和E1丰水/枯水期的平均质量浓度分别为 56.9/16.4 ng·L−1、 1080/286 ng·L−1、 43.7/177 ng·L−1、 1.1 ng·L−1/ 图3 珠三角河流水源地中EEDs的季节分布Fig. 3 Seasonal distribution of EEDs in the water source of the Pearl River Delta 表3 珠三角河流水源地中EEDs质量浓度与水质指标的Pearson相关性分析Table 3 Pearson correlation coefficients between EEDs concentrations and parameters of water quality in the water sources of the Pearl River Delta 对珠三角河流水源水中EEDs与水质理化参数之间以及各化合物之间进行相关性分析(表 3),结果发现:OP、NP、BPA、E1之间存在显著的正相关关系,表明它们在水体中的分布具有相似性,可能与它们相似的化学性质和来源有关。4种EEDs的质量浓度均与总悬浮颗粒物含量呈正相关性,呈现出明显的“颗粒物效应”,表明悬浮颗粒物的含量对EEDs的赋存有重要影响:随着悬浮颗粒物的含量增加,有机污染物在颗粒物/水间的分配系数减小,更多的污染物解吸进入溶解相(Nie et al.,2015)。另外,BPA与叶绿素 a也呈显著正相关关系(P<0.01)。考虑到叶绿素a的质量浓度可作为水环境中浮游植物丰度的指示物,因此它们之间的正相关表明来源于浮游植物的有机质可能是影响河水中BPA分布的重要因素之一(Zhang et al.,2015)。此外,BPA的质量浓度与 pH值呈显著负相关(P<0.05),这可能与EEDs的解离常数(pKa)有关。在不同的pH条件下,颗粒物对EEDs的吸附作用受到去质子化程度的影响(You et al.,2015)。本研究采集水样的pH在6.9—8.0之间低于BPA的pKa值(9.37)(Bayen et al.,2013)。因此,BPA主要以非离子态存在于水体中,易于被颗粒物吸附。环境中pH值越高越不利于BPA离解成离子状态赋存于水相。此外,水温与ΣEEDs呈显著负相关关系(P<0.01),这可能由于在水温较高的条件下,微生物及浮游生物的活性较大,对水相中的EEDs的降解、吸附作用也随之增强(Jiang et al.,2011;Gong et al.,2019);另外,夏季阳光充足,光解作用也会影响EEDs在水中的化学稳定性,导致EEDs的质量浓度降低(Koumaki et al.,2015)。 丰水/枯水期珠三角河流水源水中OP、NP、BPA、E1的RQ平均值分别为0.47/0.13、2.25/0.6、0.05/0.08和0.18/0.07(图4)。总体上OP、BPA、E1在两季均呈现中低等风险水平。值得注意的是,丰水期58%的采样点中NP的RQ值均大于1,呈现出高风险水平;在枯水期NP总体呈中等风险水平。可见,NP对大多数水源地形成了较高的生态风险,可能已对水生态及饮用水安全形成威胁,其环境效应不容忽视。 珠三角河流饮用水源地 EEDs的 HI值范围为0.045—6.05,平均值和中值分别为1.92和0.68(图5)。其中高风险点位(HI>1)占所有采样点的42%,表明近半数的水源地可能已经处于高风险水平。空间上,西江、北江、流溪河下游和东江东莞段水源水中EEDs的HI值范围(平均值)分别为0.21—0.65(0.33)、0.05—0.44(0.3)、1.54—3.23(2.39)、0.05—6.05(3.15),其空间分布特征与EEDs质量浓度分布基本一致。总体上,西江和北江的饮用水源地处于中低风险水平,而流溪河下游和东江东莞段水源地则存在高生态风险。 图4 珠三角河流水源地中EEDs的风险商(RQ)Fig. 4 RQ values of the EEDs in the water sources of the Pearl River Delta 图5 珠三角河流水源地的EEDs风险水平Fig. 5 Ecological risks of the EEDs in the water sources of the Pearl River Delta 从季节上看,水源地中EEDs的HI值在丰水/枯水两季的范围(平均值)分别为0.28—6.05(2.95)和0.045—3.23(0.88),丰水期水源地的风险总体高于枯水期。就不同流域而言,西江和北江水源地的两季HI值均小于1,无显著的季节性差异;流溪河下游枯水期HI值是丰水期的2.1倍,东江东莞段水源地丰水期和枯水期HI的范围(平均值/中值)分别为 3.66—6.05(5.31/5.64),0.48—2.27(1.0/0.85),丰水期的风险水平高于枯水期。综上所述,珠三角河流水源地均存在一定的生态风险,尤其是流溪河下游和东江东莞段,其水源水处于较高的风险水平,已对当地水生生物及饮用水安全形成严重威胁。 珠三角河流水源水中 ΣEEDs的质量浓度范围在 26.8—2460 ng·L−1之间,平均值和中值分别为775 ng·L−1和 325 ng·L−1,污染以 NP 和 BPA 为主。四处水源地的EEDs污染水平总体呈现出东江东莞段>流溪河下游>西江>北江的特征,丰水期EEDs的质量浓度显著高于枯水期。与其他水源地相比,珠三角河流水源水中的EEDs的污染在国内处于中高水平,NP、OP,BPA、E1的质量浓度水平均高于国外饮用水水源的报道值。EEDs的质量浓度分布与水温、pH、叶绿素a和悬浮颗粒物含量均存在一定的相关性,表明这些环境因子可能影响水体中EEDs的分布和行为。风险评价结果显示,流溪河下游和东江东莞段水源地处于相对较高的风险水平,主要贡献来自于NP,可能威胁到居民的饮水安全。2.3 EEDs与水环境理化参数间的相关性

2.4 风险评价


3 结论

