纳米氧化锌复合涂膜中锌的迁移及其对采后红橘的影响
高燕利,徐丹,任丹,吴习宇
(西南大学 食品科学学院,重庆,400700)
天然高分子涂膜能在果蔬表面形成半透性膜,通过减少果蔬水分散失和干物质消耗,降低果蔬内部CO2和O2与外界的气体交换速率,从而延缓果蔬的生理代谢活动,延长果蔬的贮藏期[1]。纳米材料具有比表面积大、光学性能好、机械强度高等特点,与高分子涂膜进行复合,可提高涂膜的力学性能、热学性能和阻隔性,从而改善涂膜的整体性能[2]。同时,纳米材料如纳米金属和金属氧化物具有良好的抗菌活性,将其引入高分子涂膜中可赋予其抗菌效果,从而抑制果蔬表面微生物的生长,降低腐烂率。目前已有很多研究将纳米材料与天然高分子复合涂膜用于采后果蔬尤其是水果的保鲜,并取得了显著的效果。例如纳米Ag可显著提高壳聚糖的机械性能、气体阻隔性能和抗菌性能,并延长鲜切甜瓜的保质期[3];将纳米SiO2与海藻酸钠复合涂膜能有效延长鲜切苹果的贮藏期[4];纳米TiO2/壳聚糖复合涂膜结合外援NO处理,可有效降低枇杷的呼吸强度和腐烂率,减缓其木质化败坏进程,从而具有更好的保鲜效果[5];将纳米ZnO加入羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC)中对新鲜石榴果粒涂膜,不仅能显著抑制果粒表面嗜温性细菌的生长,并能降低果粒的失重率,维持较高的花青素和维生素C含量[6]。
但纳米粒子因其颗粒小,在应用于食品包装时,可能会迁移到食品中导致安全风险[7]。目前,已有较多研究证实,含纳米粒子的包装膜(或容器)与食品[8](或食品模拟液[9])直接接触时,纳米粒子可从包装材料迁移至食品(或食品模拟液)中。但新鲜果蔬表面纳米复合涂膜中的纳米粒子与果蔬界面间的迁移行为尚未有文献报道。较多研究表明,培养液或土壤中的纳米粒子能通过农作物根茎表面的气孔进入农作物体内,参与其各项生理活动,进而对农作物的抗氧化防御系统以及产量等产生重要影响。如YANG等[10]综述了不同纳米粒子处理并迁移进植物体内后对植物的生长具有促进或抑制作用:纳米Ag能降低番茄的生物量和根长[11];纳米CuO能抑制小麦植株的生长[12];纳米TiO2能提高叶片叶绿素和过氧化氢酶含量,降低抗坏血酸过氧化物酶含量[13]等。
采后新鲜果蔬的果皮表面同样具有大量气孔,当其与纳米复合涂膜材料发生直接接触时,纳米粒子极有可能以不同形式从复合涂膜中迁移至果蔬内部并参与其生理活动。因此,本文采用具有良好抗菌和抗氧化活性的纳米氧化锌(ZnO nanoparticles,ZnO NPs)与CMC复合后,涂膜于采后红橘表皮,考察了不同质量分数(3%、6%和10%)、不同粒径(17、50和90 nm)的ZnO NPs与不同的红橘贮藏温度(4、12和20 ℃)对贮藏过程中果皮与果肉中Zn元素含量变化的影响,同时测定了红橘果实的品质指标,果皮的总氧化能力和抗氧化酶活性,旨在探究复合涂膜中Zn向红橘的迁移行为及其对红橘品质和抗氧化酶活性的影响,为其在采后果蔬保鲜的应用上提供理论指导。
1 材料与方法
1.1 实验材料试剂与仪器
新鲜红橘(CitrustangerinaHort. ex Tanaka),重庆潼南农户;ZnO NPs(17 nm,纯度>99.9%),北京博宇高科新材料技术有限公司;ZnO NPs(50 nm和90 nm,纯度99.8%),北京盛和昊源科技有限公司;CMC(实验纯),成都科龙化工试剂厂;总抗氧化能力检测试剂盒、超氧化物歧化酶和苯丙氨酸解氨酶活性检测试剂盒,北京索莱宝科技有限公司;其余试剂均为分析纯,重庆钛新化工有限公司。
Scientz-ⅡD超声波细胞粉碎机,宁波新芝生物科技股份有限公司;STHT-250恒温恒湿箱,上海三腾仪器有限公司;AAS-5 000原子吸收分光光度计,北京达丰瑞仪器仪表有限公司;PAY CHECK Model 650顶空分析仪,美国膜康公司;2WAJ阿贝折射仪,上海光学仪器五厂。
1.2 实验方法
1.2.1 涂膜液的制备
分别称取一定量17 nm的ZnO NPs,加入200 mL超纯水,用超声波细胞粉碎机分散得到质量浓度分别为300、600和1 000 mg/L的ZnO NPs分散液,然后向上述分散液中分别加入2 g CMC搅拌均匀后得到3%、6%和10%(ZnO NPs相对于CMC的质量分数,下同)的复合涂膜液。按照相同的方法,分别配制ZnO NPs粒径为50 nm和90 nm,质量分数均为10%的复合涂膜液。另称取2 g CMC于200 mL超纯水中搅拌均匀得到CMC涂膜液。
1.2.2 红橘涂膜
从当天采摘的红橘中挑选质量、大小、成熟度一致的果实,清洗后用体积分数为2%的NaClO水溶液浸泡2 min以杀灭表面微生物。置于室温下晾干后,将其随机分组,每组约180个果实。对照组(CK)不再做任何处理,CMC组涂覆CMC涂膜液。为考查ZnO NPs质量分数的影响,分别采用ZnO NPs质量分数3%、6%和10%的复合涂膜液对红橘涂膜;为考查粒径的影响,分别采用ZnO NPs质量分数均为10%,ZnO NPs粒径为17、50和90 nm的复合涂膜液对红橘涂膜。以上各组均置于相对湿度为90%,温度为20℃的恒温恒湿箱中贮藏。为考查贮藏温度的影响,将ZnO NPs质量分数均为10%,ZnO NPs粒径为17 nm的复合涂膜液对红橘涂膜,并分别置于相对湿度为90%,温度为4、12和20℃的恒温恒湿箱中贮藏。
1.2.3 红橘果皮与果肉中Zn含量的测定
各组红橘果实涂膜后即开始计时,前8 h内每小时从各组随机取出3个果实,直流水下洗净表皮涂膜层后用超纯水润洗一遍,随后将果皮剥下切碎,与果肉分别于60 ℃烘箱中烘干磨粉,经湿法消化[14]处理得到澄清的溶液后,用原子吸收分光光度计测定其中的Zn含量,单位为mg/kg DW,即每千克果皮(或果肉)干重(dry weight,DW)中的Zn含量。从第2天起每天取一次样,每组随机取3个果实,处理方法同上。
1.2.4 红橘品质的测定
将上述处理中的CK组、CMC组和采用ZnO NPs复合涂膜(ZnO NPs粒径17 nm,质量分数为10%)的红橘(ZnO/CMC组)用于品质测定,贮藏温度为20℃,相对湿度为90%。
(1)果实失重率的测定
每次测量从各组中随机选出50个果实用于测定失重率,通过公式(1)进行计算:

(1)
式中:m0,贮藏前各果实重量,g;m,贮藏期间果实重量,g。
(2)果实腐烂率的测定
每天记录各组中果实的腐烂个数。累计腐烂率记为每次测量时,每组累计腐烂的果实个数与该组果实初始数量的比值,单位为%。
(3)果实呼吸强度的测定
从每组中随机取8个果实,称重后置于洁净的干燥皿内,密封静置3 h后,将顶空分析仪的探头插入干燥皿内测定其中的CO2体积分数。每组样品进行平行取样,重复测定3次。各组果实的呼吸强度通过公式(2)计算得到:
呼吸强度/(mg CO2·(kg·h)-1))=
(2)
式中:φ,测得的干燥皿内CO2的体积分数,%;φ0,大气中CO2的体积分数,%;V,干燥皿体积,L;m1,干燥皿内果实总质量,kg;t,果实密闭时间,h。
(4)果肉可溶性固形物(total soluble solid,TSS)含量测定
将果肉打浆,经纱布过滤后,采用阿贝折射仪测定果汁中的可溶性固形物含量,结果以百分率表示。每组样品进行平行取样,重复测定3次。
(5)果肉可滴定酸(titratable acid,TA)含量测定
称取10 g果肉浆,用超纯水定容至100 mL,静置提取30 min后用纱布过滤得滤液。果肉中可滴定酸含量的测定和计算方法参照文献[15]进行,单位为%。每组样品平行取样,重复测定3次。
(6)果肉抗坏血酸(ascorbic acid,AA)含量测定
称取10 g果肉浆,用浓HCl配制体积分数为2% HCl溶液定容至100 mL,静置提取30 min后用纱布过滤得滤液。果肉中的抗坏血酸含量的测定和计算方法参照文献[15]进行,单位为mg/100 g。每组样品进行平行取样,重复测定3次。
1.2.5 果皮总抗氧化能力测定
称取0.1 g用液氮冷冻研磨好的新鲜果皮样品于10 mL离心管中,加入1 mL提取液,振荡混匀后于4 ℃静置2 h,然后于4 ℃、4 000 r/min离心30 min,收集上清液即为待测样品,低温保存备用。各组样品的总抗氧化能力依照总抗氧化能力检测试剂盒说明书测定并计算。每组样品进行平行取样,重复测定3次。
1.2.6 果皮酶活性测定
样品制备过程同1.2.5。各组果皮的过氧化物酶(peroxidase,POD)活性参照文献[15]进行测定并计算,超氧化物歧化酶(superoxide dismutase,SOD)和苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)活性分别参照检测试剂盒说明书进行测定并计算。每组样品进行平行取样,重复测定3次。
1.2.7 数据统计与分析
采用Origin 9.0作图,并用SPSS 19.0进行ANOVA单因素方差分析和Ducan’s多重检验(P<0.05)。
2 结果与分析
2.1 红橘果皮和果肉中Zn元素含量在贮藏期间的变化
2.1.1 果皮中Zn元素含量的变化
经不同处理后的红橘果皮中Zn含量随贮藏时间的变化如图1所示。从图1可知,涂膜1 h后,各处理组红橘果皮中的Zn含量随时间的增加而迅速增加。至8 h,红橘果皮中Zn元素含量达到最大值,为15.05 mg/kg DW。而CK组和CMC组果皮中的Zn在整个贮藏期间均在2.25~2.98 mg/kg DW(具体数据未列出)。各复合涂膜中果皮中的Zn含量大大高于CK组和CMC组,证实了涂膜中的Zn可向果皮中发生迁移。前5 h,不同质量分数的ZnO NPs均对果皮中Zn含量的影响较小;而5~7 h内,采用ZnO NPs质量分数为6%和10%涂膜的红橘果皮中Zn含量增加显著,高于3%组(图1-a)。同时,在涂膜前8 h,ZnO NPs粒径和贮藏温度对果皮中Zn含量的影响较小(图1-b和图1-c)。
随着贮藏时间的延长(第1~13天),各涂膜组果皮中Zn含量的增速明显减缓,且均在一定时间后趋于稳定。这可能是由于放置1 d后,红橘表面涂膜液中的水分挥发完全,CMC固化为膜,限制了ZnO NPs向果皮中的迁移。从图1-a可知,ZnO NPs质量分数为3%的处理组果皮中Zn含量在第1~13天几乎没有增加。ZnO NPs质量分数为6%和10%的处理组果皮中Zn含量呈一定的波动状态,但均高于3%处理组。不同ZnO NPs粒径处理的红橘果皮中Zn含量在贮藏第5天后趋于稳定,且各组无明显差异(图1-b)。这可能是由于3种ZnO NPs粒径均为100 nm以下,均远小于果皮表面气孔的直径(18~26 μm[16]),且Zn极有可能是以Zn2+的形式进行迁移,因此ZnO NPs的尺寸效应对Zn的迁移速率影响较小。贮藏温度对果皮中Zn含量的影响如图1-c所示。在4 ℃贮藏时,Zn迁移速度较慢,果皮中Zn含量显著低于12 ℃和20 ℃处理组,而12 ℃和20 ℃贮藏的红橘果皮中的Zn含量较为接近。综上说明,复合涂膜中Zn元素向红橘果皮中的迁移主要与ZnO NPs质量分数和贮藏温度有关,而ZnO NPs粒径对其影响不大。
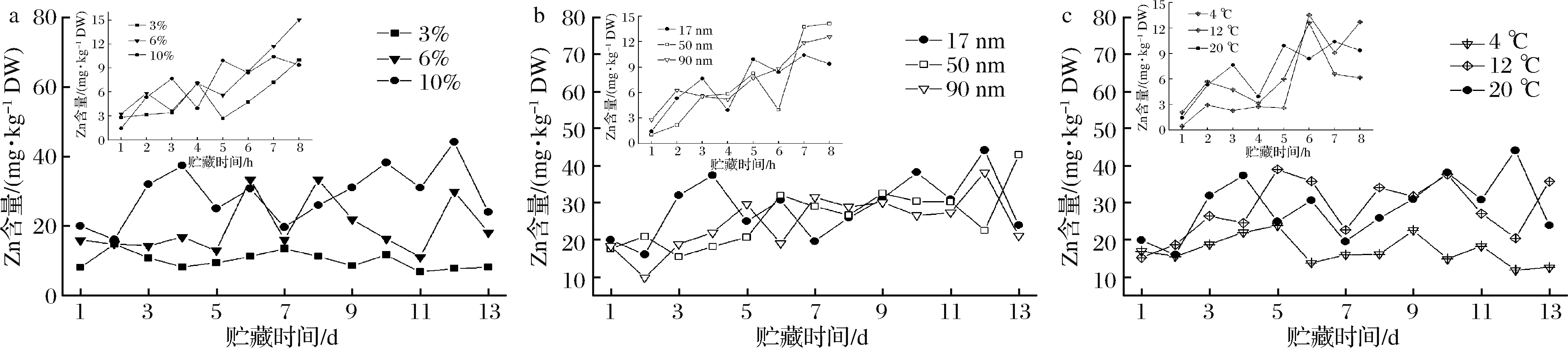
a-不同ZnO NPs质量分数;b-不同ZnO NPs粒径;c-不同贮藏温度图1 ZnO NPs质量分数、粒径和果实贮藏温度对贮藏期间红橘果皮中Zn含量变化的影响Fig.1 Effects of ZnO NPs mass fraction,particle size and storage temperature on the Zn content in tangerine peel during storage注:图中嵌入小图为对应处理下贮藏前8 h内红橘果皮中Zn含量的变化
2.1.2 果肉中Zn元素含量的变化
红橘果肉中的Zn含量在贮藏期间的变化情况如表1所示。

表1 ZnO NPs质量分数、粒径和果实贮藏温度对贮藏期间红橘果肉中Zn含量变化的影响 单位:mg/kg DW
由表1可看出,处理组红橘果肉中的Zn含量很低,为3.35~11.60 mg/kg DW,与CK组果肉中的Zn含量(6.20~6.75 mg/kg DW)接近(具体数据未列出)。而从2.1.1中可知,经复合涂膜处理的红橘果皮中的Zn含量最大值可达到44.23 mg/kg DW,远高于果肉中的Zn含量,表明ZnO NPs复合涂膜中的Zn迁移到了红橘果皮中,但尚未向果肉中迁移。由此说明,将ZnO NPs应用于红橘的复合涂膜具有较好的安全性。
2.2 红橘在贮藏期间的品质变化
上述结果表明,采用复合涂膜处理的红橘,其果皮中的Zn元素含量在贮藏期间显著增加。为进一步探讨复合涂膜红橘果皮中Zn元素含量的增加对红橘贮藏品质的影响,选取了果皮中Zn元素含量最高的一组,即采用ZnO NPs粒径为17 nm、质量分数为10%的复合涂膜处理后于20℃贮藏的红橘,测定其贮藏品质。
2.2.1 腐烂率、失重率和呼吸强度
如图2-a所示,在贮藏期间各组的腐烂率均随贮藏时间的延长而增加,但各组的变化趋势有所不同。在贮藏前6 d,各组果实的腐烂率较为接近。但7 d后,CK组的腐烂率持续增加,而CMC和ZnO/CMC组的腐烂率则较为稳定,且此时ZnO/CMC组的腐烂率低于CMC组。贮藏至第10天时,CMC和ZnO/CMC组的腐烂率均再次持续增加,且二者的数值相近,并大大低于CK组。由此说明,涂膜组可在贮藏后期有效降低果实的腐烂率。含ZnO NPs的复合涂膜,可在一定时期降低果实的腐烂率,但在贮藏后期,复合涂膜的效果与纯CMC涂膜接近。目前的研究认为,纳米粒子增强涂膜保鲜效果的机理包括:纳米粒子的抗菌作用抑制了的果实表面微生物的生长[6];纳米粒子增强了涂膜的阻隔性[2],从而对果实的呼吸作用起到抑制和调节作用。但2.1的研究结果表明,涂膜中的Zn可迁移至果皮内导致果皮内Zn含量显著增加。迁移至果皮中的Zn是否会影响果皮的生理活动进而影响果实的成熟和腐烂过程,则需要进一步研究。
红橘采后失重的主要原因是呼吸过程中的干物质损耗和蒸腾作用中的水分散失[17]。从图2-b可看出,各组红橘的失重率在前8 d均持续上升,且组间无显著性差异。而第9天后,各组失重率的增加趋势相对减缓,但CK组的失重率显著低于2个涂膜组。这可能是由于CMC为亲水性高分子,在高湿度(90%)贮藏条件下,容易吸湿润胀而不能有效抑制果实中水分的散失。
果实采摘后仍具有呼吸作用,且其采后呼吸强度反映了果蔬采后的生理代谢状态[18],因此是影响果实贮藏品质和货架期的重要因素之一。如图2-c所示,各组红橘果实的呼吸强度在贮藏期间总体呈现下降趋势。在贮藏时间的前6 d,CK组的呼吸强度低于CMC和ZnO/CMC组,但从第7天开始,CK组的呼吸强度则逐渐高于涂膜组。由此说明,涂膜处理在贮藏后期对红橘呼吸的抑制作用较为显著,与腐烂率的变化趋势较为一致。ZnO/CMC复合涂膜组的呼吸强度在贮藏前6 d较CMC组高,而随着贮藏时间的增加,其呼吸强度处于较低水平,但Zn向红橘果皮的迁移是否会影响其呼吸强度仍需进一步的研究。

a-腐烂率;b-失重率;c-呼吸强度图2 各组红橘的腐烂率、失重率和呼吸强度随贮藏时间的变化Fig.2 Variations of rotting rate,weight loss and respiration rate of tangerine fruits during storage不同小写字母标注表示相同贮藏时间的各组样品间存在显著性差异(P <0.05)(下同)
2.2.2 TSS、TA和AA
TSS、TA和AA是果实贮藏期间的重要指标。TSS含量的变化反映了果实的成熟度和呼吸速率;TA的主要成分是有机酸,通常是呼吸酶反应的底物;AA是红橘的重要营养成分和抗氧化成分[19]。各组红橘在贮藏期间的TSS、TA和AA含量的变化情况如图3所示。贮藏初期由于蔗糖的合成,各组的TSS含量呈增加趋势(图3-a),后期由于个体差异等原因呈现一定的波动,但ZnO/CMC组的TSS含量较为稳定,且整体维持在较高水平。TA含量在贮藏期间呈波动下降趋势(图3-b),CK组的TA含量从第6天起急剧下降,而CMC涂膜可较为显著地延缓TA的降低。图3-c为各组红橘的AA含量变化,可看出CMC组的AA含量在贮藏期间相对稳定;CK组和ZnO/CMC组则先降低后升高,且CK组升高较快,因此在贮藏中期(第6~10天)具有最高的AA含量;而ZnO/CMC组的AA含量则从第2天开始持续上升,因此在贮藏末期(第12天),其AA含量高于其余两组。CMC组的AA含量呈先波动升高而后降低的趋势,CMC组的AA含量相较于CK和ZnO/CMC组变化较小,而ZnO/CMC组先下降然后逐渐上升,且在贮藏末期显著高于其余两组(图3-c)。总体而言,CMC涂膜可在贮藏前期(第0~4天)保持比较高的TA和AA含量,而ZnO/CMC组可较好地保持TSS的含量,但二者的影响机制还需要进一步研究。

a-TSS;b-TA;c-AA图3 各组红橘中TSS、TA和AA含量随贮藏时间的变化Fig.3 Variations of TSS,TA and AA content of tangerine fruits during storage
2.3 果皮中的酶活性在贮藏期间的变化
迁移进入植物体内的纳米粒子能够促进活性氧的产生,过量的活性氧会引起植物的氧化应激,并改变氧化和抗氧化系统的平衡,从而影响植物体内的代谢过程[10]。2.1的研究结果表明,Zn在红橘中的迁移仅限于果皮,而果皮是果实的保护屏障,其中含有大量抗氧化酶,对延长采后红橘的贮藏期起着至关重要的作用。因此,实验测定了各组红橘果皮中的抗氧化酶活性在贮藏期间的变化情况。
2.3.1 POD活性
POD可清除植物体内多余的过氧化物[20]。如图4所示,各组红橘果皮中的POD活性在贮藏期间总体呈波动增长趋势。其中,CMC组的POD活性总体低于其余两组,但在贮藏10 d时迅速增加至与ZnO/CMC组相同。CK组和ZnO/CMC组的波动规律相似,但ZnO/CMC组随贮藏时间的变化较CK组小。KIM等[21]用ZnO NPs处理后的黄瓜幼苗中,由于Zn的迁移产生活性氧,导致POD活性显著增加,但增加程度与ZnO NPs的质量浓度有关。本研究中迁移进入果皮的Zn含量较低,因此可能对POD活性的影响较小。

图4 各组红橘果皮的POD活性随贮藏时间的变化Fig.4 Variations of POD activity in peels of tangerinefruits with different treatments during storage
2.3.2 SOD活性
SOD是植物体保护酶系统的重要组成部分[22],能清除果实体内产生的自由基[23]。如图5所示,CK组的SOD活性在贮藏期间先增加,在第4天达到最大值,随后逐渐减小,在第12天SOD活性最低,不到ZnO/CMC组的1/5。CMC组的SOD活性在贮藏期间整体呈波动增加的趋势,在第10天时达到最大值,随后又降低,说明涂膜处理能够在红橘表皮形成阻隔性薄膜,阻止氧气进入,减少果皮内产生超氧阴离子自由基,从而抑制SOD活性的下降[23]。而ZnO/CMC组的SOD活性在贮藏前4天迅速增加,随后降低再增加,在第12天时显著维持在组间最高水平。SOD是抗氧化酶体系中,催化超氧自由基歧化反应的酶,因此对体系中的过氧化物非常敏感。因此贮藏中期ZnO/CMC组中SOD活性被抑制,可能是由于活性氧过度产生和防御能力下降导致的氧化应激[21]。而贮藏后期CMC组和ZnO/CMC组均具有较高的SOD活性,则可能与涂膜对果实呼吸和代谢的抑制作用有关。

图5 各组红橘果皮的SOD活性随贮藏时间的变化Fig.5 Variations of SOD activity in peels of tangerinefruits during storage
2.3.3 PAL活性
PAL是植物体内一种重要的次生代谢酶,可保护植物机体免受病原菌的侵染,提高抗病性[24]。从图6中可看出,各组的PAL活性在贮藏期间的变化均较小,尤其是前8 d。总体而言,ZnO/CMC组的PAL活性在贮藏期间均呈较高水平,说明复合涂膜有助于保持果实中PAL活性,增强果实的防病害能力。
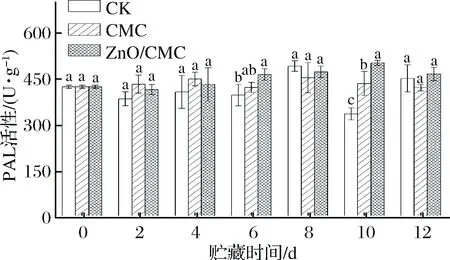
图6 各组红橘果皮的PAL活性随贮藏时间的变化Fig.6 Variations of PAL activity in peels of tangerinefruits during storage
2.4 果皮总抗氧化能力在贮藏期间的变化情况
红橘果皮的抗氧化能力主要来源于酚类化合物、黄酮类化合物、维生素C和抗氧化酶等[25]。如图7所示,CK组的总抗氧化能力在贮藏期间除第8天外均显著低于CMC组和ZnO/CMC组,说明涂膜处理可将果皮的总抗氧化能力维持在较高水平,延缓果实的衰老。而ZnO/CMC组与CMC组的总抗氧化能力仅在第10天时具有显著性差异,说明复合涂膜中Zn的迁移对果皮总抗氧化能力的影响较小。AKANBI-GADA等[26]发现在含ZnO NPs土壤中生长的西红柿果实中,总酚和黄酮类化合物等非酶抗氧化物质的浓度随ZnO NPs浓度的增加而降低。而在本研究中,复合涂膜中的Zn向果皮的迁移量有限,且非酶抗氧化物质与抗氧化酶共同构成了红橘的呈动态平衡的抗氧化系统,导致ZnO NPs复合涂膜对红橘果皮总抗氧化能力的影响较小。
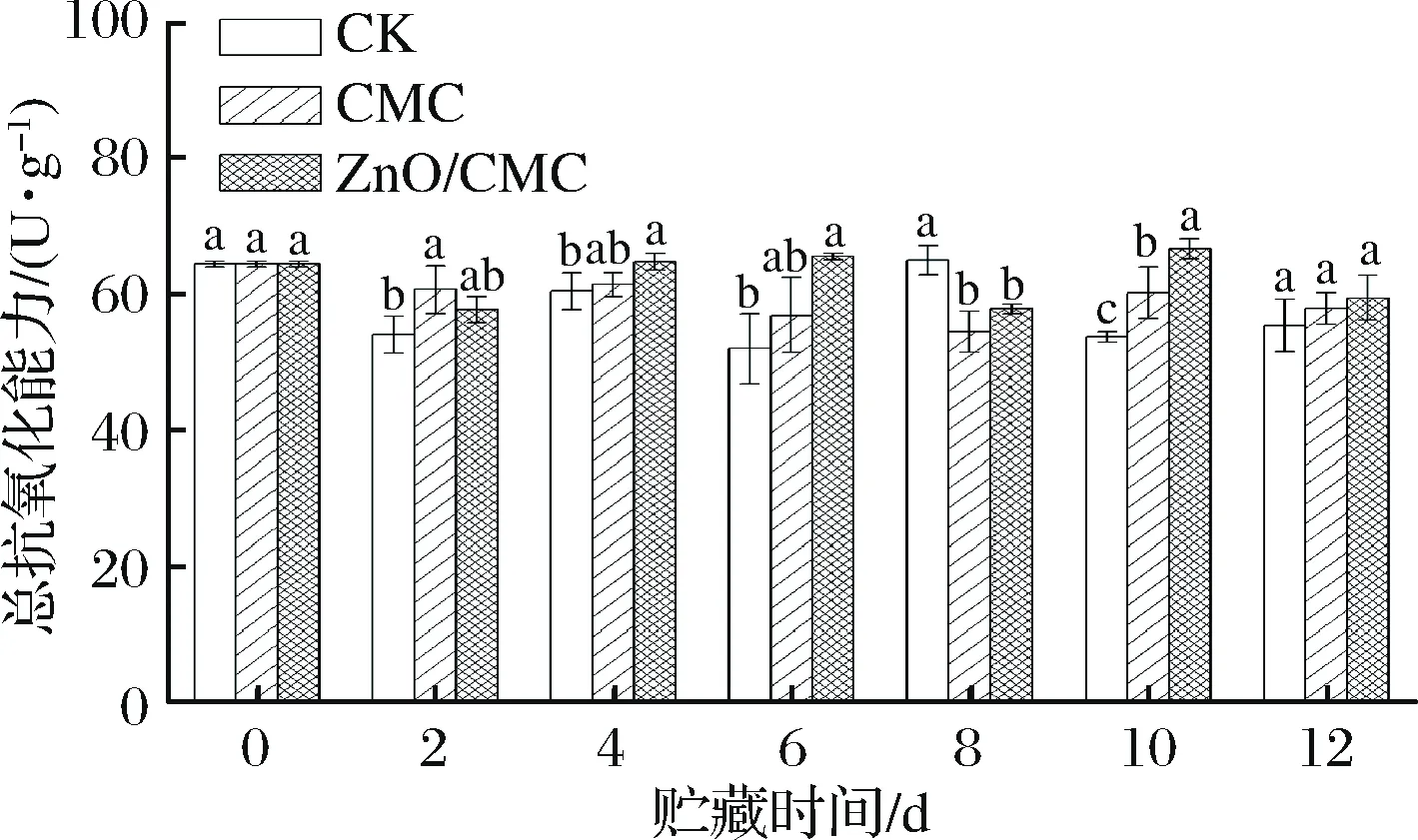
图7 各组红橘果皮的总抗氧化能力随贮藏时间的变化Fig.7 Variations of total antioxidant capacity in peels oftangerine fruits during storage
3 结论
本研究证实了采用ZnO/CMC对红橘进行复合涂膜会导致红橘果皮中Zn含量相较于CK组显著增加。在涂膜后8 h内,复合涂膜组果皮中的Zn含量迅速增加;在贮藏1~13 d内,红橘果皮中的Zn含量缓慢增加至稳定,且与涂膜中ZnO NPs质量分数和红橘贮藏温度有关,但ZnO NPs粒径对其影响较小。ZnO/CMC涂膜组中Zn的迁移仅限于果皮,果肉中Zn含量无显著增加,说明对红橘进行纳米复合涂膜具有较好的安全性。与CK组相比,CMC和ZnO/CMC涂膜可显著降低红橘在贮藏后期的腐烂率,可能与涂膜对红橘呼吸强度的抑制有关。与CMC组相比,ZnO/CMC组在仅第7~9天具有较低的腐烂率,说明ZnO NPs的添加对红橘腐烂率的抑制效果较为有限。但ZnO/CMC组在贮藏后期能保持较高的TSS和AA含量,延缓TA含量的下降,保持了较好的贮藏品质。涂膜有助于增强各组果皮中的POD、SOD和PAL活性以及总抗氧化性,但复合涂膜造成的Zn迁移对果皮的抗氧化酶活性影响较小,可能是Zn的迁移量较小所致。在今后的研究中应进一步明确涂膜中ZnO NPs在果皮中的迁移形式(纳米粒子或Zn2+),以及迁移进入的Zn对果皮生理代谢的具体影响机制,以深入探讨纳米复合涂膜的保鲜机理,并为其安全合理应用提供理论基础。

