基于CAR T免疫治疗方法用PHA包裹pomalidomide构筑医用纺织品功能后整理剂
王志雄,刘 慧,缪伟伟,傅珈豫,娜日苏2,
(1.上海理工大学,上海 200093;2.马鞍山学院,安徽马鞍山 243100;3.日本国立大阪大学,日本大阪府吹田市 565-0871)
跨界研究和医工融合,用工学的手段解决医学问题已越来越多地受到研究者的关注与追捧。本研究主要是通过设计纺织品后整理剂赋予纺织品特殊的医学功能,并利用药学原理达到提高医学治疗效果的目的。随着医疗手段和纺织品后整理技术的不断进步,医用纺织品在医疗行业中的应用越来越广,包括普通医用纺织品和高性能医用纺织品。高性能医用纺织品是指采用高科技提高产品使用性能、增加产品附加值,达到医用目的的纺织品,如外科用非植入性纺织品[1]。而这些医用纺织品很大一部分功能是依靠后整理剂来实现的。
经皮给药系统(transdermal drug delivery system,TDDS)是指药物以恒定速度(或接近恒定速度)穿过角质层,通过皮肤吸收进入全身血液循环,达到有效血药浓度,高效率地转送到目标组织,实现疾病的治疗或预防[2]。为了降低皮肤天然屏障对药物吸收的阻碍作用,目前主要采用物理方法、生物化学方法促进药物透皮吸收。其中物理方法主要包括离子导入、电穿孔、超声波导入和微针等,在紧急或病情严重的情况下,该方法能够显著提高药物渗透率,提高临床疗效。但对长期用药的患者来说,他们皮肤的天然结构会被破坏,导致部分皮肤病的发生。
聚羟基脂肪酸酯(PHA)是一种由羟基脂肪酸单体构成的高分子聚合物,由6~14 个单体碳原子组成的mcl-PHA 玻璃化温度(Tg)低,在常温下有黏着性[3]。由分子结构可知,PHA 主链具有弱亲水性,侧链具有疏水性,因此对离子型物质具有良好的分散作用[4]。前期的研究表明,mcl-PHA 能够控制药物释放,并在较长时间内维持特定的物质浓度[5];mcl-PHA 是高分子材料,不容易进入人体且可生物降解,不会对环境造成污染。因此,以mcl-PHA 作为基质制备含有pomalidomide的医用纺织品功能后整理剂构筑pomalidomide TDDS 是可行的。选用TDDS 的优点:(1)避开了肝脏对药物的首过效应;(2)血药浓度容易维持稳定;(3)撤药方便简单。
FDA 批准了第一种CAR T 细胞疗法,用于治疗CD19 抗原阳性的复发性或难治性B 细胞急性淋巴细胞白血病(ALL)[6],但CAR T 细胞疗法成功治疗实体瘤的报道很少。而pomalidomide(CC-4047,Actimid;Celgene Corporation,Warren,NJ,USA)是第三代免疫调节药物,不仅可以调节T 细胞功能,还能改善肿瘤微环境[7-8]。但关于pomalidomide 与CAR T 细胞联合治疗实体瘤的报道还很少。本研究以第三代CAR T细胞CD133-CAR T 细胞[9]作为研究对象,并以U251 CD133-OE luc(转入萤火虫荧光素酶基因且CD133过表达的人胶质瘤细胞)作为靶细胞,探究了pomalidomide 对CD133-CAR T 细胞的调节作用,以及将mcl-PHA 用于医用纺织品构筑的pomalidomide 经皮给药系统的透皮能力。
1 实验
1.1 材料
mcl-PHA(大阪大学药学研究科生物工学研究室),冻存的人外周血单核细胞(PBMC)[ALLCELLS(PB005F,Alameda,CA,USA)],pomalidomide(HY-10984,Monmouth Junction,NJ,USA)(MedChemExpress),胶质瘤细胞系U251(U251-WT)(中国科学院细胞库)。
1.2 细胞制备
用编码人CD133 蛋白的piggyBac 转座子质粒和piggyBac 转座酶载体对U251 细胞进行核转染,通过药筛得到过表达CD133 的细胞U251 CD133-OE。再用编码萤火虫荧光素酶的转座子质粒和piggyBac 转座酶载体再次对U251 CD133-OE 进行核转染,并且通过药筛获得表达荧光素酶的肿瘤细胞株U251 CD133-OE luc。使用编码萤火虫荧光素酶的转座子质粒和piggyBac 转座酶载体对U251 细胞进行核转染,得到U251-WT luc[10]。将表达CD133-CAR 的piggyBac 转座子质粒和piggyBac 转座酶载体转入PBMC内,经激活培养和药筛得到CD133-CAR T 细胞[9]。对照细胞为未转染的T(NT)细胞,制备方法与CAR T 细胞类似,但是省去电转和药筛等步骤。pomalidomide的浓度为10 mmol/L,在-80 ℃下储存,溶于二甲基亚砜(DMSO)。
1.3 测试
1.3.1 体外透皮
在室温条件下,取10 mg mcl-PHA(溶解于氯仿中)与5 mg 模型药物混合,均匀涂覆于聚酯薄片表面,干燥后制成TDDS 模型。在玻璃圆筒上贴上响尾蛇蜕下来的新鲜蛇皮,干燥后向玻璃圆筒里注入生理盐水,放置一段时间后弃去生理盐水。将制备好的TDDS 模型贴在蛇皮上,再向玻璃筒内部注入生理盐水,构筑体外渗透研究装置(如图1 所示)。渗透24 h后用UV-2450 分光光度计测量生理盐水中模型放出药物的浓度,分析mcl-PHA 促进药物渗透的效果,实验至少重复3次。

图1 体外渗透装置
1.3.2 细胞毒性
将U251 CD133-OE luc 或U251-WT luc 肿瘤 细胞按照1×104个/孔接种到96 孔白色微孔板(PerkinElmer,Waltham,MA,USA)中,根据不同的效靶比加入CD133-CAR T 细胞,同时加入pomalidomide(药物最终浓度分别为0.1、1.0、10.0 μmol/L),共培养200 μL。细胞在T 细胞培养基中培养72 h 后加入0.75 mg/mL D-荧光素K+盐(PerkinElmer,122799),并使用En-Spire Multimode 读板仪(PerkinElmer)读取信号值,实验至少重复3 次。靶细胞杀伤效率p=(1-共培养孔的荧光值/肿瘤细胞单独培养孔的荧光值)×100%,用GraphPad Prism 软 件6.0 版(GraphPad Software,San Diego,CA,USA)对计算结果进行统计学处理,p小于5%即认为具有统计学意义。
1.3.3 细胞因子分泌水平
在96孔板中接种1×105个U251 CD133-OE luc肿瘤细胞,并按照2∶1 的效靶比加入CD133-CAR T 细胞,再加入pomalidomide使最终浓度为1 μmol/L,共培养200 μL,培养24 h。收集上清液,按AlphaLISA 试剂盒(PerkinElmer;IL-2,AL221C;IFN-γ,AL217C;TNFα,AL208C;GM-CSF,AL216C)的使用说明检测细胞因子浓度。NT 细胞的细胞因子检测需要将2×105个NT 细胞接种至96 孔板,并按照使用说明加入T Cell TransAct™human(Miltenyi Biotec GmbH,Cologne,NRW,Germany)激活剂,培养24 h,收集上清液并检测。每种细胞因子的浓度以3 个复孔计算的均值来表示,实验至少重复3 次,细胞因子浓度均值的计算使用Excel 完成,实验结果使用FlowJo V-10(BD Biosciences,Bedford,MA,USA)进行处理。
2 结果与讨论
2.1 体外透皮结果
观察mcl-PHA 构筑的经皮给药系统,在干燥前能均匀混合,呈透明状,没有发生结晶现象;放置一段时间后在空气中未发生反应,性能稳定,即mcl-PHA 构筑的经皮给药系统具有良好的稳定性。模型药物的实验剂量为273.24 μg/d,TDDS 在1×10 cm2面积上需要的渗透量为27.324 μg/cm2/d。由表1 可知,在mcl-PHA 基质中药物的透皮渗透量平均值为27.867 μg/cm2/d,方差为0.450 925,说明mcl-PHA 构筑的TDDS使药物浓度满足实验需要。

表1 药物的透皮渗透量
2.2 pomalidomide 增强CD133-CAR T细胞功能
由图2 可知,在药物浓度相同的情况下,CD133-CAR T 细胞的杀伤效率随着效靶比的提高而不断升高。当效靶比为2∶1时,3种浓度的加药组杀伤效率都有明显提高;当效靶比为1∶1或1∶2时,只有当pomalidomide 浓度为0.1 或1.0 μmol/L 时,pomalidomide 组的杀伤效率相比DMSO 组才有明显提高。当效靶比一定时,1.0 μmol/L pomalidomide 对CD133-CAR T 细胞的杀伤功能促进作用最强。同时,采用U251-WT luc(CD133 抗原低表达的胶质瘤细胞)作为靶细胞与CD133-CAR T细胞共培养后,pomalidomide对CD133-CAR T 细胞的杀伤功能没有影响。这说明在CD133-CAR T 细胞未被激活的情况下,pomalidomide 不会诱导CD133-CAR T 细胞产生非特异杀伤作用。

图2 pomalidomide 对CD133-CAR T 细胞杀伤功能的影响
如图3 所示,与R10 组(培养基对照)相比,DMSO组IL-2(白细胞介素-2)、TNF-α(肿瘤坏死因子)、GM-CSF(粒细胞-巨噬细胞集落刺激因子)和IFN-γ(γ 干扰素)的细胞因子分泌水平没有显著差异,但是pomalidomide 对CD133-CAR T 细胞分泌4 种细胞因子都具有明显的促进作用。

图3 1 μmol/L pomalidomide 对CD133-CAR T 细胞细胞因子分泌水平的影响
2.3 pomalidomide 对未转染T细胞功能的调节
为进一步探究激活方式是否会影响pomalidomide 对T 细胞的调节作用,对未转染的T(NT)细胞(不表达CAR)进行研究。由图4 可知,DMSO 对NT 细胞的细胞因子分泌水平不产生作用,而pomalidomide明显促进了NT 细胞分泌IL-2、TNF-α、GM-CSF 和IFN-γ细胞因子。
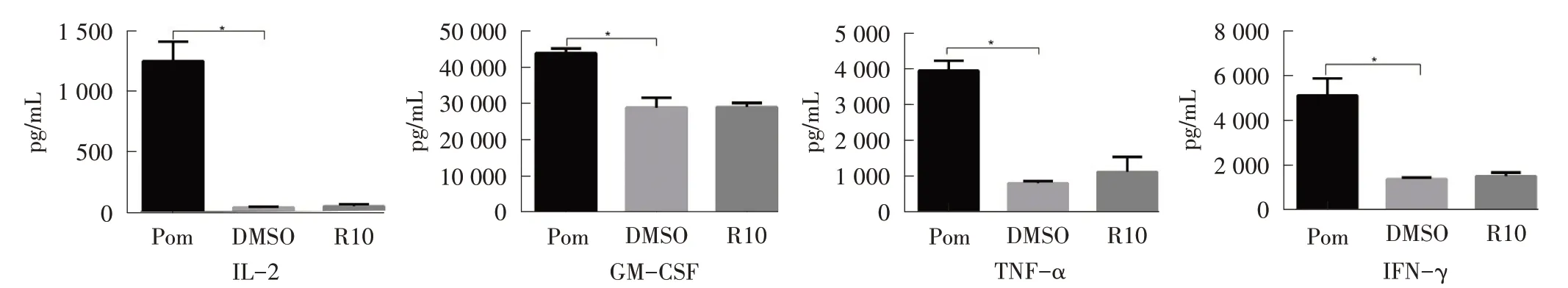
图4 1 μmol/L pomalidomide 可提高NT 细胞分泌细胞因子的水平
3 结论
(1)pomalidomide 对CD133-CAR T 细胞的杀伤功能有明显的促进作用,并且当pomalidomide 浓度为1.0 μmol/L 时,对杀伤功能的增强效果最明显。但在未激活的情况下,pomalidomide 对CD133-CAR T 细胞的杀伤功能不产生影响。pomalidomide还对CD133-CAR T 细胞及NT 细胞分泌IL-2、TNF-α、GM-CSF、IFN-γ等4种细胞因子都有明显的促进作用。
(2)pomalidomide 可以显著提高CAR-T 细胞对肿瘤细胞的杀伤效率;pomalidomide 与CD133-CAR T联用时,可以提高细胞的细胞因子分泌水平,并明显改善其对肿瘤细胞的杀伤效果。因此,pomalidomide与CAR T 细胞联用可以改善CAR T 细胞治疗实体瘤的效果。
(3)响尾蛇皮结构与皮肤角质层相似,将mcl-PHA 用于医用纺织品中构筑的Pomalidomide 经皮给药系统具有药物透皮能力,且药物透皮量达到实验需求。因此有望制造一种使用方便、患者易接受、药物浓度恒定、避免肝脏首过效应和药物在胃肠道灭活的医用纺织品联合细胞治疗,实现对实体瘤的免疫治疗。
(4)构筑了后整理剂-医用纺织品-经皮给药-疾病治疗效果的闭环,达到了通过设计纺织品后整理剂赋予纺织品特殊的医学功能,并利用药物原理达到提高医学治疗效果的目的。这对后整理剂进入医学领域有着特别重要的意义,也对后整理剂的拓展提供了一种方法与手段。值得注意的是,本研究更注重确定一个逻辑关系是否成立,是一个试探性研究。研究还停留在体外阶段,还要进一步从体内及动物实验中获取数据与佐证。作为后整理剂,对于纺织品的选择及作为医用纺织品在纺织品性能上还要做进一步研究,才能更好地成为一种新型产品和产业。

