CD11b+细胞诱导CD8+T细胞表达PD-1研究
许军英,廖原,冯叶叶,王小芳,陈雪玲
(石河子大学医学院,新疆 石河子 832002)
恶性肿瘤是严重危害人类生命健康的复杂疾病,导致人类死亡的重要原因。适应性免疫细胞以及固有免疫细胞在抗肿瘤方面发挥重要作用,如CD8+T细胞以及NK细胞对肿瘤细胞具有杀伤作用[1]。CD8+T细胞是发挥抗肿瘤的主要免疫细胞,肿瘤微环境中存在大量抗肿瘤抗原特异性的CD8+T细胞[2]。CD8+T细胞可特异性识别肿瘤抗原,CD8+T细胞杀伤靶细胞机制如下:通过分泌分泌穿孔素、颗粒酶B引起肿瘤细胞凋亡;通过表达死亡受体Fas与肿瘤细胞表面的配体FasL结合,诱导肿瘤细胞凋亡;通过分泌TNF-α等改变靶细胞溶酶体的稳定性,抑制靶细胞的代谢以及活化靶细胞核酸内切酶引起细胞死亡等。但是,肿瘤细胞仍然难以被全部清除,因为在肿瘤微环境中,CD8+T细胞极容易耗竭[3]。
肿瘤微环境(Tumor microenvironment,TME)是低糖、低氧、偏酸性的微环境,其中包含大量免疫抑制成分,包括发挥多种发挥免疫抑制作用的细胞,如肿瘤相关巨噬细胞(Tumor-associated macrophage,TAM)、骨髓来源的抑制性细胞(Myeloid-derived suppressor cells,MDSC)和调节性T细胞 (Regulatory cell,Tregs)及抑炎因子IL-10、TGF-β等[4]。在肿瘤微环境中,CD8+T细胞葡萄糖转运能力下降以及糖酵解受到抑制,抑制CD8+T细胞发挥杀伤功能[5]。肿瘤抗原长期刺激以及慢性病毒感染导致CD8+T细胞耗竭,早期耗竭以IL-2分泌减少、杀伤靶细胞能力下降和克隆性增殖能力受损为主,此时,CD8+T细胞仍可产生TNF-α;进展到T细胞耗竭晚期,IFN-γ产生能力明显受损,其基因表达谱有别于效应T细胞以及记忆T细胞亚群[6]。
耗竭CD8+T细胞表面广泛表达程序死亡性受体1(Programmed cell death protein 1,PD-1)[7],PD-1是CD8+T细胞免疫抑制性受体之一。程序性死亡配体1(Programmed Cell Death 1 ligand 1,PD-L1)表达于多种细胞表面。PD-1与其配体PD-L1结合后,传导抑制信号,抑制CD8+T细胞活化代谢以及增殖,引起CD8+T细胞凋亡[8-9]。除此之外,耗竭CD8+T细胞表面表达其他免疫抑制分子,如淋巴活化基因-3(Lymphocyte activation gene 3,LAG-3)以及T细胞免疫球蛋白-3(T cell immunoglobulin and mucin domain-3,TIM-3)[10]。肿瘤微环境中还存在大量以肿瘤相关巨噬细胞(Tumor-associated Macrophages,TAMs)为主CD11b+的细胞以及部分MDSC和DC,其中MDSC以及TAMs发挥免疫抑制作用,促进肿瘤生长[11]。但是,CD11b+细胞与肿瘤微环境中CD8+T细胞表达PD-1是否相关尚不清楚。本研究着重探讨在肿瘤微环境中,CD8+T细胞PD-1表达的机制。
1 材料与方法
1.1 细胞系与实验动物
小鼠肺癌细胞株3LL;C57BL/6小鼠,雌鼠,体重20~25 g,购买自新疆医科大学动物实验中心。
1.2 主要试剂和仪器
流式抗体(PE-CY7 anti-mouse CD45、APC anti-mouse PD-1、FITC CD8 anti-mouse、APC anti-mouse CD19、Pacific BuleTManti-mouse CD3、anti-mouse TIM-3、anti-mouse LAG-3),Biolegend公司;CD11b+细胞磁珠分选试剂盒以及CD8+T细胞磁珠分选试剂盒,美天旎公司;PBS、1640、胎牛血清,Gibco公司;流式仪BD AriaⅢ,BD公司。
1.3 构建小鼠皮下荷瘤模型
在37 ℃ 5% CO2恒温培养箱中使用75 cm2培养瓶培养3LL细胞,待其长势良好,制备成单细胞悬液,使用PBS重悬。选取10只健康C57小鼠,随机平均分为两组,一组为正常对照组,一组为肿瘤模型组。将模型组小鼠经腹腔麻醉,于左下腹皮下注射3LL单细胞悬液,细胞注射量为106/只。于第7天,发现小鼠左下腹皮下肿瘤明显生长。于第14天,将小鼠脱臼处死。剥取完整肿瘤组织,称重。
1.4 肿瘤组织制备单细胞悬液
将肿瘤组织剪碎,使用胶原酶处理,PBS洗涤两次后,裂解红细胞过滤,使用PBS重悬。
1.5 流式细胞术检测细胞表面蛋白表达
收集细胞,取200 μL浓度为1×106/mL的细胞,使用Fc受体封闭,加入表面荧光抗体,4摄氏度避光孵育30 min后,PBS洗脱2次,洗脱未结合抗体,使用PBS重悬后,使用流式仪进行检测细胞膜表面分子标志。
1.6 MACS分选细胞
使用免疫磁珠MACS分选CD8+T细胞以及CD11b+细胞,于超净台中取荷瘤小鼠脾脏,研磨,过滤,裂解红细胞,经PBS洗涤后,使用MACS分选试剂分别分选CD8+T细胞以及CD11b+细胞,使用流式细胞仪检测分选细胞的纯度,纯度较好,可供使用。
1.7 CD8+T细胞、CD11b+细胞共培养
将分选所的CD8+T细胞、CD11b+细胞1∶1共培养,使用3LL细胞培养上清(10%),在37 ℃和5% CO2中培养48 h。
1.8 统计学分析

2 结果
2.1 肿瘤实质的重量与肿瘤微环境中T细胞的比例呈负相关
构建小鼠皮下荷瘤模型,于第十四天,将小鼠处死,剥取完整的肿瘤组织(图1A)。流式细胞术检测肿瘤微环境中各免疫细胞(图1B),发现肿瘤微环境中存在大量的CD11b+细胞,在免疫细胞中占53.8%左右。此外,T细胞以及其他类型免疫细胞细胞在免疫细胞中所占比例分别为16.4%,29.8%(图1C)。分析发现,肿瘤微环境中CD3+T细胞比例越高,肿瘤体积越小,即肿瘤的重量与肿瘤微环境中T细胞的比例呈负相关(图1D)。
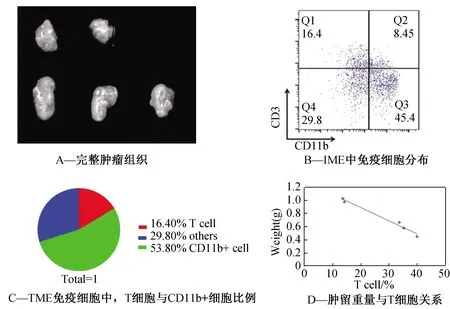
图1 肿瘤的重量与肿瘤微环境中T细胞的比例呈负相关
2.2 肿瘤微环境中CD8+PD-1+T细胞比例增高
取小鼠肿瘤组织,制备成单细胞悬液,检测CD8+T细胞在免疫细胞中所占的比例,CD45是所有免疫细胞共有的标志。经流式检测分析,CD8+T细胞在肿瘤微环境免疫细胞中所占比例为10%左右(图2A)。
与正常小鼠比较,脾脏以及外周血中CD8+PD-1+T细胞比例没有变化(P>0.05);荷瘤小鼠淋巴结中,CD8+PD-1+T细胞比例升高(P<0.05);肿瘤微环境中CD8+PD-1+T细胞比例显著升高(P<0.01),占CD8+T细胞数量的40%左右(图2B、2C)。同时,肿瘤微环境中CD8+T细胞表达其他免疫抑制性受体如TIM-3、LAG-3(图2D)。

t检验,*表示正常组小鼠与荷瘤组小鼠淋巴结中CD8+PD-1+T细胞相比,P<0.05; ##表示荷瘤小鼠肿瘤微环境中CD8+PD-1+T细胞比例与荷瘤小鼠脾脏中CD8+PD-1+T细胞比例相比,P<0.01。图2 肿瘤微环境中CD8+PD-1+T细胞比例增高
2.3 CD11b+细胞诱导CD8+T细胞表PD-1
肿瘤微环境中除肿瘤细胞之外,存在大量CD11b+细胞,我们推测CD11b+细胞可诱导CD8+T细胞表达PD-1。取荷瘤组小鼠脾脏,制备成单细胞悬液,利用磁珠分选分别分选CD8+T细胞以及CD11b+T细胞。
对照组的CD8+T细胞使用肿瘤细胞培养上清处理48 h,实验组将CD8+T细胞与CD11b+共培养,并使用肿瘤细胞培养上清处理48 h。经流式检测分析,CD11b+细胞诱导CD8+T细胞表达PD-1(图3A),与对照组相比,结果具有统计学意义(图3B)。
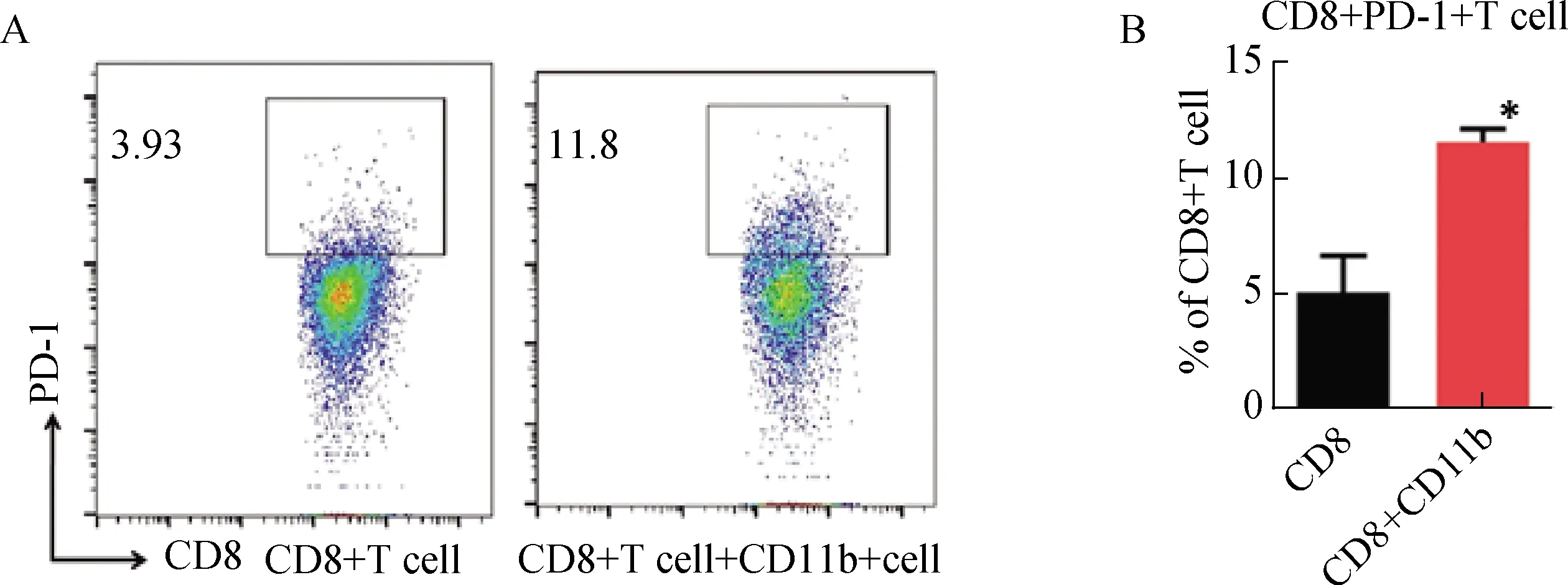
*表示CD8+T细胞纯培养与CD8和CD11b+细胞共培养组相比,P<0.05。图3 CD11b+细胞诱导CD8+T细胞表PD-1
3 讨论
研究发现肿瘤大小与肿瘤微环境中T细胞的比例呈负相关,说明T细胞在抗肿瘤免疫应答中发挥重要作用。T细胞主要分为两大类细胞,CD4+T细胞与CD8+T细胞。其中CD4+Th1细胞通过分泌IFN-γ、TNF-α,介导细胞免疫,抑制CD4+Th2细胞增殖[12],增强CD8+T细胞的杀伤肿瘤细胞的功能。Treg以及CD4+Th2细胞通过分泌抑炎因子在抗肿瘤免疫中发挥免疫抑制作用[10],促进肿瘤逃逸。
CD8+T细胞是抗肿瘤免疫应答中主要细胞,检测发现CD8+T细胞在肿瘤微环境免疫细胞中大约占10%,CD8+T细胞可通过分泌IFN-γ、TNF-α、穿孔素以及颗粒酶等杀伤肿瘤;也可通过表达FasL,与肿瘤细胞表面受体结合,诱导肿瘤细胞凋亡。PD-1即程序性死亡受体,作为T细胞表面免疫抑制性受体,抑制CD8+T细胞发挥抗肿瘤杀伤效应,造成肿瘤细胞逃逸。PD-1与其配体PD-L1结合后,抑制CD8+T细胞活化代谢以及增殖,导致CD8+T细胞杀伤功能受到抑制[13]。CD8+T细胞与CD11b+细胞共培养实验发现,CD11b+细胞可诱导肿瘤微环境中CD8+T细胞表达PD-1。
CD11b+细胞是髓系来源的免疫细胞,在肿瘤微环境中肿瘤相关巨噬细胞占较大的比例。此外,肿瘤微环境中存在少量树突状细胞以及MDSC等。肿瘤相关巨噬细胞抗原提呈能力降低,分泌Th2细胞因子,促进肿瘤血管形成[14]。MDSC通过表达精氨酸酶-1,导致微环境中L-精氨酸缺乏,CD8+T细胞增殖受限;分泌抑炎细胞因子TGF-β、IL-10,表达PD-L1等发挥免疫抑制作用[15]。PD-L1除了广泛表达于髓系来源的免疫细胞表面,还表达于肿瘤细胞表面,进而抑制CD8+T细胞的功能。目前,PD-1/PD-L1单抗可增强CD8+T细胞的功能,在恶性肿瘤的临床治疗方面取得良好的效果。有研究表明,肿瘤细胞PD-L1表达量较高的患者,使用PD-L1单抗治疗效果教好[16]。因而,增强CD8+T细胞功能,抑制肿瘤微环境中发挥免疫抑制作用的免疫细胞的功能[17],对于肿瘤治疗非常重要。其次,揭示肿瘤微环境中各免疫细胞的特性及其相互作用的机制,对于改善肿瘤微环境进而提高机体的抗肿瘤效应具有重要的科学意义。
综上所述,肿瘤微环境CD11b+细胞可通过诱导CD8+T细胞表达免疫抑制受体PD-1,抑制CD8+T细胞发挥抗肿瘤免疫应答。在肿瘤微环境中,CD11b+细胞可能是通过分泌细胞因子或是通过细胞膜表面分子的相互作用诱导CD8+T细胞表达PD-1。因而,可将CD11b+细胞作为肿瘤治疗的靶点,从而为肿瘤免疫治疗提供新思路。

