血清淀粉样蛋白A1对头颈部鳞状癌细胞HN4增殖迁移能力的影响及其机制研究
杨心怡,孙磊,钱峰
(上海交通大学药学院细胞与治疗抗体工程研究中心,上海 200240)
头颈部鳞状细胞癌是全球第六大癌症,每年确认病例超过50万例,有着较高的复发率与转移率;尽管一些治疗方法如手术、放化疗等取得了进展,但多年来患者的生存时间并未得到明显的改善[1]。研究发现淋巴结转移是造成头颈癌生存期短暂的重要因素之一[2]。因此提高对头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)细胞转移机制的认识,有助于发现与开发新的治疗策略。
血清淀粉样蛋白A(serum amyloid A,SAA)是一种急性时相蛋白,主要由肝细胞分泌合成[3]。SAA也在其他组织和细胞中表达和分泌,如肿瘤组织、滑膜组织等[4]。当机体发生炎症、感染等急性时相反应时,SAA在血液中的浓度能够增加约1000倍[5-7]。目前研究已发现SAA在人体中主要有四种亚型,分别为SAA1,SAA2,SAA3和SAA4,其中SAA1在众多疾病中发挥着重要作用,越来越多的研究发现SAA1的升高可能与肿瘤的形成和肿瘤转移密切相关[8]。已有研究表明体内SAA的升高与多种类型肿瘤的预后不良有关,包括胃癌,乳腺癌和HNSCC等,SAA的升高亦可作为这些肿瘤的生物标记物[9-11]。同时也有研究发现SAA在HNSCC患者组织以及血清中表达水平显著升高[12]。这些研究发现提示SAA1的高表达在头颈部鳞状细胞癌的发生发展中可能发挥着重要的作用。
趋化因子受体3(C-X-C chemokine receptor type 3,CXCR3)是一种CXC趋化因子受体,在多种细胞中表达,尤其是单核细胞、自然杀伤细胞和一些癌细胞;CXCR3具有三种亚型 CXCR3A,CXCR3B和CXCR3alt。CXCR3的主要配体是三种干扰素诱导的趋化因子:CXCL9,CXCL10和CXCL11,另外还包括CXCL4。CXCR3A和CXCR3B在肿瘤中发挥着重要作用[13-14]。文献报道,CXCR3A在透明细胞卵巢癌中表达上调,而CXCR3B的表达出现下调[14-15];在前列腺癌中CXCR3A的mRNA表达量升高促进了前列腺癌细胞的增殖与迁移能力[16]。在胃癌细胞和组织中,CXCR3的表达明显升高,并且其高表达与胃癌患者的肿瘤分期,淋巴结转移以及生存期差异相关,CXCR3的激活能够促进基质金属蛋白酶 (matrix metalloproteinase,MMP-2) 和MMP-9的表达,促进胃癌细胞的侵袭和迁移。因此,CXCR3A的表达在多种类型肿瘤中升高,并且与肿瘤的转移侵袭机制相关。同时也有研究发现,头颈部鳞状癌患者外周血单核细胞(Peripheral blood mononuclear cell,PBMC)中CXCR3A及其配体表达的上调能够促进其增殖和迁移[17]。这提示CXCR3A不仅是肿瘤的转移与侵袭机制中的一个重要分子,也在免疫细胞介导的肿瘤细胞杀伤作用中产生重要影响。
本研究中我们以SAA1作为刺激物刺激HNSCC细胞HN4,检测SAA1对于HN4细胞增殖和迁移能力的影响,并探讨其机制。
1 材料与方法
1.1 试剂
DMEM培养基,RPMI-1640培养基,胰蛋白酶和100 × 青霉素/链霉素购买于美国Thermo Fisher 公司;胎牛血清购自杭州天杭生物科技有限公司;抗体 p-p38 MAPK (4511),p38 MAPK (8690),p-Erk (4370),Erk (4695),p-Akt (4060),Akt (4685),β-actin (4970) 购自美国 Cell Signaling Technology公司;逆转录试剂盒、实时荧光定量PCR检测试剂盒购于日本TOYOBO公司。头颈部鳞状癌细胞株HN4,HN30,SCC25,Cal27和HN12购于美国模式菌种保藏中心(American Type Culture Collection,ATCC)。SAA1购买于美国Pepro Tech(派普泰克)公司(纯度:通过SDS-PAGE凝胶和HPLC分析,大于98%)。
1.2 细胞培养
人源头颈部鳞状癌细胞HN4,HN30和HN12所用培养基为含有10%胎牛血清、1%青霉素-链霉素的DMEM培养基;SCC25和Cal27细胞所用培养基为含有10%胎牛血清、1%青霉素-链霉素的RPMI-1640培养基。细胞置于37 ℃,5%二氧化碳培养箱中常规培养。观察细胞状态,在细胞生长至对数生长期时,及时进行传代、接种和冻存。
1.3 MTT实验
精确称量50 mg MTT 粉末至10 mL 无菌PBS中溶解,得5 mg·mL-1MTT;-20 ℃保存。收集对数生长期细胞,调整至1×105个·mL-1,每孔100 μL接种于96孔板中,每组设三个复孔,每孔补加100 μL完全培养基,培养过夜。待细胞达到80%的汇合度,加各浓度的人血清淀粉样蛋白A1孵育24 h后,每孔加20 μL 5 mg·mL-1MTT溶液,继续培养4 h后,1 500 r·min-1,5 min 离心后弃掉上清,每孔加100 μL 二甲基亚砜,将孔板置于水平摇床低速震荡10 min,测定490 nm处的OD值。
1.4 实时荧光定量PCR
Trizol法提取对数生长期细胞样本总RNA,使用Nano-Drop 2 000微量分光光度计进行RNA定量。按照日本TOYOBO公司逆转录试剂盒说明书进行逆转录反应,合成模板cDNA。设置副孔数3个,取平均值,通过分析ΔΔCt值,进行定量计算。以2-ΔΔCt法测定CXCR3的相对表达。CXCR3A引物序列:上游引物:5′ CTGCTGTCCAGTGGGTTT 3′,下游引物:5′ GTTGGCTGATAGGTAGATGAA 3′。
1.5 划痕实验
将状态良好的对数生长期的HN4细胞以4×105/孔接种至6孔板,过夜培养。次日更换新的完全培养基,用200 μL移液器吸头在孔底以无菌直尺为标准划痕,横向三道划痕均分,纵向三道划痕均分,用PBS清洗3次,将划下的细胞吸去,加入无血清培养基,加入不同浓度的SAA1,在37 ℃,5%二氧化碳恒温箱中培养,分别在0、6、12 h取样拍照。使用Image J软件计算图像的划痕面积。计算公式为 划痕愈合率/%=(0 h划痕面积-12 h划痕面积)/0 h划痕面积。
1.6 Western 印迹分析
将状态良好的对数生长期HN4细胞以1×106/孔接种至6孔板,过夜培养,待细胞长满约80%~90%时,在各孔内加入10 μmol·L-1人重组蛋白SAA1,刺激不同时间后收样检测。将培养有细胞的孔板从培养箱中取出置于冰上,用预冷的PBS沿孔板壁轻轻清洗细胞一次,将PBS吸净弃去,加入1×loading buffer后、用细胞刮充分裂解细胞。根据SDS-聚丙烯酰胺凝胶的配制方法配制分离胶和浓缩胶。
电泳:取等量裂解液上清加入已配置好的胶孔中,设置电压为80 V,电泳时间为30 min,30 min后样品压缩至分离胶与浓缩胶交界线,再将电压设置为120 V,电泳至所需条带到达胶板3/4处。转膜:停止电泳后,采用“滤纸-凝胶-膜-滤纸”夹心法,以110 V电压,80 min在冰水浴中将凝胶上的蛋白转移到硝酸纤维素膜(NC)膜上。封闭:转膜结束后,用平头镊夹取膜小心放入有5%牛奶的孵育盒中,在摇床上室温封闭1~2 h。以NC膜上的蛋白为抗原,在4 ℃冰箱中与对应的一抗孵育过夜,用1×TNET buffer以5 min·次-1、5次洗膜,再用辣根过氧化物酶HRP连接的二抗室温孵育结合2 h,用1×TNET buffer以7 min·次-1、3次洗膜。将膜正面朝上平整地放在保鲜膜上,将配好的ECL底物均匀滴在对应的蛋白条带上,进行显色并拍照。
1.7 统计学分析
本研究中,实验数据均为至少3次独立重复实验结果,并用平均值±标准误(mean ± SEM)来表示,用 GraphPad Prim 5 软件进行数据处理和分析,两组间比较采用t检验,P<0.05 则认为结果具有统计学意义。
2 结果
2.1 血清淀粉样蛋白A1对HN4细胞活力的影响
MTT是一种检测细胞存活和生长的方法。如图1所示,与未给予SAA1组相比,给予SAA1组(5 μmol·L-1和10 μmol·L-1)细胞活力明显升高(*P<0.05)。实验结果表明SAA1能够增强HN4细胞活力。
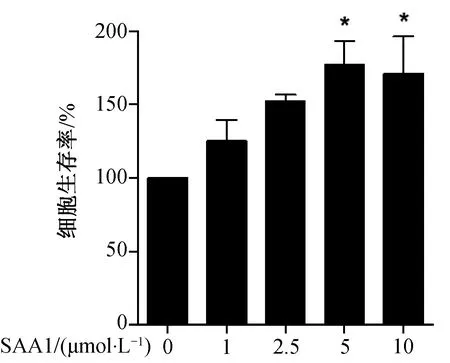
HN4细胞经SAA1刺激24 h后,以SAA1 0 μmol·L-1组为1, 使用MTT法检测细胞活力,*P<0.05,与SAA1 0 μmol·L-1组相比。图1 血清淀粉样蛋白A1对HN4细胞活力的影响
2.2 血清淀粉样蛋白A1对HNSCC细胞HN4迁移能力的影响
划痕实验又称为体外伤口愈合实验,是一种检测细胞迁移运动和修复能力的方法。
根据结果2.1,我们发现高浓度SAA1(5 μmol·L-1和10 μmol·L-1)能够增强HN4的细胞活力。为了排除SAA1对细胞活力的影响,我们选择了低浓度SAA1(1 μmol·L-1和2.5 μmol·L-1)刺激HN4细胞进行划痕实验。图2中,与PBS相比,划痕12 h后,2.5 μmol·L-1SAA1能够促进HN4 (图2A,2B) 细胞划痕的愈合以及细胞的迁移运动,而1 μmol·L-1SAA1对HN4细胞划痕愈合的作用没有显著性差异。
实验结果表明2.5 μmol·L-1SAA1对头颈部鳞状癌细胞HN4的迁移运动有促进作用。
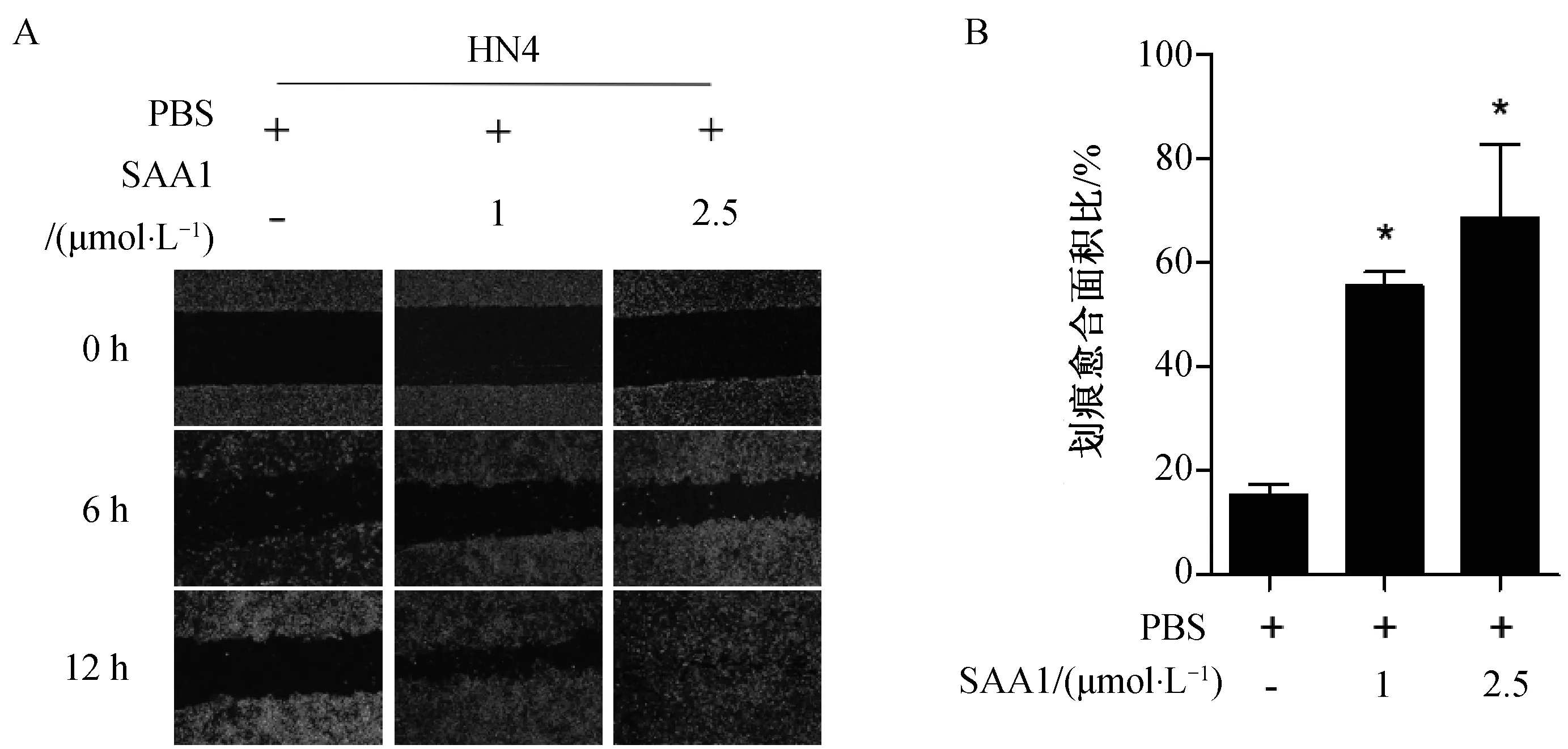
A:SAA1(1 μmol·L-1,2.5 μmol·L-1)刺激HN4细胞12 h后,划痕实验检测SAA对HN4细胞迁移能力的影响; B:SAA1刺激HN4细胞划痕愈合面积比;*P<0.05,**P<0.01,与PBS组相比。图2 人血清淀粉样蛋白A1对头颈部鳞状癌细胞HN4迁移能力的影响
2.3 血清淀粉样蛋白A1对HNSCC各细胞系中CXCR3A的表达量的影响
CXCR3A 是一种对肿瘤具有重要影响的趋化因子受体,主要影响肿瘤的迁移侵袭能力等[18]。为了进一步探究SAA1如何调控HNSCC细胞增殖与迁移能力,我们进一步检测SAA1是否通过影响HNSCC细胞中CXCR3A的表达调控细胞的迁移能力。检测了10 μmol·L-1SAA1刺激HNSCC各细胞系12 h后CXCR3A的变化量,与PBS组相比,发现10 μmol·L-1SAA1刺激12 h后,HN4细胞中CXCR3A的mRNA水平有明显的升高(图3)。
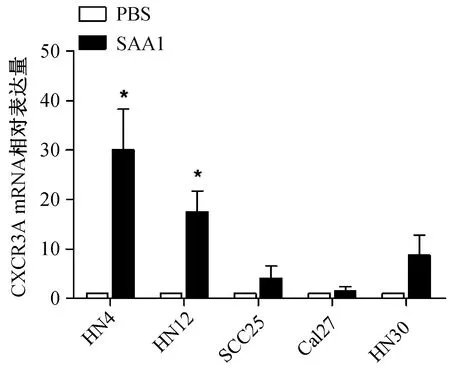
10 μmol·L-1 SAA1 刺激HN4,HN12,SCC25,Cal27,HN30细胞12 h后, 实时荧光定量PCR检测CXCR3A的mRNA表达水平,以各细胞系PBS 组为1计算CXCR3A相对表达量。*P<0.05,与PBS组相比。图3 人血清淀粉样蛋白A1对人头颈癌细胞 各细胞系表达CXCR3A的影响
2.4 SAA1能够激活Erk1/2和p38 MAPK通路
MAPK的活化是调控CXCR3A的一条重要的信号途径[19]。因此我们检测了SAA1刺激HN4细胞后Erk1/2和p38 MAPK的激活水平。同时,我们也检测了Akt信号通路的变化,实验结果表明SAA1刺激能够引起HN4细胞Erk1/2和p38 MAPK磷酸化水平显著性增加,对Akt的磷酸化无显著影响(图4)。
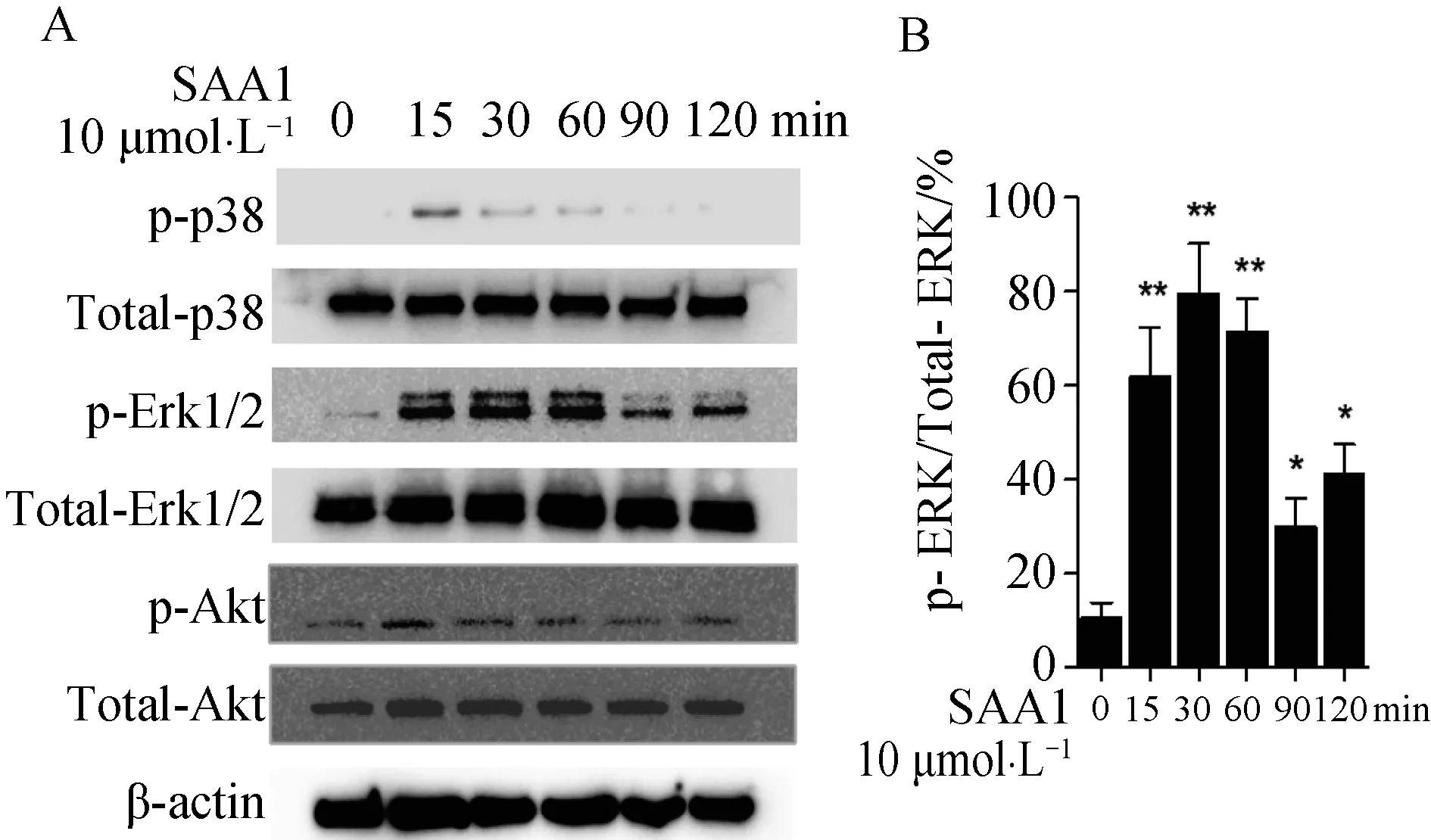
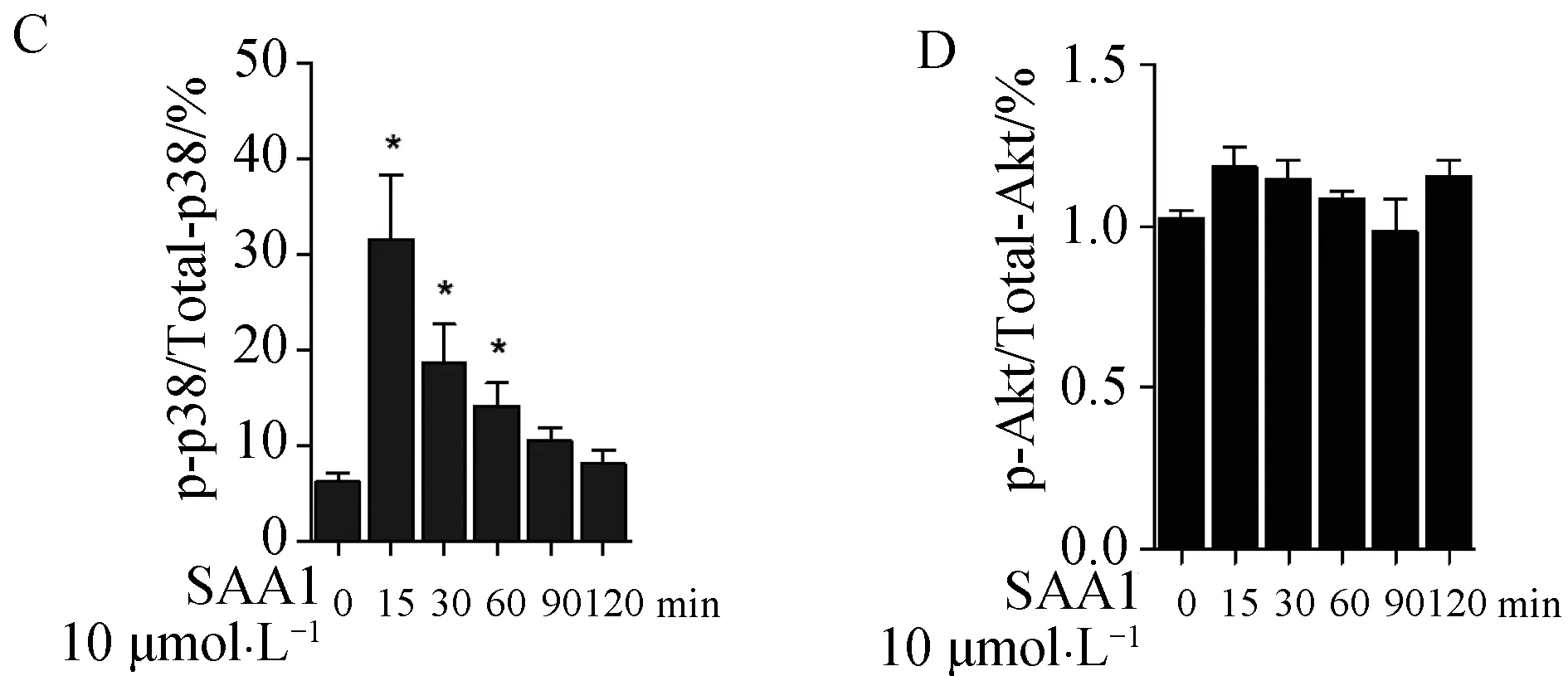
A:10 μmol·L-1 SAA1 刺激HN4细胞不同时间后,western blot检测 p-Erk1/2,p-p38 MAPK的磷酸化水平,以及p-Akt 磷酸化水平; B~D:灰度统计分析;*P<0.05,**P<0.01,与0 min组相比。图4 SAA1能够激活Erk1/2,p38 MAPK通路
3 讨论
血清淀粉样蛋白A作为一种急性时相蛋白,当机体内出现急性时相反应时,其体内浓度会迅速升高[8]。SAA1的分子量为12 kD;与许多蛋白质类似,其前体形式包含一段18个氨基酸的信号肽,这段信号肽在分泌过程中会被信号肽酶剪切,得到长度为104个氨基酸的成熟SAA1蛋白[20]。在本研究中主要探索血清淀粉样蛋白A1在头颈部鳞状癌细胞HN4中的作用。已有研究发现 SAA1的升高与肿瘤如肺鳞癌、食道鳞状细胞癌等的发生率有着较高的相关性,且其浓度随着癌症分期的严重程度增加[9,11,21];SAA1在HNSCC患者血清中的表达水平明显高于正常人,且肿瘤组织中SAA1的表达量也明显高于正常粘膜组织[12]。然而,SAA1高水平的表达对HNSCC肿瘤细胞的影响及其机制尚不明确。本研究主要探讨在多种肿瘤中高水平表达的SAA1对于头颈部鳞状癌细胞HN4的细胞活力和迁移能力的影响。
CXCR3A,也被称为G蛋白偶联受体9(GPR9)或CD183,是一种具有7次跨膜结构域的G蛋白偶联受体,通过特异性结合配体而被激活发挥作用,诱导多种细胞反应。CXCR3A是CXCR3的一个重要的亚型,具有CXCR3的经典功能,包括在IFN-g诱导的免疫反应中的趋化性和细胞增殖等,在肿瘤的形成与发展中发挥着重要作用[13,18]。已有研究发现,CXCR3A在前列腺肿瘤的表达量明显高于正常组织中,且其升高与该肿瘤细胞的增殖迁移能力呈正相关[16]。CXCR3A也被认为是一类具有良好前景的抗肿瘤靶点。SAA是一种具有与细胞因子类似的功能与性质的急性时相蛋白,它能够诱导多种细胞因子或趋化因子的表达[7]。本研究中,我们以
SAA1作为刺激剂,发现SAA1通过诱导HN4细胞表达CXCR3A促进HN4细胞的增殖与迁移。在结果2.3中,SAA1刺激后HN12细胞中CXCR3A的mRNA水平亦出现上调,但HN30细胞中CXCR3A的表达没有明显升高。HN4/HN12和HN30/HN31细胞是来自于口腔癌或咽癌的一系列细胞株,其中原发性HN4细胞的转移性衍生细胞株被命名为HN12,原发性HN30细胞的转移性衍生细胞株被命名为HN31。有研究通过多重荧光原位杂交(M-FISH)和阵列比较基因组杂交技术(array CGH)对头颈部鳞状癌2种不同细胞系(HN4-HN12和HN30-HN31)进行分析,发现HNSCC中基因组的改变,其中HN12和HN30细胞中发现了SIX3和MMP家族基因的过表达,但在HN31和HN4细胞中SIX3基因的表达正常;一种新的抑癌基因WWOX的表达水平在这4种细胞系中亦不同,HN12,HN30和HN31细胞中没有发现WWOX基因的表达[22]。因此,我们CXCR3A在HN30细胞系中的表达差异可能与细胞株中肿瘤发展相关基因表达的倾向有关。
MAPK是一组能够被多种胞外刺激(如细胞因子、细胞应激等)激活的丝氨酸/苏氨酸蛋白激酶。其中Erk和p38 MAPK的激活参与了细胞增殖、分化和凋亡等活动。具有趋化活性和类细胞因子活性的SAA1能够有效诱导Erk1/2,p38 MAPK的磷酸化[23]。SAA1与TLR2、4的相互作用可激活细胞内信使,如 MyD88 和 MAPKs,以及下游包括 NF-κB在内的转录因子,从而刺激一些肿瘤相关细胞因子及其受体的表达[5-7]。本研究中使用Western印迹法检测了SAA1刺激不同时间后MAPKs(包括Erk1/2,p38 MAPK)的表达,结果表明SAA1 能够诱导Erk1/2,p38 MAPK的磷酸化,且在刺激时间为30 min时其磷酸化水平达到峰值。p38 MAPK的激活能够诱导NF-κB和AP-1两个转录因子的活化,这两个转录因子是调控MMP-2和MMP-9基因表达的重要分子[24];Erk-MAPK在细胞的生长分化中具有重要作用,并介导了调控细胞迁移运动的信号通路,活化的Erk通过磷酸化肌球蛋白调节轻链激酶 (myosin light chain kinase,MLCK) 调节膜突起和粘着斑的转化过程,调节细胞迁移运动;Erk的活化同时也与多种细胞基质蛋白的表达密切相关,如纤连蛋白 (Fibronectin),波连蛋白 (Vitronetin)等[25]。Akt被认为是PI3K信号途径中的关键信号转导激酶和下游效应分子,Girdin是Akt信号通路的重要靶标,它能够被Akt磷酸化后激活,诱导MMPs的表达水平和活性;Girdin也能够结合并激活Gαi3进一步激活Akt信号转导途径[26];RAC1是PI3K/Akt/mTOR通路下游的一个重要的靶标分子,调控E-cadherin和Snail的 产生和激活水平,并与它们协同作用介导细胞迁移[27-28]。因此Akt的激活是调节细胞增殖和迁移的重要信号,但在本研究中我们发现SAA1不能激活Akt信号通路。因此,我们推论SAA1主要通过影响MAPK的活化影响CXCR3A的表达。
在本研究中,我们发现SAA1能够诱导CXCR3A的表达且增强头颈部鳞状癌细胞HN4的细胞活力与迁移能力,其作用机制可能与诱导Erk1/2和p38 MAPK活化相关,仍需进一步研究证明。该发现对于SAA1在头颈部鳞状细胞癌的诊断、预后以及治疗中的应用研究提供了新的方向;同时也为寻找头颈部鳞状细胞癌的新型药物作用靶点提供理论依据。

