酒精性脂肪性肝炎差异表达基因的生物信息学分析*
李毅勤,姜 瑶,陶华林△,郭永灿
(1.西南医科大学附属医院检验科,四川泸州 646000;2.西南医科大学附属中医医院检验科,四川泸州 646000)
酒精性肝病是全球慢性肝病的主要疾病之一,其主要包括单纯性脂肪变性、酒精性脂肪性肝炎(ASH)、进行性肝纤维化(通常始于肝小叶的周围区域)、肝硬化和肝癌[1-2]。ASH其病理表现为脂肪变性、肝细胞气球样变性和多形核中性粒细胞炎性浸润共存。虽然,ASH病理改变与非酒精性脂肪性肝炎(NASH)病理改变类似,然而与NASH比较,ASH具有更严重的临床表现和组织学病变[3]。患重度ASH患者1个月病死率可达30%~40%[4]。目前,ASH发生和发展的确切分子机制尚不完全清楚。因此,探索ASH的关键基因及其分子机制,对发现更有效的诊断方法及治疗靶点非常重要。随着计算机技术的普及和发展,高通量平台在医学领域得到广泛应用,微阵列技术和新一代测序分析作为用于基因表达分析的工具,具有巨大的临床价值,目前已普遍应用于突变基因检测、差异基因筛查、肿瘤分型、多态性检测等多个方面[5-6]。本研究通过生物信息学方法,从基因芯片公共数据库(GEO)筛选出ASH相关差异表达基因,并对其进行基因本体论(GO)富集分析和 KEGG通路分析,同时分析其蛋白互作网络结构,以明确差异表达基因的生物学功能,进一步探索与ASH相关的潜在基因和相关分子机制,为ASH的诊疗提供新的靶标。
1 材料与方法
1.1材料 本研究应用2个ASH相关基因芯片数据GSE28619[7]和GSE103580[8]进行整合分析,均从Gene Expression Omnibus(http://www.ncbi.nlm.nih.gov/geo/)数据库下载[9],其中GSE28619的微阵列数据包括15例ASH肝组织标本和7例正常肝组织标本,GSE103580包括13例ASH肝组织标本。
1.2数据处理及差异表达基因分析 将原始数据转换成表达矩阵,随后使用perl软件对2个芯片进行数据合并。使用R软件(版本3.5.3,https:// www.r-project.org/)和Bioconductor软件包(http:// www.bioconductor.org/)进行合并后对数据进行分析,首先使用R软件中sva包中Combat功能对数据进行批次校正。随后使用R软件中limma包筛选ASH肝组织和正常肝组织间的差异表达基因。P值及其余参数计算采用经验性贝叶斯方法。其中|log2FoldChange|>1.2且adjustedP<0.05为差异有统计学意义。
1.3差异表达基因的功能富集分析 在线分析软件DAVID数据库(david.abcc.ncifcrf.gov/knowledgebase)是为研究人员提供的一套全面的功能注释工具。本研究使用DAVID工具对差异表达基因进行GO富集分析(包括生物过程、细胞成分和分子功能类别)。应用R软件中Clusterprofiler包对差异表达基因进行京都基因和基因组百科全书(KEGG)途径富集分析,以明确其生物学功能及参与的信号调控网络。选择P<0.05为功能富集分析差异有统计学意义。
1.4差异表达基因编码蛋白的相互作用分析 蛋白质相互作用关系数据库(STRING)是最大的蛋白质数据库之一,通过STRING分析工具,可以预测蛋白质之间的关系并可视化,找出关键蛋白质。MIRYALA等[10]作为一种生物图形可视化工具,主要用于生物网络的研究与设计,如基因表达调控网络及蛋白互作网络等。利用STRING评估差异表达基因之间的相互作用关系,再使用Cytoscape软件构建蛋白质-蛋白质相互作用(PPI)网络图,利用Cytoscape软件中插件CytoHubba,综合12种拓扑分析方法的得分排序筛选出分数最高的前3个作为核心基因。最后再次使用DAVID数据库对PPI网络中包含的基因进行GO功能富集分析。
2 结 果
2.1ASH差异表达基因的筛选 对数据集GSE28619和GSE103580进行联合分析,筛选ASH患者与正常对照组间的差异表达基因,共筛选出28个差异表达基因,见表1。与对照组比较,ASH组中共21个上调基因,7个下调基因。

表1 数据集GSE28619和GSE103580的28个差异表达基因
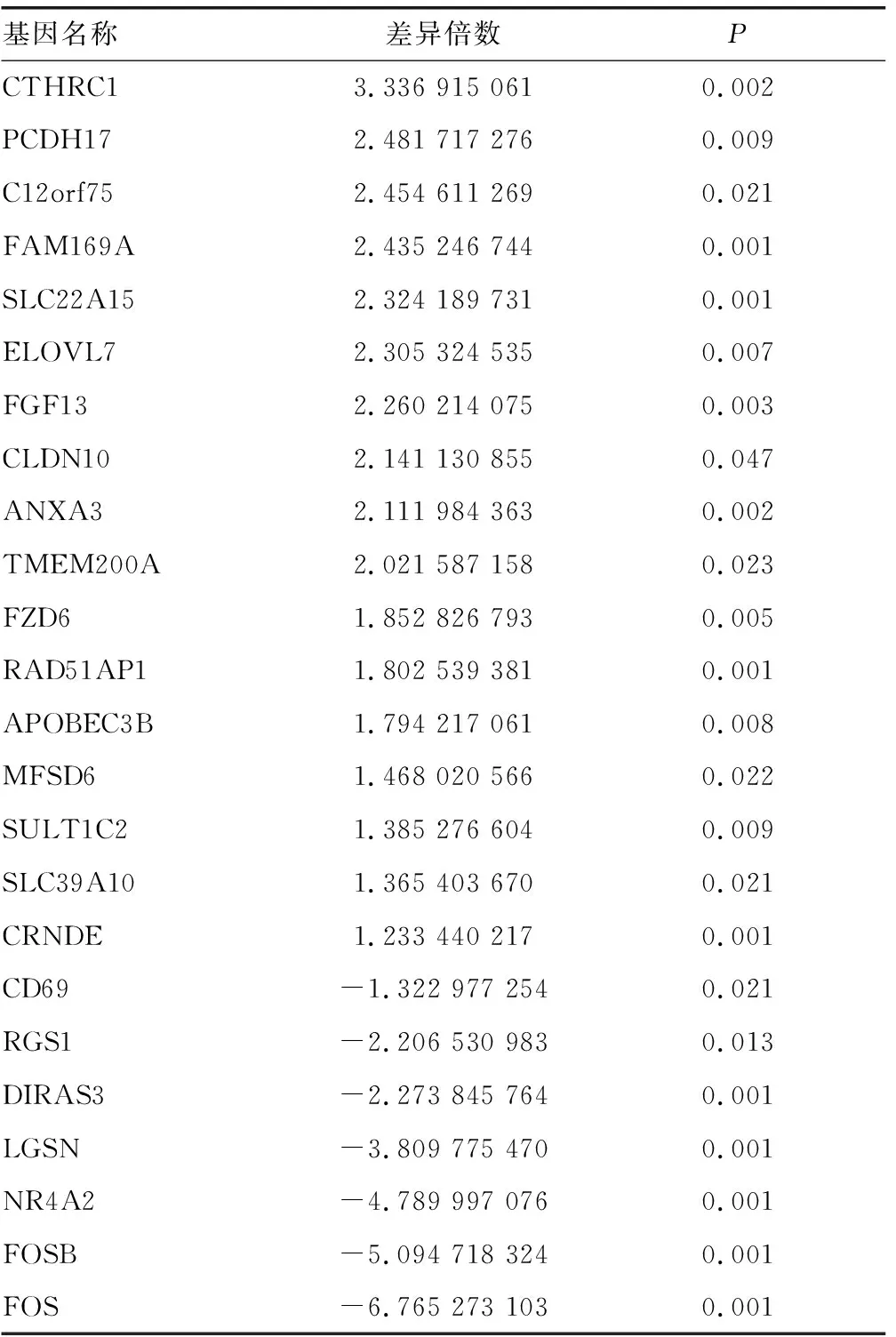
续表1 数据集GSE28619和GSE103580的28个差异表达基因
2.2ASH差异表达基因的GO富集分析和KEGG通路分析 利用DAVID软件对28个差异表达基因进行GO富集分析见表2。GO富集分析结果表明,在生物过程方面,差异表达基因参与了细胞对细胞外刺激的反应及对皮质醇的反应。分子功能方面参与Wnt蛋白结合、转录因子活性、转录激活因子活性及RNA聚合酶Ⅱ核心启动子近端区序列特异性结合等功能。应用R软件中Clusterprofiler包对差异表达基因进行KEGG通路分析发现,差异表达基因仅富集在唯一一个通路——白细胞介素-17(IL-17)信号通路上。
2.3差异表达基因PPI分析 通过STRING在线数据库评估28个差异表达基因间相互作用关系,再应用Cytoscape构建蛋白互作网络分析图,见图1。利用Cytoscape中插件CytoHubba筛选出核心基因为FOS、CCL20及NR4A2,见图2。对PPI网络中的节点进一步进行GO富集分析发现,差异表达基因的功能最主要富集在信号转导上。

图1 差异表达基因的PPI网络

图2 核心基因的相互作用网络

表2 差异表达基因的GO富集分析
3 讨 论
ASH是一种严重的临床综合征,主要表现为黄疸、肝大和腹痛[11]。由于对ASH肝脏炎症的病理生理学仍未完全了解,治疗方案受限,患者往往预后较差。因此,了解ASH进展的分子机制对其诊断和治疗至关重要。目前,对于ASH大多数研究都是单个队列研究,较少有多个队列研究。而多个队列研究往往比单一队列研究具有更低的假阳性率和假阴性率[12],因此,本研究从GEO数据库下载2个芯片数据集进行研究,分别为GSE28619和GSE103580,由于GSE 103580未做对照组的基因芯片[8],其对照组数据主要参考GSE28619对照组芯片数据进行分析。因此,可直接对GSE28619中15个ASH、7个对照组芯片数据及GSE103580中13个ASH芯片数据进行合并数据分析。由于不同芯片数据会存在批次效应,故使用R软件sva包中的Combat功能来消除本研究中的批次效应[13],以此提高差异表达基因鉴定的可信度。对两组芯片进行联合分析,共筛选出28个差异表达基因,包括21个上调基因和7个下调基因。为了解差异表达基因的生物学意义,本研究对其进行了GO富集分析和KEGG通路分析。GO富集分析发现,差异表达基因参与了对皮质醇反应、Wnt蛋白活性、细胞对细胞外刺激的反应、转录因子活性、转录激活因子活性及RNA聚合酶Ⅱ核心启动子近端区序列特异性结合等功能。由于R软件中Clusterprofiler对数据的更新速度比DAVID数据库更快,为得到最新的通路分析结果,因此,采用R软件中的Clusterprofiler进行KEGG通路分析,最后得到一个富集通路,即差异表达基因富集在唯一通路——IL-17信号通路上。
IL-17是一个重要的促炎症细胞因子,可靶向不同细胞类型以诱导多种促炎介质,同时也参与自身免疫、慢性炎症性疾病、纤维化和肿瘤的发展等过程[14-15],其可以介导炎症细胞依赖性T细胞受体、粒细胞分化抗原-1及活性氧产生相关氧化酶,从而介导炎症发生[16]。目前已发现,IL-17可通过巨噬细胞的极化调控脂肪性肝病炎症发生,加剧并加快肝细胞的损伤,推动脂肪变性到脂肪性肝炎的进展[17]。因此,推测IL-17信号通路可能为促进ASH炎性病变过程中的一条重要通路,靶向调控IL-17信号通路有望成为ASH治疗的新靶点,但尚未找到具体作用于IL-17通路的关键基因。随后对差异表达基因进行PPI分析,找到CCL20、FOS及NR4A2 3个核心基因,与对照组比较,CCL20在ASH中上调,FOS、NR4A2表现为下调。KEGG通路分析发现,CCL20及FOS均富集在IL-17信号通路上,猜想其可能通过作用于IL-17信号通路介导ASH炎症的发生和发展。
CCL20是趋化因子家族中的重要成员,是肝脏中重要的促炎和促纤维化的趋化因子。CCL20表达水平可随肝脏组织学(正常<脂肪变性<炎症<纤维化)变化的严重程度而逐渐上升,目前已被证实是病毒性肝炎、酒精性脂肪肝、非酒精性脂肪肝等肝损伤共同途径中的重要调控分子[18]。AFFO等[19]研究发现,CCL20是ASH中最上调的趋化因子,并且在ASH患者的肝脏及血清水平高于NASH、丙型肝炎等其他肝脏疾病,这与本研究结果大致一致,本研究分析得到CCL20在ASH中高度表达。BERINGER等[20]研究发现,IL-17介导的肝脏炎症主要是通过诱导吸引中性粒细胞的趋化因子,使中性粒细胞发生局部募集而促进肝脏炎症发生,而CCL20就是其中一个被IL-17诱导的趋化因子。AFFO等[21]研究也证实,CCL20可通过促进巨噬细胞和中性粒细胞的肝脏浸润介导肝损伤后炎症细胞募集。上述研究均表明,CCL20在肝脏炎症发生过程中扮演着重要角色,且与IL-17相关。因此猜想,IL-17信号通路在CCL20介导ASH的形成过程中起重要作用。CCL20通过作用于IL-17信号通路,被诱导激活后促进巨噬细胞、中性粒细胞等炎症细胞的募集,从而介导ASH炎症发生。
目前,对于NR4A2和FOS在肝脏代谢疾病方面的研究较少,缺乏足够的文献支持。NR4A2也称为Nurr1,是孤儿核受体NR4A家族的成员,并且充当转录因子,主要分布在调节分化、增殖和凋亡细胞中,已知其是维持肝葡萄糖稳态及脂质代谢的关键转录调节因子,其可调节肝脏脂质平衡及脂肪生成[22],猜想其可能参与ASH形成过程中的脂质代谢。FOS蛋白的前体C-FOS基因属于原癌基因[23]。单独FOS没有功能,主要是和Jun家族成员形成异源二聚体组成激活蛋白1转录因子,从而参与细胞的增殖、分化及凋亡,以及肿瘤中细胞转化、浸润性生长及远端转移等过程[24]。目前,对于C-FOS的研究主要集中在肿瘤生长、转移、预后方面及神经系统方面对神经元的可塑性及阵痛作用[25-26]。对于NR4A2和FOS在ASH形成过程中的具体机制尚不清楚,仍有待更多的体内、体外试验进行验证。
4 结 论
本研究发现,IL-17这一关键信号通路及3个核心基因(CCL20、FOS和NR4A2)可能在ASH的发生和发展中起重要作用,其中CCL20可能通过作用在IL-17信号通路,被诱导激活后促进巨噬细胞、中性粒细胞等炎症细胞的募集,从而介导ASH的炎症发生,为进一步了解ASH的分子机制提供了新思路。靶向调控IL-17信号通路有望成为ASH治疗的新型疗法,但仍需后期试验来验证这种预测结果,充分了解以上基因在ASH作用中的机制。

