血清抗JO-1抗体检测的回顾性分析与临床价值探讨*
廖云凤,何一帆,唐翌姝,夏 云,史 静
(重庆医科大学附属第一医院检验科,重庆 400016)
抗JO-1抗体又称抗组氨酰tRNA合成酶(HRS)抗体,1980年NISHIKAI等[1]从1例叫JOHN的多发性肌炎(PM)患者血清中发现抗JO-1抗体,由此命名为抗JO-1抗体[1]。有研究表明,抗JO-1抗体主要参与PM/皮肌炎(DM)整个疾病免疫病理过程的发生与发展[2]。抗JO-1抗体的产生是特异性的、抗原驱动的过程,而不是肌肉损伤的伴随现象[3]。由于抗JO-1抗体阳性患者常出现发热、关节炎、雷诺现象、技工手及间质性肺炎(ILD)等,临床上将这类患者统称为抗合成酶综合征(ASS)。由于患者临床表现的多样化,临床医生对疾病的诊断难度大大增加。关于抗JO-1抗体与疾病的相关性,国外相关报道的研究对象主要是欧美人群,目前对于抗JO-1抗体相关性疾病的联合检测诊断指标也不明确。本研究主要通过回顾性资料分析,探讨中国西部地区人群抗JO-1抗体阳性在临床疾病诊断中的价值,同时研究该抗体在联合其他自身抗体及实验室免疫生化检测指标时,是否有助于临床对疾病做出快速准确的诊断,避免误诊及漏诊。
1 资料与方法
1.1一般资料 选取2016-2018年在本院进行抗核抗体(ANA)和抗可溶性抗原(ENA)抗体谱检测的26 402例患者作为研究对象,筛选出抗JO-1抗体阳性患者111例作为抗JO-1抗体(+)组,选取400例抗JO-1抗体阴性患者作为抗JO-1抗体(-)组。就两组患者的基本信息、疾病诊断、ANA核型与滴度、其他相关自身抗体条带阳性比例及白细胞计数(WBC)、红细胞计数(RBC)、血小板计数(PLT)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、血清尿酸(UA)、血清肌酐(Cr)、肌酸激酶(CK)、肌红蛋白(MYO)、B型利钠肽(BNP)、C反应蛋白(CRP)、补体C3、补体C4、IgA、IgG、IgM等检测结果进行统计分析。
1.2检测方法 ANA采用间接免疫荧光法,抗ENA抗体谱分析采用蛋白质免疫印迹法,试剂均由德国欧蒙医学实验诊断有限公司生产;血常规采用Sysmex XE-2100全血细胞分析仪检测;IgG、IgA、IgM、补体C3、补体C4采用速率散射浊度法,由IMMAGE800特种蛋白分析仪检测;肝肾功能及心肌损伤标志物均采用Roche cobas e602全自动生化分析仪及配套试剂进行检测。
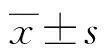
2 结 果
2.1抗JO-1抗体阳性患者性别及年龄情况 2016-2018年在本院进行ENA谱检测的共有26 402例,阳性指标共11 787例,抗JO-1抗体结果为阳性的患者共111例,占0.94%,见表1。其中男40例,女71例,男女比例为1∶1.78,抗JO-1抗体(-)与抗JO-1抗体(+)之间男女比例差异无统计学意义(P>0.05),见表2。患者年龄23~96岁,平均55岁,抗JO-1抗体(-)组年龄49(32,64)岁,抗JO-1抗体(+)组55(47,68)岁,两组年龄差异有统计学意义(P<0.01);ANA(+)抗JO-1抗体(+)组年龄55(49,66)岁,ANA(-)抗JO-1抗体(+)组年龄55(45,70)岁,两组年龄差异无统计学意义(P=0.894)。
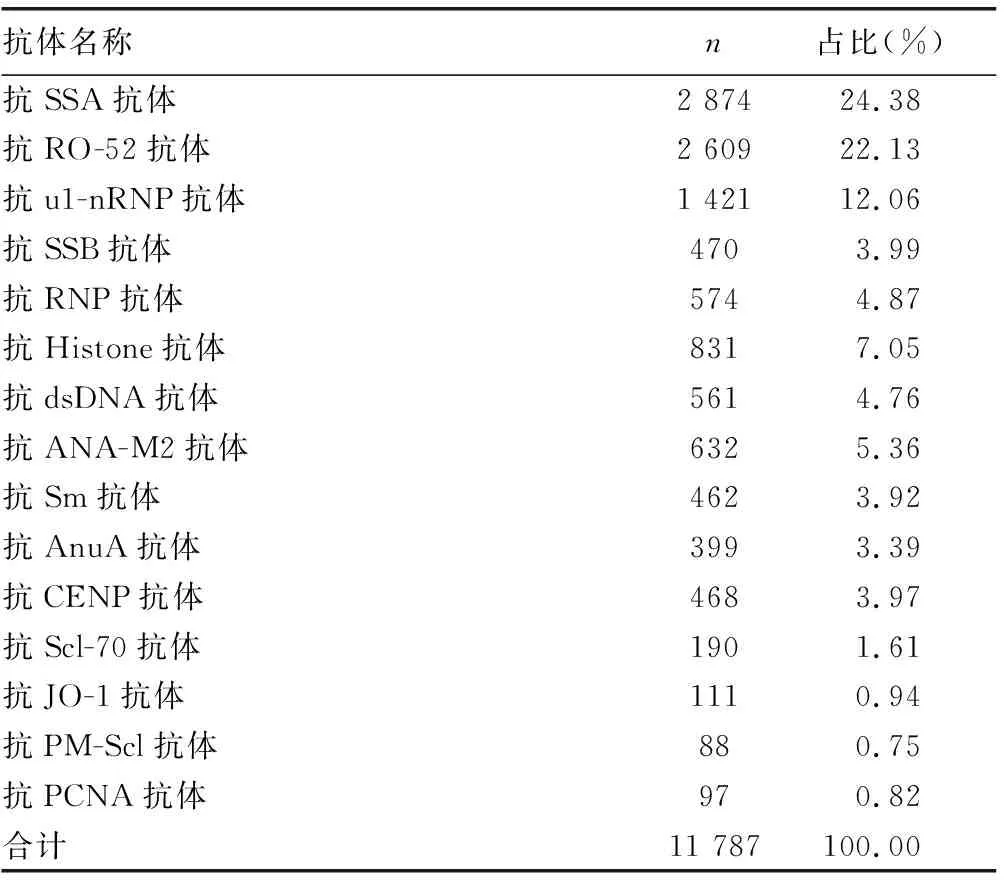
表1 2016-2018年ANA谱各项目检测阳性分布情况

表2 抗JO-1抗体与患者性别的关系[n(%)]
2.2抗JO-1抗体与相关临床诊断的关系 111例抗JO-1抗体阳性患者中诊断最多病例为ILD,占31.53%,其次为PM/DM,占13.51%,ASS与肺部感染比例相同,均为11.71%,与抗JO-1抗体(-)组比较,差异有统计学意义(P<0.05),见表3。56例单独抗JO-1抗体阳性患者的疾病构成诊断中,ILD占17.86%,肺部感染占16.07%,PM/DM、ASS均占7.14%,与抗JO-1抗体(-)组比较,差异有统计学意义(P<0.05),见表4。
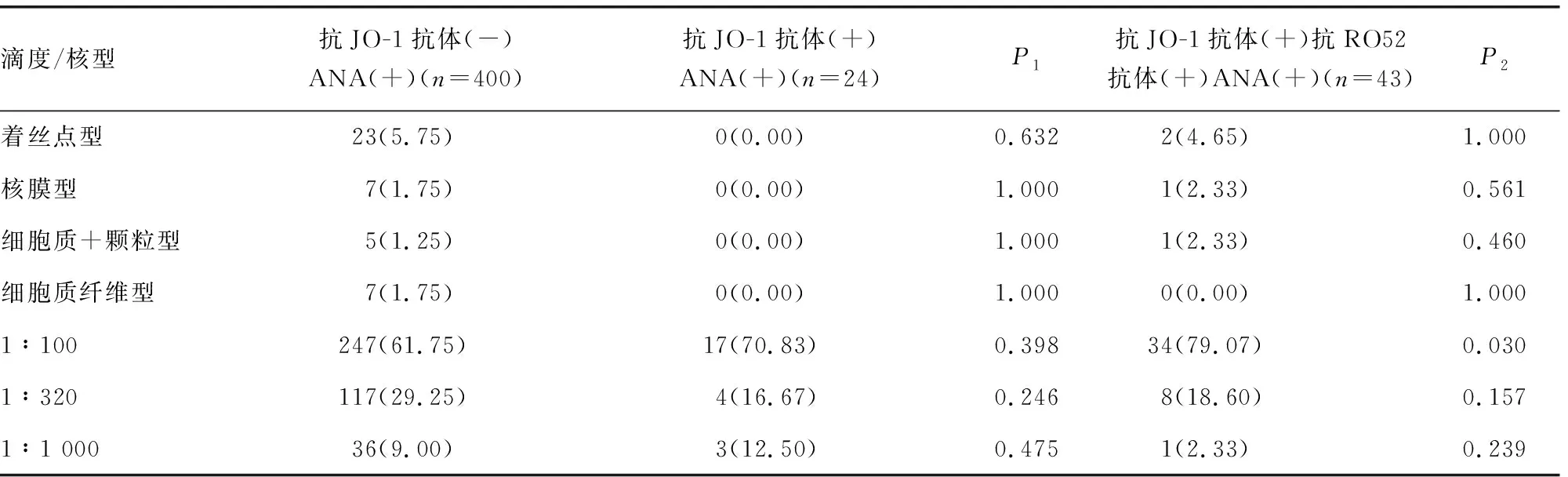
2.3抗JO-1抗体与ANA核型和滴度的关系 为避免其他ENA抗体ANA核型的干扰,在111例抗JO-1抗体阳性患者中选取单独抗JO-1抗体(+) ANA(+)(24例)进行ANA核型和滴度分析,同时选取抗JO-1抗体(-)ANA(+)、抗JO-1抗体(+)RO52(+)ANA(+)进行对照分析,结果显示,单独抗JO-1抗体(+),ANA核型以细胞质颗粒型为主,差异有统计学意义(P<0.05),但ANA滴度差异无统计学意义(P>0.05),见表5。其他核型例数<5,因数据太少,差异无统计学意义,将其删除。其他核型包括:高尔基体型、高尔基体型+颗粒型、纺锤体+颗粒型、肌动蛋白型、抗染色体相关抗原型、线粒体型、颗粒+核膜型、颗粒+核仁型、着丝点+细胞质型、着丝点+胆管型、细胞质+核仁型、着丝点+颗粒型、细胞质+均质型、细胞质棒状型、核点型、纺锤体型。

表3 抗JO-1抗体阳性患者的疾病构成[n(%)]
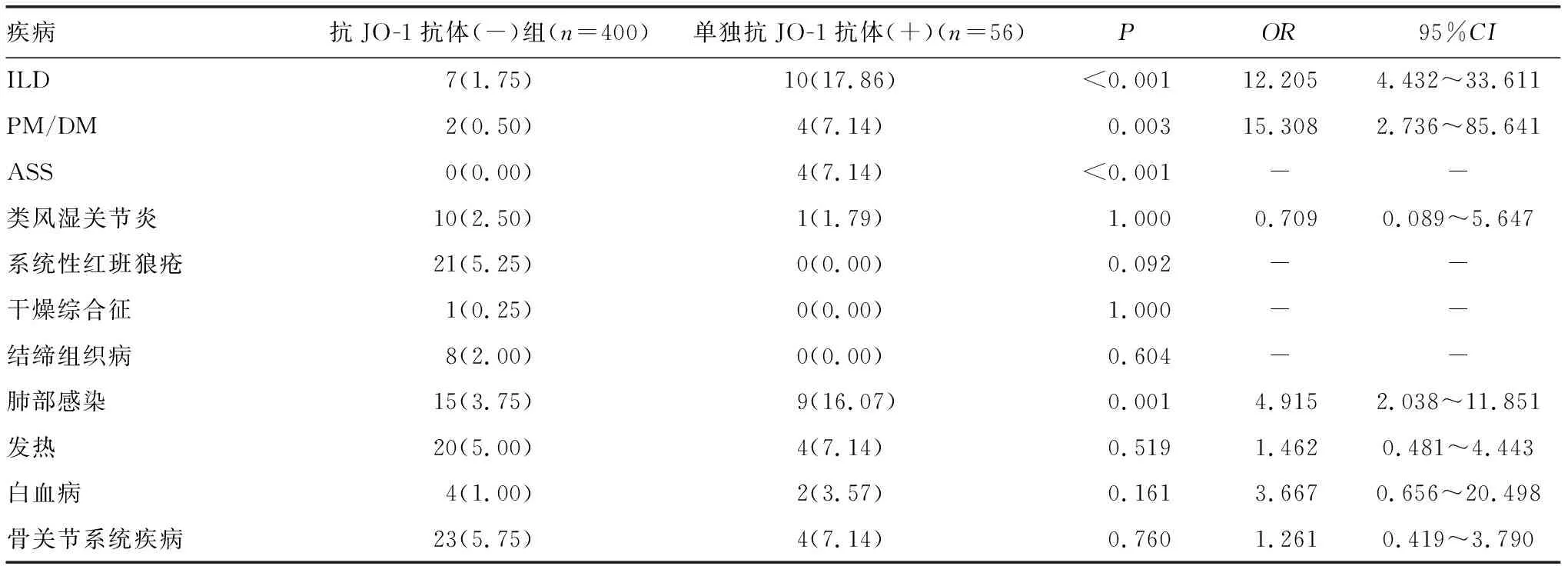
表4 单独抗JO-1抗体阳性患者的疾病构成[n(%)]

表5 抗JO-1抗体(+)患者ANA核型与滴度的关系[n(%)]
续表5 抗JO-1抗体(+)患者ANA核型与滴度的关系[n(%)]
2.4抗JO-1抗体与ENA谱中其他自身抗体的关系 对111例抗JO-1抗体阳性患者ENA结果进行统计,与抗JO-1抗体(-)组比较,JO-1抗体阳性患者ENA谱中阳性比例最高的是抗RO-52抗体,占43.24%,差异有统计学意义(P<0.05),见表6。
2.5抗JO-1抗体与其他自身抗体阳性时的灰度值与疾病的相关性 抗JO-1抗体阳性患者分别诊断为ILD、PM/DM与ASS时,抗JO-1抗体、抗RO-52抗体、抗SSA抗体阳性的灰度值均高于临界值,但各组间结果比较,差异均无统计学意义(P>0.05),见表7。
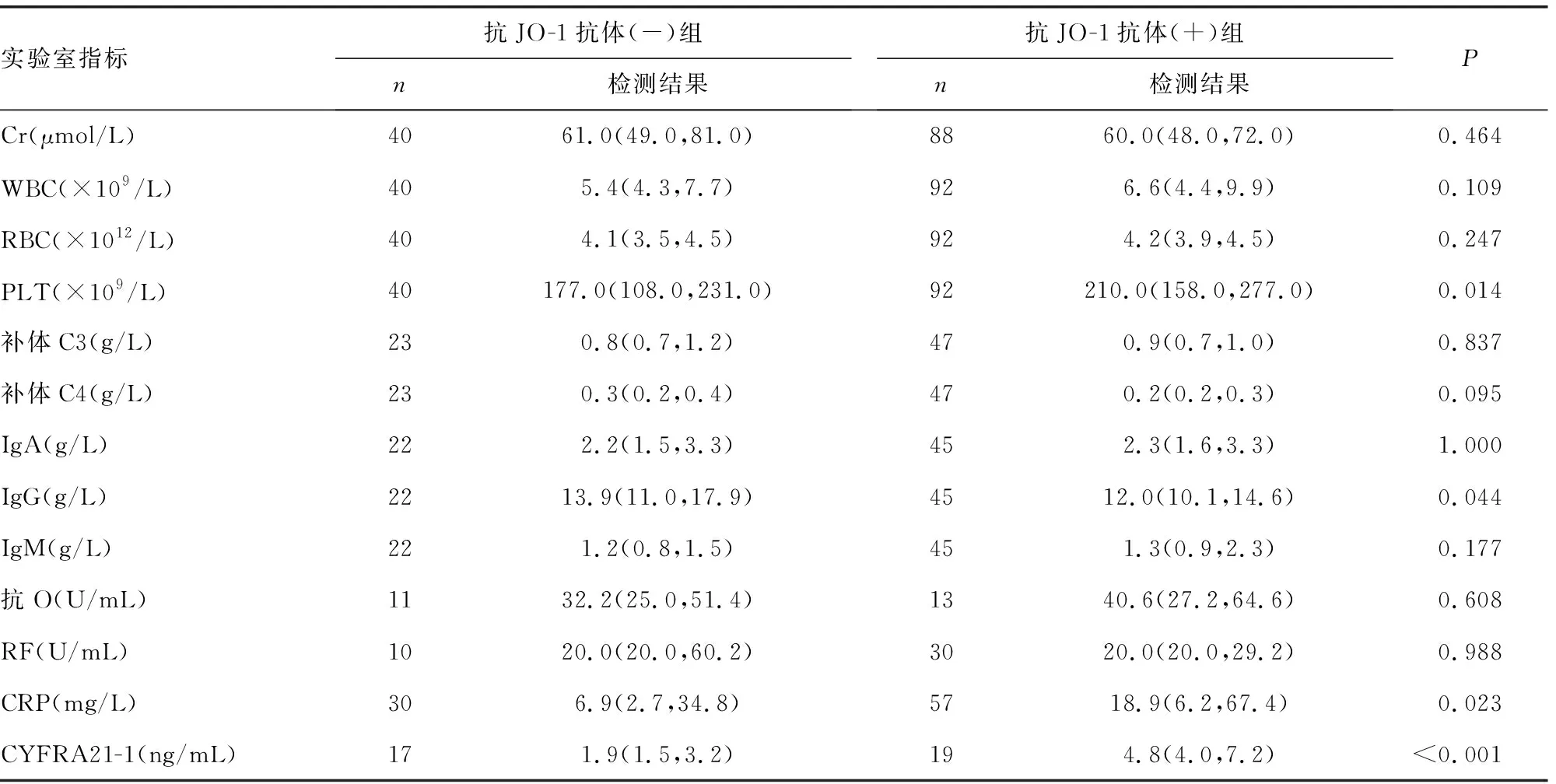
2.6抗JO-1抗体与相关实验室检测结果的关系 抗JO-1抗体(+)组CK中位数为2.6(1.0,85.5) U/L,PLT为210.0(158.0,277.0)×109/L,CRP为18.9(6.2,67.4)mg/L,细胞角蛋白19片段抗原(CYFRA21-1)为4.8(4.0,7.2)ng/mL,均明显高于抗JO-1抗体(-)组,差异均有统计学意义(P<0.05)。但IgG为12.0(10.1,14.6)g/L,低于抗JO-1抗体(-)组,差异有统计学意义(P<0.05),见表8。
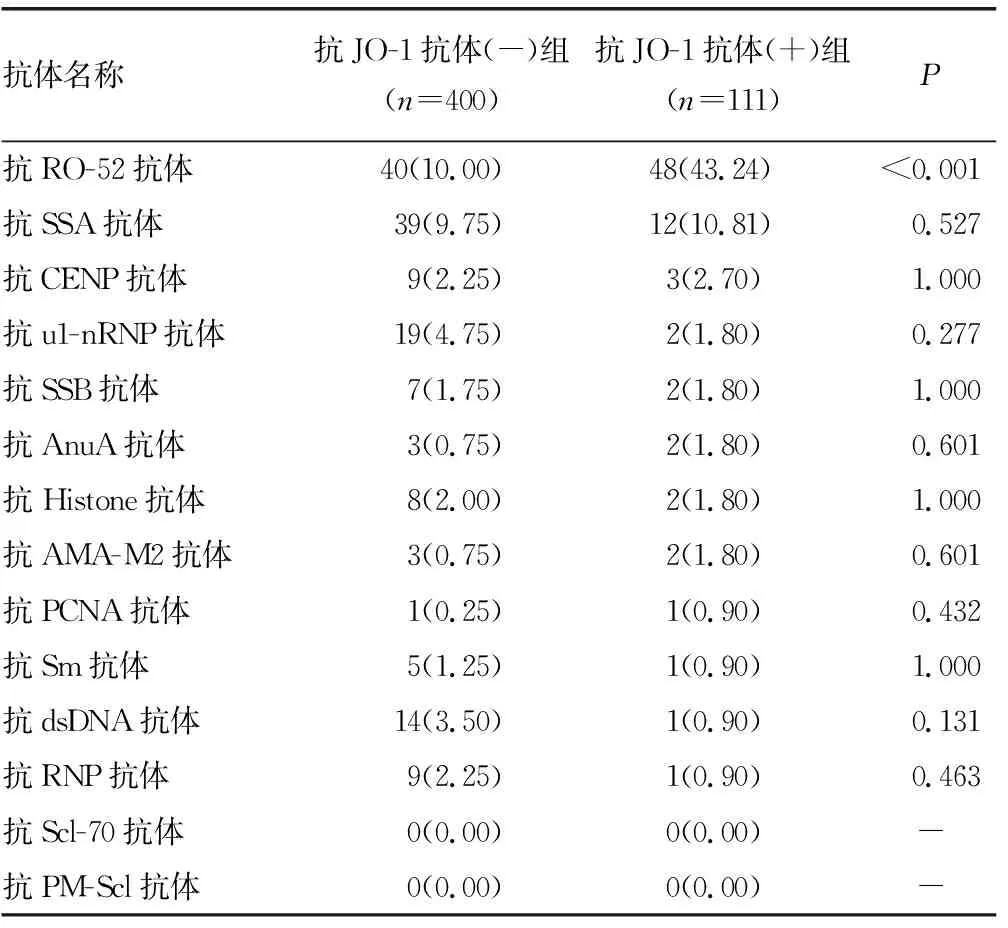
表6 抗JO-1抗体(+)患者ENA阳性率[n(%)]

表7 抗JO-1抗体(+)患者ENA(+)抗体灰度值与相关疾病的关系
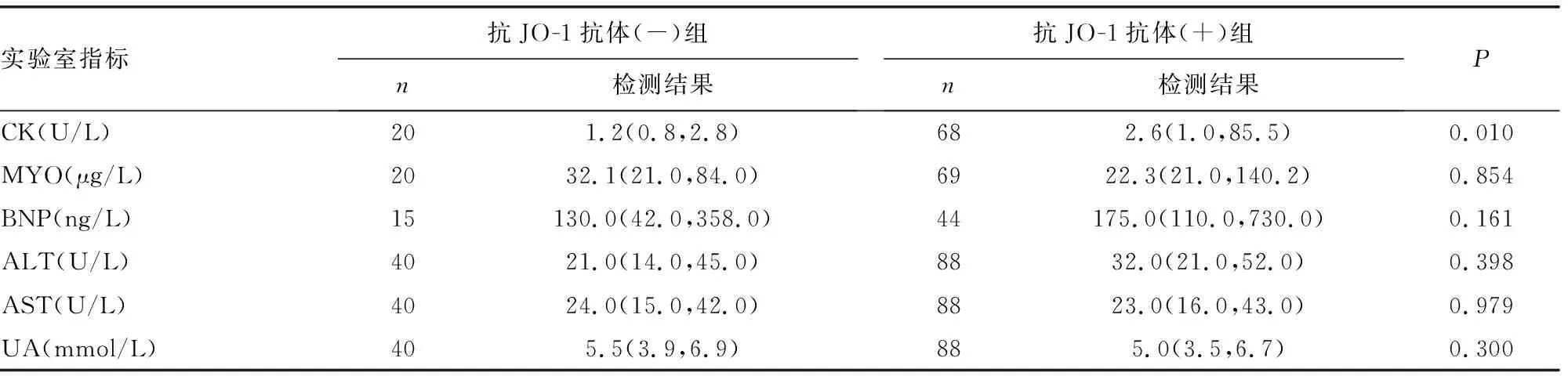
表8 抗JO-1抗体(+)患者相关实验室指标检测结果的关系[M(P25,P75)]
续表8 抗JO-1抗体(+)患者相关实验室指标检测结果的关系[M(P25,P75)]
3 讨 论
本研究通过回顾性分析111例抗JO-1抗体阳性患者病例数据发现,抗JO-1抗体阳性患者女性比例高于男性,平均年龄55(47,68)岁,高于抗JO-1抗体(-)组,均与自身免疫性疾病的特征相符合。有报道显示,抗JO-1抗体阳性的检出率有随着年龄增加而增加的趋势,其研究的主要检出年龄为61~90岁,占65.63%[4]。本研究中61~90岁仅检出43例,占38.74%,而主要检出年龄为41~70岁,占72.97%。同时,60岁之前,抗JO-1抗体阳性的检出率有增加趋势,60岁之后,检出率逐渐降低,这可能与患者地域差异有一定关系。
有研究表明,抗JO-1抗体是PM的特异性抗体,其阳性表达常提示有脏器损害,可能导致患者病死率增加,以及疾病预后不理想[5-6]。抗JO-1抗体在肺泡上皮细胞存在高表达,通过针对JO-1的自身免疫对肺造成的免疫损伤,其阳性患者的临床表现中,呼吸系统损害率高达96%[7];另有学者曾报道,抗JO-1抗体阳性的DM患者ILD的发生率可高达50%~75%[8],而ILD又是ASS最常见的症状之一,由此可见,抗JO-1抗体与肺损害的关系十分密切。本研究同样证实了这一点,在抗JO-1抗体阳性病例中,与肺损害密切相关的4种疾病(包括ILD、PM/DM、ASS及肺部感染)总和高达76%,且无论是总的抗JO-1抗体阳性还是单独抗JO-1抗体阳性分别与抗JO-1抗体(-)组比较,差异均有统计学意义(P<0.05)。
值得注意的是,PM/DM的诊断率只有13.51%,不足ILD的1/2;而ASS占11.71%,比例稍低;发热、关节炎/关节痛占疾病诊断总和的6.3%。许多学者将ASS作为PM/DM合并ILD的重要预测因素,其中发热、关节炎/关节痛更是被当作PM/DM的预测指标及预后判断因素[9-10]。吴秀琳等[11]研究表明,抗JO-1抗体与PM/DM合并ILD密切相关,其阳性患者中呼吸道症状首发者高达52.8%,多关节炎达33.3%,而PM仅占11.1%,且前二者比PM症状早出现,时间最长可达2~5年,因此,不排除疾病漏诊和误诊的可能。另外,以肺部感染为主要诊断的病例达11.71%~16.07%,且无论是总的抗JO-1抗体阳性还是单独抗JO-1抗体阳性分别与抗JO-1抗体(-)组比较,差异均有统计学意义(P<0.05),究其原因可能是随着疾病的深入研究,更多的药物得到应用,这虽然有助于延长患者的生存期限,但不可避免地会损伤宿主的防御和免疫功能,从而导致更多合并症,感染就是其中最常见的合并症之一。因此,如何合理运用药物,如何在控制疾病发生、发展的同时,尽量减少患者的免疫损伤及减少感染发生,成为目前亟待研究和解决的重要问题,需要临床医生引起高度重视。
对于JO-1在细胞内的分布,比较一致的观点是其主要存在于细胞质中。KAMEI[12]曾利用绿色荧光标记蛋白研究JO-1在细胞中的确切定位,发现JO-1可以以单独或弥散的形式存在于几乎所有细胞的细胞质中;同时还发现细胞核内或周围有一些小的斑点样物质,推测是JO-1在核膜上凹陷所致。本研究对111例抗JO-1抗体阳性患者均进行了ANA检测,分析发现,无论是单独抗JO-1抗体阳性还是抗JO-1抗体合并抗RO-52抗体阳性,ANA核型均以细胞质颗粒型为主,与抗JO-1抗体(-)组比较,差异有统计学意义(P<0.05)。另外,ANA为阴性的患者高达39.6%,需引起大家的高度重视。至于为何会出现ANA阴性而ENA阳性的情况,学者们的研究大致分为以下两种观点:一是由于疾病在初期或者在发展过程中得到缓解,导致ANA水平不足,未能检出;二是方法学因素,由于ANA的抗体类型主要是IgG、IgE及IgD,而ANA检测时采用的二抗均为IgG,从而使ANA阳性率降低[13-14]。无论是以上哪种情况,均会导致疾病在诊疗过程中出现漏诊和误诊,因此,建议临床医生在怀疑患者是自身免疫性疾病时,尤其是中老年女性患者,应同时检测ANA和ENA,争取及早发现病因,以免延误治疗。
本研究对111例抗JO-1抗体阳性患者进行ENA分析发现,抗JO-1抗体合并抗RO-52抗体阳性率达43.24%,其次是抗SSA抗体,达10.81%,与抗JO-1抗体(-)组比较,前者差异有统计学意义(P<0.05)。覃仕锋等[15]指出,抗RO-52抗体在PM/DM的诊断中具有非常高的诊断价值;也有研究显示,DM患者抗RO-52抗体和抗JO-1抗体阳性提示并发ILD、心脏损害、恶性肿瘤及高病死率[16];本研究中ILD比例最高,不排除存在DM漏诊情况;本研究比较了患者分别诊断为ILD、PM/DM和ASS时抗JO-1抗体和抗RO-52抗体阳性的灰度值,结果显示3种疾病之间的灰度值差异无统计学意义(P>0.05),但诊断为ILD时,抗JO-1抗体和抗RO-52抗体的灰度值与其他两种疾病比较均较高,值得关注。另有文献指出,抗RO-52抗体在系统性红斑狼疮(SLE)中出现的时间比其他自身抗体(如抗dsDNA抗体、抗Sm抗体等)早3~4年[17],结合本研究的抗JO-1抗体阳性与疾病的关系及抗RO-52抗体的高阳性率分析表明,同时检测抗JO-1抗体和抗RO-52抗体,可作为PM/DM、ILD及SLE的辅助诊断指标,对于疾病的早期诊断及鉴别诊断具有重要意义。
CK主要存在于骨骼肌、心肌和大脑组织中,绝大多数CK位于肌细胞内,CK及其同工酶是目前世界上临床测定最多的酶。血液中CK水平升高一般提示已有肌肉损害或正在发生肌肉损害,因其在疾病初期就可升高,所以被认为是PM中最常见且是所有肌酶中最敏感的指标,其水平升高与DM的诊断、疾病活动及预后相关。郑文洁等[18]曾报道,肌酶的升高可作为ASS的首发症状,其中以CK-C及羟丁酸脱氢酶水平升高最明显。本研究中抗JO-1抗体阳性患者CK水平明显增高,与抗JO-1抗体(-)组比较,差异有统计学意义(P<0.05),这与曹丽萍等[19]的报道一致。推测CK与抗JO-1抗体可能共同参与PM、ASS等疾病的发生和发展过程,二者同时阳性对疾病具有重要诊断价值。本研究还发现,抗JO-1抗体阳性患者CRP水平也明显增高,与抗JO-1抗体(-)组比较,差异有统计学意义(P<0.05)。CRP作为炎性反应的重要指标之一,因其通常被用来衡量炎性反应的活跃性,而并非作为某种疾病的诊断指标,所以缺乏特异性;由于自身免疫性疾病患者往往长期服用免疫抑制剂等药物,所以免疫力较低,容易合并其他感染,也会导致CRP水平升高,因此,其结果的准确性及其与抗JO-1抗体的相关性需进一步论证。本研究发现,抗JO-1抗体阳性患者CYFRA21-1水平明显增高,与抗JO-1抗体(-)组比较,差异有统计学意义(P<0.05)。CYFRA21-1作为肺癌肿瘤标志物之一,对于小细胞肺癌及鳞癌的诊断灵敏度均较高,在疾病治疗过程中其水平下降是预后的可靠预测因子[20],其主要存在于肺、食管部上皮起源的肿瘤细胞细胞质中,伴随细胞溶解坏死而释放出来。本研究中,抗JO-1抗体阳性患者CYFRA21-1水平明显增高,高度提示患者肺部组织可能存在损伤或病变。
本研究对抗JO-1抗体阳性患者的补体及免疫球蛋白进行统计时发现,IgG有升高趋势,但与抗JO-1抗体(-)组比较,结果稍低,差异有统计学意义(P<0.05),其他结果差异无统计学意义(P>0.05)。由于不同的病因和病程发展患者的免疫球蛋白水平之间差异有统计学意义[21],因此,临床上常常把免疫球蛋白作为疾病(如RA、支原体肺炎等)诊断、疗效观察及预后评定的重要指标。免疫球蛋白根据重链不同分为IgA、IgG、IgM、IgD、IgE 5种,血浆中IgG水平最高,且IgG分为IgG1、IgG2、IgG3、IgG4 4个亚型,各个亚型功能各异,又互相关联。其中IgG4相关性疾病谱较宽,包括ILD、自身免疫性胰腺炎、Riedel甲状腺炎、间质性肾炎等[22]。结合本研究的抗JO-1抗体阳性与ILD的相关性可以推测,IgG4与抗JO-1抗体可能共同参与了ILD的发生和发展过程,同时对二者进行检测,能更了解自身免疫性疾病的发病机制,对疾病的诊断和治疗意义更大。下一步将进行患者抗JO-1抗体阳性与血清IgG亚型的相关性研究。
目前,临床上检测抗JO-1抗体的方法大多是酶联免疫吸附试验、免疫扩散法、蛋白质免疫印迹法和流式荧光法。本研究的病例为自身抗体的联合检测与分析,采用的是蛋白质免疫印迹法,后续将采用灵敏度和特异度更高的流式荧光法对抗JO-1抗体阳性标本进一步进行相关研究。另外,本研究的抗JO-1抗体阳性病例数不是很多,可能存在一定的局限性,下一步将增加病例,深入进行疾病相关性探讨,为临床疾病的诊断提供更加有利的依据。
4 结 论
抗JO-1抗体作为PM的特异性抗体之一,阳性病例诊断为ILD的比例较PM/DM和ASS高,联合ANA、抗RO-52抗体、CK、CYFRA21-1及免疫球蛋白(尤其是血清IgG亚型)等检测,可作为PM/DM、ILD、ASS及SLE等自身免疫性疾病的辅助诊断指标,对于疾病的早期与鉴别诊断及了解自身免疫性疾病的发病机制等有重要意义。

