花旗参茶对乙醇诱导小鼠氧化损伤的保护作用
陈斯琪,李雅琦,余孝云,尚 强,3,伍 彪,聂 克,*
(1.广东药科大学中药学院,广东广州 510006;2.健康药业(中国)有限公司,广东珠海 519090;3.国家中药现代化工程技术研究中心,广东珠海 519090)
西洋参为五加科植物西洋参(PanaxquinquefoliumL.)的干燥根,又名花旗参,具有补气养阴、清热生津等功效[1]。现代研究表明,西洋参具有抗氧化[2]、调节免疫[3]、抗肿瘤[4]、保护心血管系统[5]、抗衰老[6]、抗炎[7]、改善糖脂代谢[8]和改善肠道菌群[9]等生物活性,可通过恢复体内平衡预防和治疗多种疾病[10]。民间有用西洋参饮片泡水服用、煲汤等习惯。花旗参茶是用西洋参经现代工艺制成的颗粒剂,用开水冲调即可饮用,具有便于携带、便于服用等优点。但是目前对花旗参茶的营养和保健作用的机制研究较少。
大量摄入乙醇可产生过量氧自由基,引起组织细胞过氧化以及肝脏脂肪变性、肝细胞坏死等病变[11]。机体氧化损伤是导致酒精性肝病的重要原因之一,其机制主要与机体氧化还原失衡、脂质过氧化等有关[12-13]。已有研究报道,乙醇能导致动物氧化应激,损伤肝脏,使体内的丙二醛(Malondialdehyde,MDA)、蛋白质羰基(Protein carbonyl,PC)水平显著升高,总超氧化物歧化酶(Total superoxide dismutase,T-SOD)、微量还原型谷胱甘肽(Reduced glutathione,GSH)水平显著降低,丙氨酸转氨酶(Alanine aminotransferase,ALT)、天冬氨酸转氨酶(Aminotransferase,AST)、甘油三酯(Triglyceride,TG)水平显著升高[14-16]。
本文根据原国家食品药品监督管理局保健食品《抗氧化功能评价方法(征求意见稿)》[17],采用乙醇氧化损伤小鼠模型,观察了花旗参茶的抗氧化损伤作用以及对乙醇所致肝损伤的保护作用,并与西洋参饮片泡水服用的抗氧化效果进行了对比。本研究首次从抗氧化和保护肝脏等方面对花旗参茶的保健作用机制进行实验研究,为其保健应用提供了一定科学依据。
1 材料与方法
1.1 材料与仪器
花旗参茶 3 g/袋,健康药业(中国)有限公司;MDA试剂盒、PC试剂盒、T-SOD试剂盒、GSH试剂盒、总蛋白(Total protein,TP)试剂盒、ALT试剂盒、AST试剂盒、TG试剂盒 南京建成生物工程研究所;其他试剂 均为分析纯;SPF级健康成年昆明小鼠 60只,雌性,体质量17.01±0.16 g,由南方医科大学实验动物中心提供,实验动物质量许可证号SCXK(粤)2016-0041,饲养于温度为20~25 ℃,湿度为40%~70%,12 h光照,12 h黑暗的环境,自由摄食和饮水,适应性饲养一周。
UV-2310 Ⅱ型紫外-可见分光光度计 上海天美科学仪器有限公司;BioTek Eon型超微量核酸蛋白分析仪 广州云星科学仪器有限公司;TGL-16M型台式高速冷冻离心机 长沙湘仪离心机仪器有限公司;NIKON Eclipse ci光学显微镜 日本尼康株式会社。
1.2 实验方法
1.2.1 西洋参饮片泡水样品制备 取西洋参饮片200 g,加16倍沸水,浸泡5 min,重复3次,合并滤液,滤过,浓缩,冷冻干燥,得冻干粉40 g。
1.2.2 动物分组与给药 选取25~30 g小鼠,随机分为6组:空白对照组、模型对照组、花旗参茶(参茶组)低中高3个剂量组、西洋参饮片泡水(饮片泡水)对照组,每组10只。参茶3个剂量组分别灌胃给予参茶1.5、3.0、6.0 g/kg(参茶成人每日推荐用量为9 g,成人体重按60 kg计,则人用量为0.15 g/kg体重。根据药效学研究中人与小鼠给药剂量的换算方法[18],小鼠剂量分别相当于人用量的10倍、20倍、40倍,每3 g参茶颗粒相当于原生药0.55 g,则分别相当于0.275、0.550、1.100 g生药/kg体重),饮片泡水组给予泡水冻干粉0.1 g/kg(西洋参饮片成人每日用量为3 g,成人体重按60 kg计,则人用量为0.5 g/kg体重。小鼠给药剂量相当于人用量的10倍,1 g冻干粉相当于原生药5 g,则相当于0.500 g生药/kg体重),模型对照组和空白对照组给予蒸馏水,各组动物灌胃容积均为20 mL/kg,连续30 d,根据每周体重调整给药剂量。
1.2.3 指标检测 每周称量并记录小鼠体重,共4周。末次灌胃后,模型对照组和各给药组禁食16 h(过夜),称量小鼠体重,一次性灌胃给予50%乙醇12 mL/kg bw造模,6 h后摘眼球取血(空白对照组不作处理,不禁食取血),4 ℃、2000 r/min离心10 min,制备血清,-80 ℃冰箱保存待测。取血后脱颈椎处死小鼠,解剖,迅速取出肝脏,一部分肝组织放入4%多聚甲醛固定,常规石蜡切片、HE染色;另一部分肝组织用生理盐水或试剂盒匀浆介质低温匀浆,4 ℃ 2000 r/min离心10 min,取上清液,待测。取出脾脏和胸腺,称重,按以下公式计算脾脏系数和胸腺系数:脾脏系数(mg/g)=脾脏重量(mg)/体重(g),胸腺系数(mg/g)=胸腺重量(mg)/体重(g)。
按照试剂盒说明书,分别检测血清和肝匀浆MDA、PC、T-SOD和GSH水平;检测血清ALT、AST和TG水平。
1.3 数据处理
2 结果与分析
2.1 花旗参茶对小鼠体重的影响
由表1可知,实验期间各组小鼠体重随时间延长而增长,在不同时间点各组小组体重分别两两比较,均无统计学差异(P>0.05)。说明花旗参茶和西洋参饮片泡水对正常小鼠体重增长无明显影响。
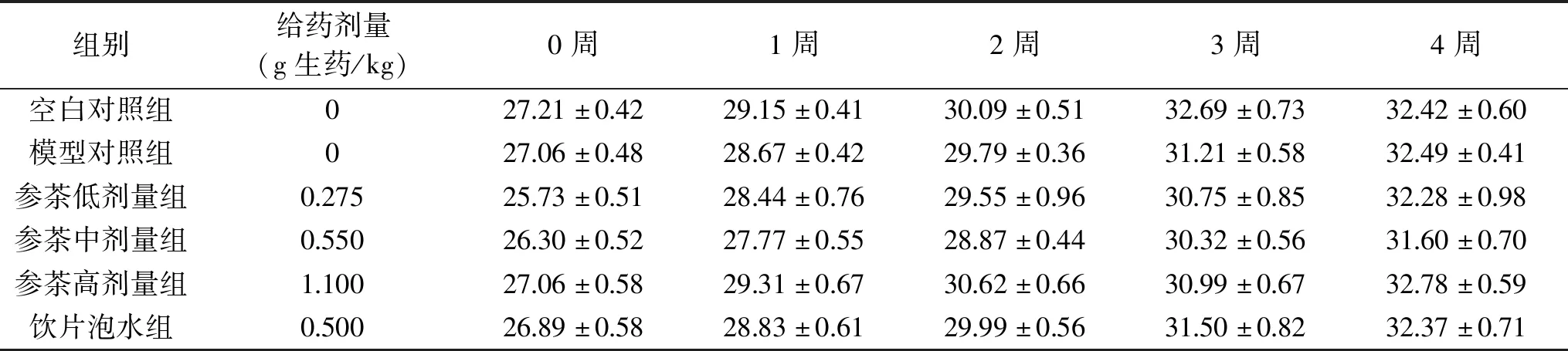
表1 各组小鼠体重变化(g)Table 1 Body weight of mice in each group(g)
2.2 花旗参茶对小鼠脏器系数的影响
由表2可知,各组小鼠胸腺系数和脾脏系数分别两两比较,均无统计学差异(P>0.05)。说明花旗参茶和西洋参饮片泡水在实验剂量范围对小鼠的胸腺系数和脾脏系数无明显影响。
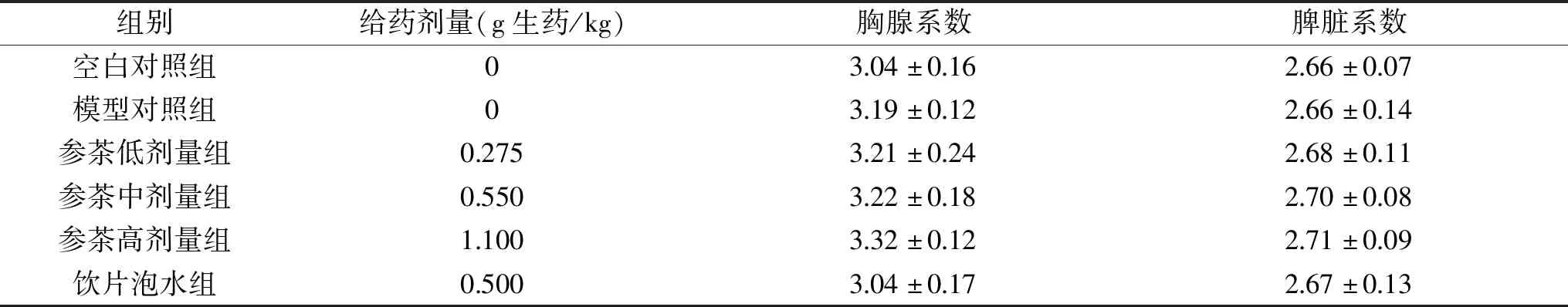
表2 各组小鼠脏器系数变化(mg/g)Table 2 Organ coefficient of mice in each group(mg/g)
2.3 花旗参茶对小鼠体内氧化损伤相关指标MDA、PC、T-SOD和GSH含量的影响
MDA是一种脂质氧化产物,其含量高低可反映机体内脂质过氧化的程度,间接地反映出细胞损伤的程度[19],PC可与生物大分子相互作用,引起羰基应激和氧化应激[20];T-SOD作为抗氧化系统的第一道防线,可清除超氧阴离子自由基,保护细胞免受损伤,对机体的氧化与抗氧化平衡起着至关重要的作用[21];氧化损伤的细胞中还原型和氧化型谷胱甘肽比例失衡,GSH作为一种低分子清除剂,可清除O2-、H2O2等,GSH含量是衡量机体抗氧化能力大小的重要因素[22]。
由表3可知,与空白对照组比较,模型组小鼠血清和肝组织中MDA和PC水平极显著升高(P<0.01),T-SOD和GSH水平显著降低(P<0.01),说明50%乙醇氧化损伤模型成功。与模型组比较,参茶低、中、高3个剂量组血清中MDA和PC水平均极显著降低(P<0.01),GSH水平极显著升高(低、中、高3个剂量,均P<0.01),T-SOD水平显著升高(低、中剂量,P<0.05;高剂量,P<0.01);饮片泡水组血清中MDA和PC水平极显著降低(P<0.01),GSH水平显著升高(P<0.05),T-SOD水平有升高趋势但无统计学差异(P>0.05)。与空白对照组比较,参茶低、中、高3个剂量组血清中的MDA和PC水平升高,T-SOD水平降低,低、中剂量组的GSH水平降低,高剂量组的GSH水平升高,但均无统计学差异(P>0.05);饮片泡水组血清中MDA水平显著高于空白对照组(P<0.05),T-SOD水平显著低于空白对照组(P<0.05),而PC水平有升高趋势,GSH水平有降低趋势,但均无统计学差异(P>0.05)。

表3 花旗参茶对各组小鼠血清中MDA、PC、T-SOD和GSH含量的影响Table 3 Effect of ginseng tea on MDA,PC,T-SOD and GSH in serum of mice in each group
以上结果说明,花旗参茶可剂量依赖性地降低乙醇氧化损伤小鼠血清中脂质过氧化和蛋白质氧化水平,提高抗氧化酶活性和抗氧化物质水平,发挥显著的抗氧化作用。西洋参饮片泡水组的给药剂量(0.500 g生药/kg)与花旗参茶中剂量(0.550 g生药/kg)相近,但其对抗氧化相关指标的改善程度只与花旗参茶低剂量(0.275 g生药/kg)相当,说明在同等剂量下,花旗参茶对氧化损伤的改善效果优于西洋参饮片泡水。
由表4可知,与模型组比较,参茶低、中、高3个剂量组和饮片泡水组肝组织中MDA和PC水平极显著降低(P<0.01),T-SOD和GSH水平极显著升高(P<0.01)。与空白对照组比较,参茶低剂量组肝组织中MDA和PC水平有升高趋势,中、高剂量组MDA和PC水平有降低趋势,但均无统计学差异(P>0.05);参茶低剂量组T-SOD极显著降低(P<0.01),而中、高剂量组T-SOD水平有降低趋势但均无统计学差异(P>0.05);参茶低剂量组GSH水平有升高趋势但无统计学差异(P>0.05),而中、高剂量GSH水平显著升高(分别P<0.05,P<0.01);饮片泡水组肝组织中的MDA、PC和GSH水平有升高趋势,T-SOD水平有降低趋势,但均无统计学差异(P>0.05)。
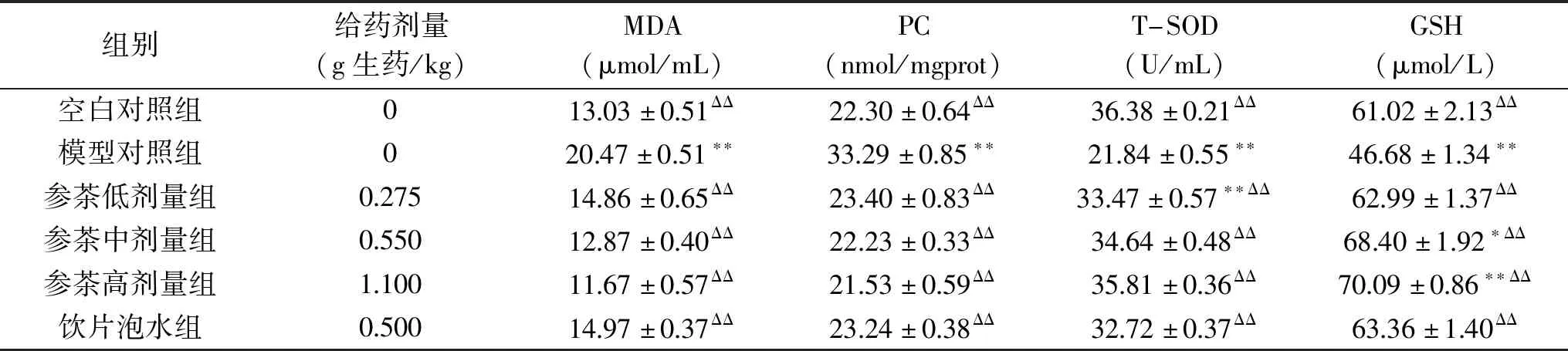
表4 花旗参茶对各组小鼠肝组织中MDA、PC、T-SOD和GSH水平的影响Table 4 Effect of ginseng tea on MDA,PC,T-SOD and GSH levels in liver tissues of mice in each group
肝组织中抗氧化相关指标测定结果与上述血清中抗氧化指标测定结果一致,进一步说明花旗参茶具有显著的抗氧化作用,并且在同等剂量下,花旗参茶对乙醇诱导氧化损伤的改善效果优于西洋参饮片泡水。
2.4 花旗参茶对小鼠体内肝损伤相关指标ALT、AST和TG水平的影响
ALT和AST是临床上广泛应用于肝功能检测的生化指标,当肝细胞受损变性时,肝细胞的胞浆释放ALT到血液中,当肝细胞严重受损、坏死时,肝细胞的线粒体释放AST到血液中,使血清ALT或AST含量增加,在肝功能检查中,ALT、AST分别是反映肝细胞受损、肝细胞坏死的指标[23];肝脏是合成、贮存TG的场所,TG含量偏高指示脂质的沉积[24]。
由表5可知,与空白对照组比较,模型组小鼠血清ALT、AST和TG水平极显著升高(P<0.01),说明50%乙醇可造成肝脏急性损伤和脂质沉积。与模型对照组比较,参茶3个剂量组和饮片泡水组血清中ALT水平极显著降低(P<0.01),AST水平显著降低(参茶3个剂量组P<0.01,饮片泡水组P<0.05);参茶中、高剂量组血清TG水平极显著降低(P<0.01),而参茶低剂量组和饮片泡水组TG水平只有降低趋势。与空白对照组比较,参茶中、高剂量组的ALT水平略有升高,但无统计学差异(P>0.05),但参茶低剂量组和饮片泡水组血清ALT水平显著高于空白组(分别P<0.05,P<0.01);参茶3个剂量组和饮片泡水组血清AST水平均极显著高于空白组(P<0.01);参茶3个剂量组和饮片泡水组血清TG水平均略高于空白组,但均无统计学差异(均P>0.05),见表5。以上结果说明,花旗参茶可减少乙醇诱导肝损伤小鼠的肝细胞中转氨酶和TG的释放,可能是通过调节肝细胞的细胞膜通透性,减少脂质堆积,保护肝脏。在同等剂量下,花旗参茶对乙醇诱导肝损伤的改善效果优于西洋参泡水。

表5 花旗参茶对各组小鼠血清中ALT、AST和TG水平的影响Table 5 Effect of ginseng tea on ALT,AST and TG levels in serum of mice in each group
2.5 花旗参茶对小鼠肝损伤的病理分析
酒精导致的肝脏损伤除了转氨酶和TG的水平改变,也会造成肝细胞凋亡和产生炎症[25]。HE染色结果显示(图1),空白对照组小鼠肝脏结构清晰,细胞正常;50%乙醇造模后,模型组小鼠肝组织出现明显的细胞空泡变性、坏死、胞质疏松淡染、细小泡沫样,且少数肝细胞嗜酸性增强,胞质内有伊红染半透明小体,指示存在炎症。与模型组比较,参茶低剂量组肝损伤程度与模型组无明显差异,中、高剂量组小鼠肝损伤程度较模型组轻,高剂量改善效果最明显;西洋参饮片泡水组损伤程度严重,未见明显改善。与空白对照组比较,参茶低、中、高剂量组小鼠肝组织出现细胞变性坏死、炎性浸润等不同程度损伤,高剂量改善效果最好;西洋参饮片泡水组小鼠肝组织出现细胞变性坏死和炎性浸润,损伤程度严重。说明中、高剂量的花旗参茶可减轻乙醇诱导肝损伤小鼠的肝脏炎症和维持肝细胞正常结构,高剂量组的改善效果最明显。

图1 各组小鼠肝组织HE染色病理分析图(200×)Fig.1 Pathological analysis of HE staining of liver tissues of mice in each group(200×)注:1为细胞变性;2为细胞坏死;3为强嗜酸性细胞;4为嗜酸性小体。
3 结论与讨论
乙醇在体内经过一系列生物代谢过程,产生乙醛等有害物质,导致氧化应激,对肝脏等器官造成损伤[26]。本实验通过建立乙醇氧化损伤小鼠模型,检测血清和肝组织中MDA、PC、T-SOD和GSH的含量,评估花旗参茶的抗氧化作用;通过检测血清中ALT、AST和TG含量,并结合病理观察,评估花旗参茶对肝损伤的改善作用。结果表明,花旗参茶和西洋参饮片泡水可通过抑制机体脂质过氧化和蛋白质氧化、提高抗氧化酶活性和抗氧化物水平,并减轻肝组织空泡变性和炎症反应等病理改变,进而减轻乙醇对机体的氧化损伤和急性肝损伤。另有研究表明,西洋参对电离辐射导致的小鼠氧化损伤具有保护作用[27],对对乙酰氨基酚和环磷酰胺导致的小鼠肝损伤具有保护作用[28-29],说明西洋参具有确切的抗氧化和肝保护作用,与本文用乙醇诱导小鼠氧化损伤和肝损伤模型的实验结果一致。
花旗参茶通过降低乙醇氧化损伤小鼠体内MDA、PC水平,升高SOD、GSH水平,维持氧化与抗氧化平衡,减少肝组织中的ALT、AST和TG释放到血液,并减轻肝组织中肝细胞坏死、变性、炎性浸润等病理改变,从而发挥显著的抗氧化和保护乙醇急性肝损伤作用。在同等剂量下,花旗参茶的抗氧化作用和保护肝损伤作用优于西洋参饮片。本研究只对花旗参茶抗氧化和保肝的作用机制进行了探讨,而其调节免疫、抗疲劳等作用及作用机制尚待下一步继续研究。后续可通过网络药理学、分子对接等技术,深入挖掘花旗参茶抗氧化、保肝等作用的有效成分、作用靶点和信号通路,并通过相关实验进行验证,以更深入、更全面阐明花旗参茶的保健作用机制。

