黄精总皂苷提取工艺优化及其对α淀粉酶及α葡萄糖苷酶抑制活性
包瑞敏,张 智,*,杜亚飞,高 群,王 彪,张志峰
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.秀山土家族苗族自治县油茶研究院,重庆 409900)
黄精是百合科植物黄精、多花黄精的干燥根茎[1-2],主要化学成分有皂苷、多糖、生物碱等,具有降血糖、降血脂、增强免疫、促进睡眠等功效[3-8]。皂苷是黄精主要活性成分[9]。
目前,对黄精总皂苷的提取方法主要有有机溶剂提取法、超声波法、微波法、酶法以及超声波辅助纤维素酶法等[10-13],纤维素酶和果胶酶能特异性降解中草药细胞壁中纤维素、果胶,使细胞内物质最大限度地溶出,因此,本研究选择利用纤维素酶和果胶酶共同进行黄精总皂苷的提取,通过复合酶法的使用更大限度地提高黄精总皂苷得率。Miura等[14]利用非胰岛素依赖型糖尿病小鼠研究了黄精根茎的提取物具有降血糖作用。
本研究通过黄精总皂苷提取物对α-葡萄糖苷酶及α-淀粉酶抑制活性的研究来辅助对黄精总皂苷降糖活性的研究,旨在为黄精总皂苷的提取、利用提供新的角度和一定的数据参考。
1 材料与方法
1.1 材料与仪器
鲜黄精 于2018年12月采自贵州省印江县,经贵州省中药材产业黄精专家组龙昌顺专家鉴定为百合科植物多花黄精的干燥根茎;薯蓣皂苷元标准品 上海哈灵生物科技有限公司;果胶酶(1.0×105U/g)、纤维素酶(1.4×106U/g) 北京博奥拓达科技有限公司;α-葡萄糖苷酶(100 U/mg)、α-淀粉酶(150 U/mg)、阿卡波糖 上海源叶生物科技有限公司。
UV-5500PC型紫外可见分光光度计 上海元析仪器有限公司;RT-6000型酶标仪 深圳雷杜生命科学有限公司;SJ-3 F型pH计 上海圣科仪器设备有限公司。
1.2 实验方法
1.2.1 总皂苷提取工艺 将鲜黄精清洗切片放入干燥箱干制,取出干燥片粉碎,过60目筛后装袋,于4 ℃保存待用。
称取一定量上述黄精粉末,加入一定比例的纤维素酶与果胶酶,以一定料液比加入蒸馏水,调节酶解pH,在一定温度下提取一定时间,得到黄精总皂苷提取液。
1.2.2 单因素试验
1.2.2.1 纤维素酶添加量对得率的影响 在果胶酶添加量3.0%,料液比1∶12 g/mL,调节酶解pH为5.0,40 ℃酶解温度下,调整纤维素酶添加量为0.2%、0.4%、0.6%、0.8%、1.0%、1.2%,酶解1.5 h后迅速升温至90 ℃以上,保持15 min使酶失活。室温下离心,用100 mL蒸馏水洗涤滤渣,合并滤液浓缩至100 mL。精密吸取20 mL,用水饱和的正丁醇萃取3次,合并正丁醇部分,冷冻干燥,得粗黄精总皂苷。将粗皂苷用甲醇定容至50 mL,制成样品液,测定样品液的总皂苷含量。
1.2.2.2 果胶酶添加量对得率的影响 确定纤维素酶添加量0.4%,其他条件同上,调整果酶添加量为1.0%、2.0%、3.0%、4.0%、5.0%、6.0%,测定样品液的总皂苷含量。
1.2.2.3 料液比对得率的影响 确定纤维素酶添加量0.4%,果胶酶添加量5.0%,其他条件同上,调整料液比为1∶4、1∶8、1∶12、1∶16、1∶20、1∶24 g/mL,测定样品液的总皂苷含量。
1.2.2.4 酶解pH对得率的影响 确定纤维素酶添加量0.4%,果胶酶添加量5.0%,料液比1∶16 g/mL,其他条件同上,调整酶解pH为4.0、4.5、5.0、5.5、6.0、6.5,测定样品液的总皂苷含量。
1.2.2.5 酶解温度对得率的影响 确定纤维素酶添加量0.4%,果胶酶添加量5.0%,料液比1∶16 g/mL,酶解pH为5.0,其他条件同上,调整酶解温度为30、35、40、45、50、55 ℃,测定样品液的总皂苷含量。
1.2.2.6 酶解时间对得率的影响 确定纤维素酶添加量0.4%,果胶酶添加量5.0%,料液比1∶16 g/mL,酶解pH为5.0,酶解温度为45 ℃,调整酶解时间为0.5、1.0、1.5、2.0、2.5、3.0 h,测定样品液总皂苷含量。
1.2.3 响应面试验 根据单因素实验结果选择纤维素酶添加量、酶解温度、酶解时间3个因素,以黄精总皂苷得率为指标,设计3因素3水平响应面试验,如表1所示。

表1 响应面因素水平表Table 1 Factors and levels response surface method
1.2.4 总皂苷得率的计算
1.2.4.1 标曲的制作 参考苑璐等[15]的方法稍作改动,使用薯蓣皂苷元作为标准品,确定最大吸收波长为550 nm,绘制标准曲线。得到回归方程为y=0.0121x+0.0034,R2=0.9997。
1.2.4.2 总皂苷得率的计算
式中:W表示总皂苷得率,%;c表示溶液质量浓度,μg/mL;D表示稀释倍数,10-6;V表示皂苷稀释后体积,mL;m表示黄精称取量,g。
1.3 体外α-葡萄糖苷酶抑制活性及α-淀粉酶抑制活性研究
1.3.1α-葡萄糖苷酶抑制试验 参考Nguyen等[16]的方法稍作改动,将50 μL不同浓度(0.125、0.250、0.500、1.000、2.000、3.000 mg/mL)的样品溶液(50% DMSO)加入到100 μL 0.1 mol/L含有α-葡萄糖苷酶溶液(1.0 U/mL)的磷酸盐缓冲液(pH6.9)中,96孔板中25 ℃孵育10 min,对照品使用50 μL 50% DMSO替代样品。预孵育后,将50 μL 5 mmol/L对硝基苯基-α-D-吡喃葡萄糖溶液加入0.1 mol/L磷酸盐缓冲液(pH6.9)中。混合物在25 ℃孵育5 min。孵育前后,用酶标仪记录405 nm处的吸光度读数。设置0.5 mg/mL 的阿卡波糖液为阳性对照。抑制率计算如下:

式中:Acontrol表示对照样品吸光度;Asample表示测试样品吸光度。
1.3.2α-淀粉酶抑制试验 参考Agu等[17]的方法稍作改动,准备200 μL不同浓度(0.125、0.250、0.500、1.000、2.000、3.000 mg/mL)的样品稀释液和500 μL含猪源胰腺α-淀粉酶(0.50 mg/mL)磷酸钠缓冲液(0.02 mol/dm3,pH=6.9和0.006 mol/L NaCl为稳定剂)。将样品在37 ℃下孵育5 min,然后将500 μL淀粉溶液(1 mg/100 mL,0.02 mol/dm3钠缓冲液,pH6.9,含0.006 mol/L NaCl引入反应混合物中。并在37 ℃水浴中孵育5 min。加入1 mL二硝基水杨酸(DNSA)停止反应,然后在沸水中进一步孵育5 min。空白样品中不添加淀粉溶液和酶,而对照样品除淀粉溶液外,所有试剂和酶都有。当反应混合物冷却时,在540 nm处读取吸光度。设置0.5 mg/mL 的阿卡波糖液为阳性对照。抑制率计算如下:

式中:Acontrol表示对照样品吸光度;Asample表示测试样品吸光度。
1.4 数据处理
数据使用平均值±标准差表示,每组数据测定3次,采用Excel 2019处理,图表使用OrginLab绘制,响应面方案的设计及分析使用Design Expert 10进行。
2 结果与分析
2.1 单因素试验结果
2.1.1 纤维素酶添加量对得率的影响 由图1可知,纤维素酶添加量0.4%时,黄精总皂苷得率最大,这可能是由于纤维素酶可以产生破壁作用致使皂苷类化合物充分溶出。之后,增加纤维素酶含量,得率则持续下降,可能是因为过高的酶含量会造成皂苷的降解[18]。据此,纤维素酶添加量确定为0.4%。
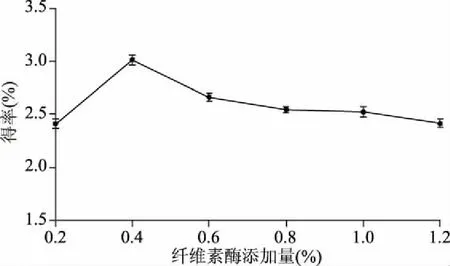
图1 纤维素酶添加量对得率的影响Fig.1 Effect of cellulase addition on extraction rate
2.1.2 果胶酶添加量对得率的影响 由图2可知,果胶酶添加量由1.0%增加到5.0%的过程中,黄精总皂苷得率不断增大,果胶酶添加量5.0%时得率最大。而后,总皂苷得率呈现降低趋势。这种变化可能因为果胶酶能够降解植物细胞细胞壁,随着添加量增加,活性成分不断溶出,然而,酶含量的增加并没有使得率持续上高,可能是因为过高的酶含量会造成皂苷的降解。据此,果胶酶添加量选择为5.0%。

图2 果胶酶添加量对得率的影响Fig.2 Effect of pectinase addition on extraction rate
2.1.3 料液比对得率的影响 由图3可知,随着料液比的减小黄精总皂苷得率不断增大,料液比为1∶16 g/mL时得率最大。这种变化可能是过少的蒸馏水在提取时会导致提取液较为粘稠,目标物释放困难,会出现提取速度慢、提取不完全的情况。当蒸馏水的用量不断增加,酶与反应物能够增大接触面积,致使溶液中的总皂苷含量增多。据此,选择料液比为1∶16 g/mL。

图3 料液比对得率的影响Fig.3 Effect of solid-liquid ratio on extraction rate
2.1.4 酶解pH对得率的影响 由图4可知,pH4.0~5.0时,黄精总皂苷得率呈递增趋势,pH为5.0时得率最大,pH超过5.0后,得率呈递减趋势,说明pH为5.0时最有利于酶和底物的结合,由此得出:过低与过高的pH均能使酶的活性降低,而此复合酶的最适pH为5.0。据此,选择pH为5.0。

图4 酶解pH对得率的影响Fig.4 Effect of enzymatic hydrolysis pH on extraction rate
2.1.5 酶解温度对得率的影响 由图5可知,当酶解温度低于35 ℃时黄精总皂苷得率处于较低的状态,而当温度超过35 ℃后酶解速度增加,得率出现较大地上升,并在45 ℃时达到最大。超过45 ℃后酶活性降低,酶解速度减慢,得率降低。这可能是由于低温时分子运动弱,酶与底物的结合率低,反应速率低。随着酶解温度的升高,反应物分子间的有效碰撞次数增多,反应速率提升。但过低与过高的温度均不利于酶解的进行,而45 ℃正是此复合酶最适温度。据此,综合考虑,选择酶解温度为45 ℃。
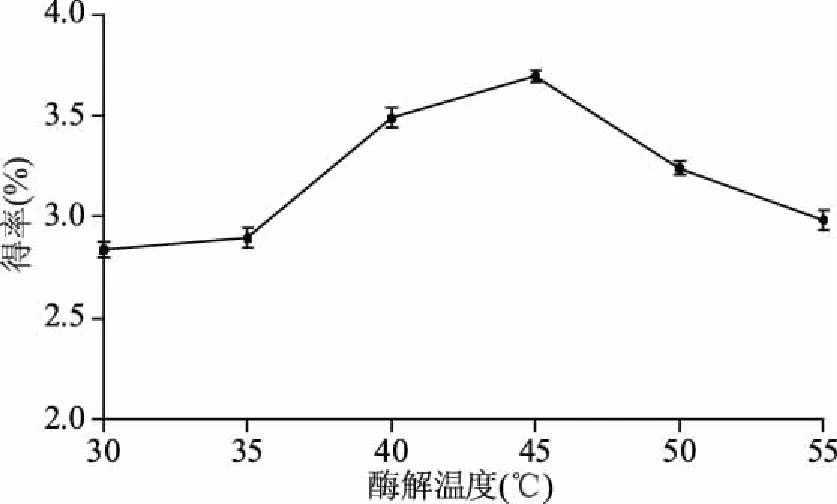
图5 酶解温度对得率的影响Fig.5 Effect of enzymatic hydrolysis temperature on extraction rate
2.1.6 酶解时间对得率的影响 由图6可知,随着酶解时间的加长黄精总皂苷得率随之上升,酶解时长2.0 h时得率最大,而后延长酶解时间得率稍有降低。酶解反应需要一定时间,酶解时间的加长能够使酶与底物充分反应,当酶解结束,酶解时间的加长没有让总皂苷得率持续升高。因此,选择酶解时间为2.0 h。

图6 酶解时间对得率的影响Fig.6 Effect of enzymatic hydrolysis time on extraction rate
2.2 响应面试验结果与方差分析
根据单因素实验结果确定响应面设计方案,得率结果如表2所示,回归方程为Y=-29.07+17.76A+1.19B+3.21C+0.016AB+0.668AC+0.075BC-24.16A2-0.015B2-1.79C2,响应面模型方差分析如表3所示。

表3 响应面模型方差分析Table 3 Anovariance analysis of response surface model
由表3可以看出,黄精总皂苷提取工艺的回归模型P=0.0001<0.01,说明回归模型达到极显著,具有统计学意义;模型误差失拟项P=0.1262>0.05,差异不显著,R2=0.9729,表明该方程对模型拟合情况较好,能够反映纤维素酶添加量、酶解温度、酶解时间对黄精总皂苷得率的影响,可用来分析和预测黄精总皂苷得率。
经Design-Expert 10. 0软件处理得到个因素交互作用的响应面图(图7~图9),可以直观地看出各因素间的交互作用对黄精总皂苷得率的影响,可以看出每两个因素之间具有一定的交互作用但不明显,图7等高线呈现椭圆形,纤维素酶添加量轴向等高线变化密集,对响应值峰值的影响较酶解温度大。图8等高线呈现椭圆形,纤维素酶添加量对响应值峰值的影响较酶解时间大。图9酶解温度和酶解时间轴向等高线变化密集程度相当,说明二者对响应值峰值的影响相当,但都比纤维素酶添加量小。
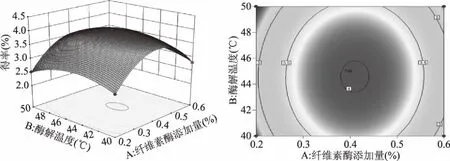
图7 纤维素酶添加量与酶解温度交互作用效应Fig.7 Interaction effect of cellulase addition amount and enzymatic hydrolysis temperature
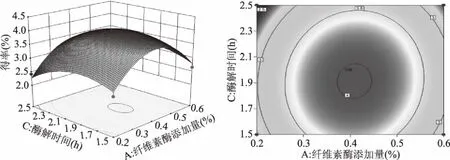
图8 纤维素酶添加量与酶解时间交互作用效应Fig.8 Interaction effect of cellulase addition amount and digestion time
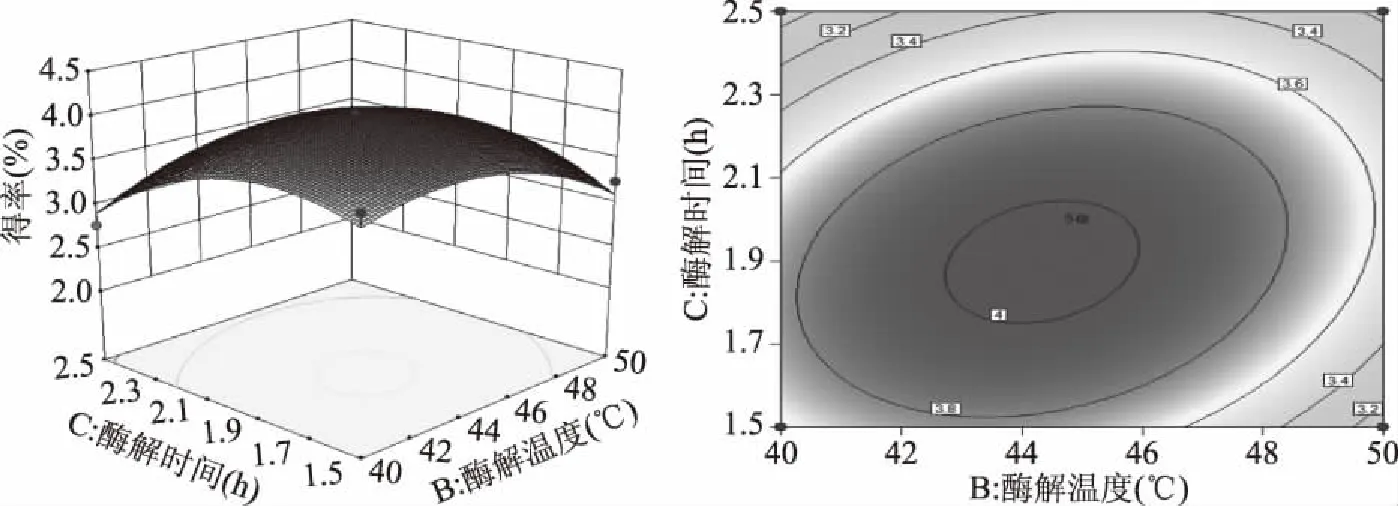
图9 酶解温度与酶解时间交互作用效应Fig.9 Interaction effect of enzymatic hydrolysis temperature and enzymatic hydrolysis time
经Design-Expert. 10. 0软件分析,得出黄精总皂苷最佳提取工艺条件为:纤维素酶添加量0.41%,酶解温度44.3 ℃,酶解时间为1.9 h,此时理论上的预测得率为4.04%。考虑到操作的实际性,将最佳参数设置为纤维素酶添加量0.4%,酶解温度45 ℃,酶解时间2.0 h进行验证试验,重复3次,验证结果的可靠性,测得皂苷得率为4.06%,与理论预测值非常相近,由此,基于响应曲面法所得的黄精总皂苷提取参数准确可靠,具有实用价值。
2.3 黄精总皂苷体外α-淀粉酶及α-葡萄糖苷酶抑制活性
使用上文所获得的最佳提取条件提取的黄精总皂苷,分别验证不同的总皂苷浓度对α-葡萄糖苷酶、α-淀粉酶的抑制率。
黄精总皂苷对α-葡萄糖苷酶抑制率如图10所示。α-葡萄糖苷酶可以将二糖消化为葡萄糖,其位于肠道细胞表面膜上,对于II型糖尿病患者来说,餐后,α-葡萄糖苷酶的作用极易造成高血糖[19]。若能抑制寡糖水解成葡萄糖的过程,就可控制餐后高血糖。因此,抑制α-葡萄糖苷酶活性从而抑制糖类水解,有利于II型糖尿病患者控制血糖[20]。不同浓度的黄精总皂苷对α-葡萄糖苷酶均有抑制作用,陆建美等[21]的研究也得到相近的结果。抑制率随其浓度的升高而增大,在总皂苷浓度低于0.500 mg/mL时,其抑制率较低,在0.500 mg/mL其抑制率达到61%,当浓度高于0.500 mg/mL后抑制率的上升则相对放缓。当浓度为3.000 mg/mL 时,抑制率为74%,接近于阿卡波糖(0.5 mg/mL)的82%。
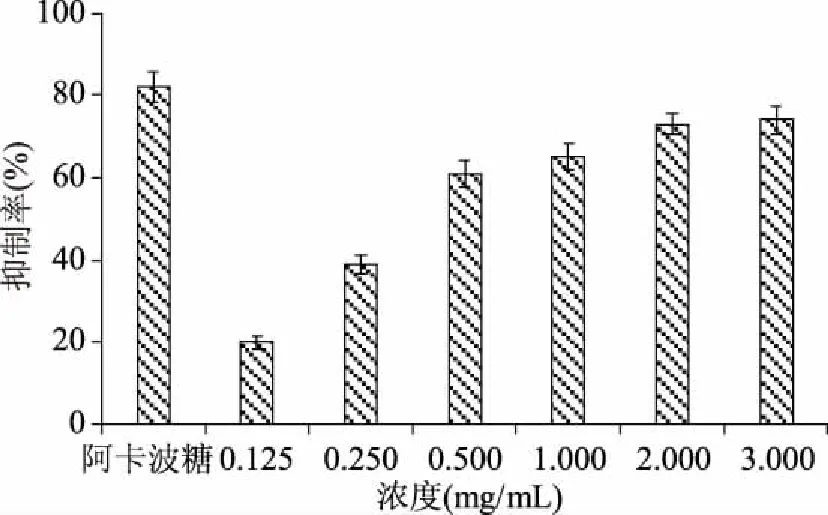
图10 黄精总皂苷对α-葡萄糖苷酶的抑制率Fig.10 Inhibitory rate of Polygonatum sibirium saponins on α-glucosidase
黄精总皂苷对α-淀粉酶抑制率如图11所示。α-淀粉酶可以水解淀粉内部的α-1,4-糖苷键,水解产物为糊精、低聚糖和单糖,也可以造成胰岛素代谢障碍人群餐后高血糖[22]。黄精总皂苷对α-淀粉酶抑制率整体趋势随浓度的增大而增强,在总皂苷浓度低于1.000 mg/mL,其α-淀粉酶抑制率增加较为明显,随后增长趋势放缓。2.000 mg/mL时,其抑制率最高,达到82%,高于阿卡波糖(0.5 mg/mL)的80%。两组酶抑制试验说明黄精总皂苷提取物具有抑制α-葡萄糖苷酶和α-淀粉酶活性的作用。

图11 黄精总皂苷对α-淀粉酶的抑制率Fig.11 Inhibitory rate of saponins from Polygonatum sibiricum on α-amylase
3 结论
本文以黄精为原料,对黄精总皂苷的复合酶法提取工艺及总皂苷对α-葡萄糖苷酶和α-淀粉酶的抑制活性进行了研究,在单因素实验的基础上通过响应面优化试验确定出最佳提取参数:纤维素酶添加量0.4%,果胶酶添加量5.0%,料液比1∶16 g/mL,酶解pH为5.0,酶解温度45 ℃,酶解时间2.0 h,在此条件下得率为4.06%。分别测试不同浓度下的黄精总皂苷体外α-淀粉酶及α-葡萄糖苷酶抑制活性,两组酶的抑制试验说明:黄精总皂苷具有抑制α-葡萄糖苷酶和α-淀粉酶活性的作用,表明其具有一定的降血糖功能。本文为黄精这一传统的药食同源性中草药植物能够被更好地开发、利用提供有效的理论参考。在今后的研究中,可结合总皂苷体外降糖试验与体内降糖试验两方面完善其降糖功能的探究。

