基于TLR4/MyD88/NF-κB信号通路研究黄连素对小鼠巨噬细胞极化的干预作用
李建功 孙文熙 刘家玥 李雪山 薛伟琪 罗川晋

摘 要 目的:基于Toll樣受体4(TLR4)/髓样分化因子88(MyD88)/核因子κB(NF-κB)信号通路研究黄连素对小鼠巨噬细胞极化的影响。方法:以小鼠巨噬细胞RAW264.7为对象,以阿托伐他汀钙为阳性对照,经脂多糖(LPS)诱导以复制炎症细胞模型,采用酶联免疫吸附测定法检测低、中、高剂量黄连素(5、10、20 μmol/L)作用24 h后细胞培养液中肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、NF-κB含量,采用实时荧光定量聚合酶链反应法检测细胞中TLR4、MyD88 mRNA的表达水平,采用Western blotting法检测细胞中TLR4、MyD88、诱导型一氧化氮合酶(iNOS)、CD206蛋白的表达水平。结果:与空白对照组比较,LPS诱导组细胞培养液中TNF-α、IL-6、NF-κB含量,细胞中TLR4、MyD88 mRNA的相对表达量以及TLR4、MyD88、iNOS蛋白相对表达量均显著升高(P<0.05)。与LPS诱导组比较,阿托伐他汀钙组和黄连素中、高剂量组TNF-α、IL-6含量,TRL4、MyD88 mRNA及其蛋白的相对表达量以及各给药组NF-κB含量和iNOS蛋白的相对表达量均显著降低,且黄连素高剂量组NF-κB含量显著低于阿托伐他汀钙组(P<0.05);阿托伐他汀钙组和黄连素高剂量组CD206蛋白的相对表达量均显著升高,且黄连素高剂量组CD206蛋白的相对表达量显著高于阿托伐他汀钙组(P<0.05)。结论:不同剂量的黄连素均可不同程度地干预小鼠巨噬细胞极化,其机制可能与调控TLR4/MyD88/NF-κB信号通路有关。
关键词 黄连素;小鼠巨噬细胞;RAW264.7细胞;极化;Toll样受体4/髓样分化因子88/核因子κB信号通路
ABSTRACT OBJECTIVE: To study the effects of berberine on mice macrophage polarization based on TLR4-MyD88-NF-κB signaling pathway. METHODS: Using mice RAW264.7 macrophage as the object, atorvastatin calcium as positive control, inflammatory cell model was induced by lipopolysaccharide (LPS); ELISA method was used to detect the contents of TNF-α, IL-6 and NF-κB in cell culture medium after treated with low, medium and high doses of berberine (5, 10, 20 μmol/L) for 24 h. The real-time fluorescence quantitative PCR was conducted to determine the mRNA expression of TLR4 and MyD88 in cells. Western blotting assay was used to detect the protein expression of TLR4, MyD88, iNOS and CD206 in cells. RESULTS: Compared with blank control group, the contents of TNF-α, IL-6 and NF-κB in cell culture medium, mRNA expression of TLR4 and MyD88, protein expression of TLR4, MyD88 and iNOS in cells were increased significantly in LPS induction group (P<0.05). Compared with LPS induction group, the contents of TNF-α and IL-6, mRNA and protein expression of TLR4 and MyD88 in atorvastatin calcium group, berberine medium-dose and high-dose groups as well as the content of NF-κB and protein expression of iNOS in administration groups were decreased significantly, while the content of NF-κB in berberine high-dose group was significantly lower than atorvastatin calcium group (P<0.05). The protein expressions of CD206 in atorvastatin calcium group and berberine high-dose group were increased significantly, while the protein expression of CD206 in berberine high-dose group was significantly higher than atorvastatin calcium group (P<0.05). CONCLUSIONS: Different doses of berberine can intervene in mice macrophage polarization to different extents, the mechanism of which may be associated with the regulation of TLR4/MyD88/NF-κB signaling pathway.
KEYWORDS Berberine; Mice macrophage; RAW264.7 cell; Polarization; TLR4/MyD88/NF-κB signaling pathway
动脉粥样硬化(Atherosclerosis,AS)是一种慢性炎症性疾病[1]。有研究指出,AS斑块中存在大量的免疫细胞如巨噬细胞、树突状细胞等[2]。其中,巨噬细胞作为斑块组织中炎症因子的主要来源和先天性免疫应答中的主要免疫细胞,在AS的进展过程中发挥了关键作用[3]。巨噬细胞是一种多相细胞,可在不同因子的诱导下极化,即被不同细胞因子激活后活化为M1型或M2型巨噬细胞,其中M1型巨噬细胞分泌的细胞因子具有促AS的作用,M2型巨噬细胞则可增加AS斑块的稳定性[4]。因此有学者指出,调节巨噬细胞的极化可能成为抗AS作用研究的新靶点[3]。核因子κB(NF-κB)是一种重要的转录因子,可参与调控多种与炎症反应相关的细胞因子、黏附分子的表达,其激活与巨噬细胞极化密切相关[5-6]。脂多糖(LPS)是引起炎症性疾病的主要原因之一[7]。有研究证实,LPS可通过识别并结合Toll样受体4(TLR4),经TLR4/髓样分化因子88(MyD88)途径激活NF-κB[8-9]。
黄连素作为中药黄连的主要有效成分之一,已有研究证实其可通过抗炎作用抑制AS斑块的形成[10-11],但具体机制尚未完全阐明。本研究基于TLR4/MyD88/NF-κB信号通路,初步探讨了黄连素对小鼠RAW264.7巨噬细胞极化的干预作用,以期为临床防治AS提供新的靶点和思路。
1 材料
1.1 仪器
HEPA Class100型CO2培养箱(美国Thermo Fisher Scientific公司);Rotofix 32A型离心机(德国Hettich公司);SpectraMax Plus 384型全自动酶标仪(美国Molecular Devices公司);BioDoc-IT型凝胶成像系统(美国UVP公司);UV-6100S型紫外分光光度计(上海元析仪器有限公司);ABI 7500型实时荧光定量聚合酶链反应(PCR)仪(美国Bio-Rad公司);BT25S型电子天平(德国Sartorius公司)。
1.2 药品与试剂
黄连素原料药(批号:HY-N0197,纯度:98%)以及胎牛血清、DMEM高糖培养基、磷酸盐缓冲液(PBS,pH 7.2)、RPMI 1640培养基、蛋白裂解液(RIPA)、TRIzol试剂、实时荧光定量PCR试剂盒(含SYBR荧光染料等试剂)、ECL化学发光试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒、BCA蛋白定量试剂盒(批号分别为ISEQ00010、ISEQ00023、ISEQ00812、WSED00972、WSED08821、WSED56324、CSB-E08324r、CSB-E08453r、CSB-E09971r、CSB-E09576r)均购自广东晶欣生物科技有限公司;阿托伐他汀钙片(阳性对照,辉瑞制药有限公司,批号:6958703500744,规格:20 mg/片);二甲基亚砜(DMSO)、脂多糖(LPS)(美国Sigma公司,批号分别为D4540、L2880);肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、NF-κB酶联免疫吸附测定(ELISA)检测试剂盒(广州英韦创津生物科技有限公司,批号分别为SDFGT1589、SDFGT1573、SDFGT15812);cDNA合成试剂盒(美国Thermo Fisher Scientific公司,批号:00351597);兔抗小鼠TLR4、MyD88、誘导型一氧化氮合酶(iNOS)、CD206、甘油醛-3-硫酸脱氢酶(GAPDH)抗体(内参)(武汉博士德生物工程有限公司,批号分别为BSD-GS77908、BSD-GS23903、BSD-GS67905、BSD- GS44907、BSD- GS76901);辣根过氧化物酶标记的山羊抗小鼠免疫球蛋白G(IgG)二抗(武汉华美生物工程有限公司,批号:CSB-PA644737);其余试剂均为分析纯,水为蒸馏水。
1.3 细胞
小鼠巨噬细胞RAW264.7细胞株由中国科学院上海生科院细胞资源中心提供。
2 方法
2.1 细胞培养
将RAW264.7细胞接种于含10%胎牛血清的DMEM高糖培养基中,于37 ℃、5%CO2条件下(下同)培养48 h,以1 000 r/min离心5 min;弃去上清液,沉淀加入PBS适量,再加入RPMI 1640培养基混匀、重悬并计数,制成密度为1×106个/mL的细胞悬液,备用。
2.2 分组、造模与给药
取“2.1”项下RAW264.7细胞悬液适量,按100 μL/孔接种于96孔板中,并随机分为空白对照组、LPS诱导组、阿托伐他汀钙组(10 μmol/L,剂量设置参考文献方法[12])和黄连素低、中、高剂量组(5、10、20 μmol/L,剂量设置参考本课题组前期预试验结果),每组设3个复孔。空白对照组和LPS诱导组均不加入药物;LPS诱导组加入LPS(终质量浓度为100 μg/L),其余各药物组经相应药物预处理2 h后再加入等量LPS(终质量浓度为100 μg/L),培养24 h以复制细胞炎症模型。
2.3 相关指标检测
2.3.1 细胞培养液中TNF-α、IL-6、NF-κB的含量 采用ELISA法检测。收集“2.2”项下各组细胞培养液,于4 ℃下以12 000 r/min离心10 min,收集上清液,使用全自动酶标仪检测其中TNF-α、IL-6、NF-κB含量。严格按照相应试剂盒说明书操作。上述试验重复3次。
2.3.2 细胞中TLR4、MyD88 mRNA的表达量 采用实时荧光定量PCR法检测。取“2.2”项下各组细胞适量,用PBS清洗后,采用TRIzol法提取细胞总RNA,使用紫外分光光度计检测RNA的纯度和浓度(当RNA的A260 nm/A280 nm为1.8~2.0时,才能进行后续试验[12])。按 cDNA合成试剂盒说明书操作,将mRNA逆转录为cDNA并进行PCR扩增。PCR反应体系(20 μL):cDNA模板4 μL、上/下游引物(序列见表1)各2 μL、SYBR荧光染料10 μL、无核酸酶水2 μL;反应条件:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。以GAPDH作为内参,生成扩增曲线和熔解曲线,使用Image J v1.5.1软件分析并采用2-ΔΔCt法计算TLR4、MyD88 mRNA的相对表达量。上述试验重复6次。
2.3.3 细胞中TLR4、MyD88、iNOS、CD206蛋白的表达量 采用Western blotting法检测。取“2.2”项下各组细胞适量,用蛋白裂解液(RIPA)裂解30 min后,于4 ℃下以12 000 r/min离心10 min,取上清液,用BCA蛋白定量试剂盒测定蛋白浓度。蛋白经煮沸5 min变性,取变性蛋白50 μg行SDS-PAGE,电泳结束后转移至聚偏二氟乙烯(PVDF)膜上,用5%脱脂奶粉于室温封闭1 h,加入相应一抗(稀释度均为1 ∶ 1 000),于4 ℃孵育过夜;用磷酸盐吐温缓冲溶液(PBST)清洗后,加入二抗(稀释度为1 ∶ 200),于37 ℃孵育1 h;用PBST溶液清洗后,以ECL化学发光试剂盒显色后,置于凝胶成像系统上成像并采用Image J v1.5.1软件分析,以相应蛋白与内参的灰度值比值表示该蛋白的相对表达量。上述试验重复6次。
2.4 统计学方法
使用SPSS 22.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较用单因素方差分析,组间两两比较采用t检验。P<0.05表示差异有统计学意义。
3 结果
3.1 黄连素对RAW264.7细胞培养液中TNF-α、IL-6、NF-κB含量的影响
与空白对照组比较,LPS诱导组细胞培养液中TNF-α、IL-6、NF-κB含量均显著升高(P<0.05)。与LPS诱导组比较,阿托伐他汀钙组和黄连素中、高剂量组细胞培养液中TNF-α、IL-6含量以及各给药组NF-κB含量均显著降低,且黄连素高剂量组NF-κB含量显著低于阿托伐他汀钙组(P<0.05),详见表2。
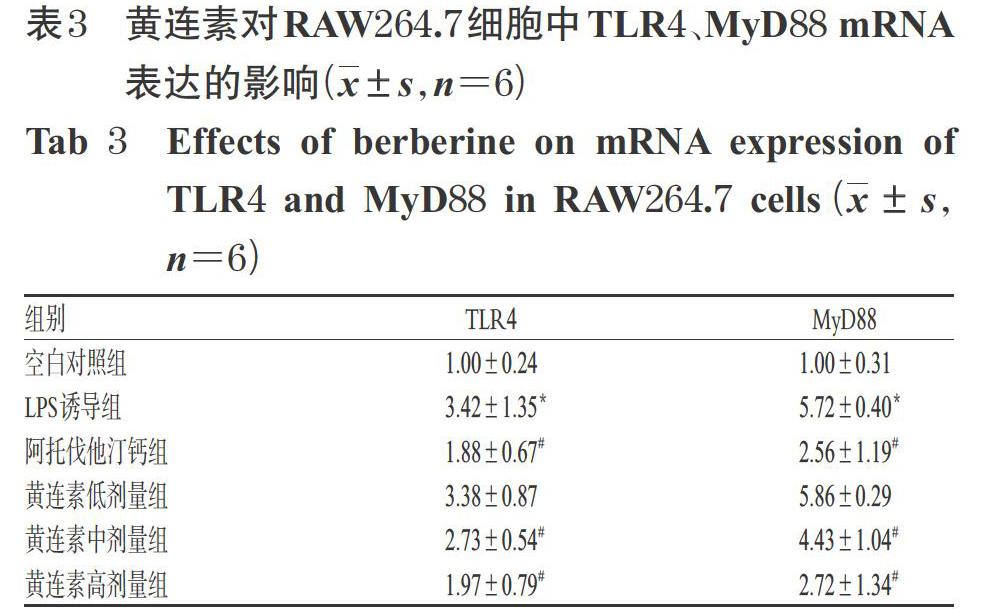
3.2 黄连素对RAW264.7细胞中TLR4、MyD88 mRNA表达的影响
与空白对照组比较,LPS诱导组细胞中TRL4、MyD88 mRNA的相对表达量均显著升高(P<0.05);与LPS诱导组比较,阿托伐他汀钙组和黄连素中、高剂量组细胞TRL4、MyD88 mRNA的相对表达量均显著降低(P<0.05),但黄连素高剂量组上述指标与阿托伐他汀钙组比较差异均无统计学意义(P>0.05),详见表3。
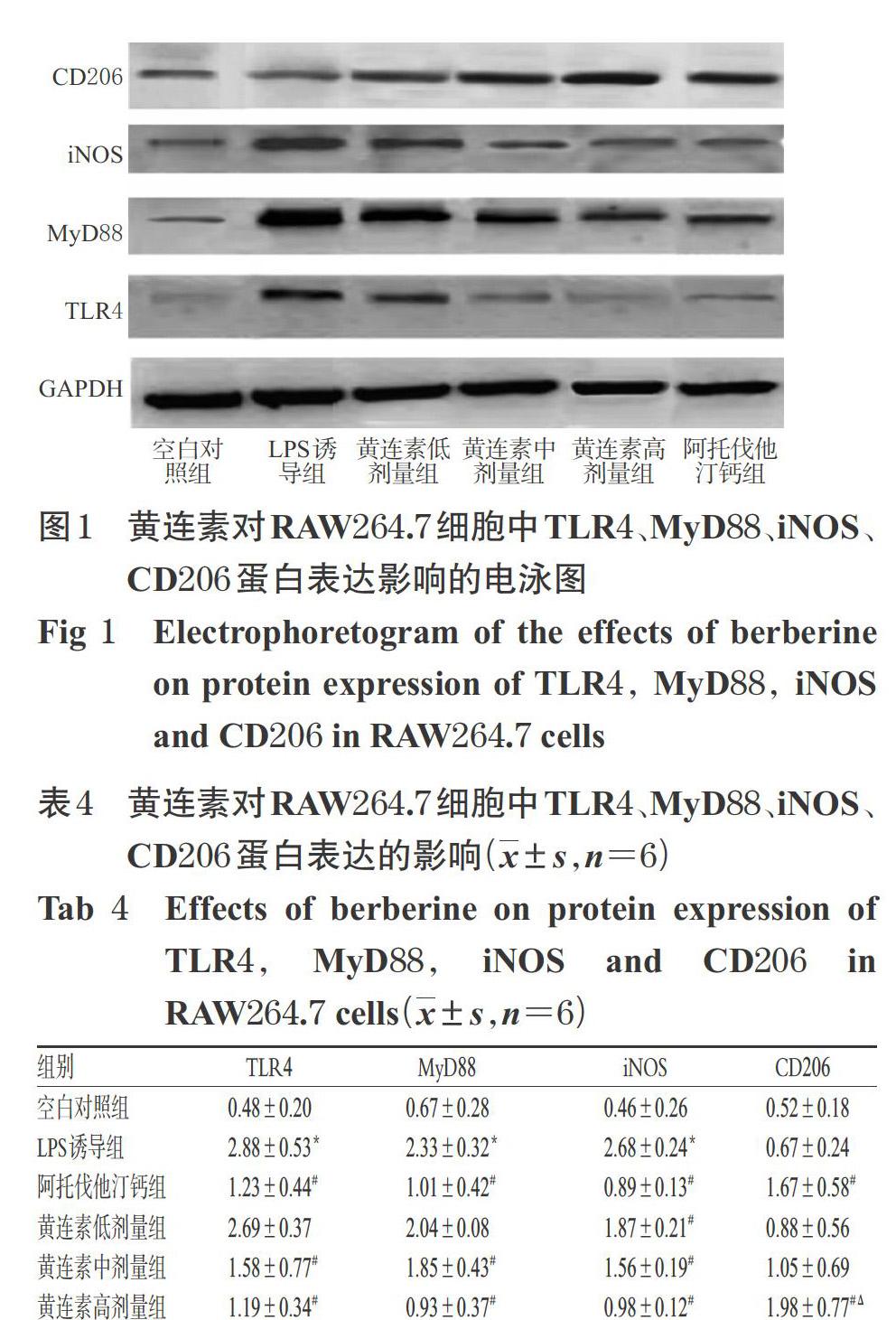
3.3 黄连素对RAW264.7细胞中TLR4、MyD88、iNOS、CD206蛋白表达的影响
与空白对照组比较,LPS诱导组细胞中TLR4、MyD88、iNOS蛋白的相对表达量均显著升高(P<0.05);与LPS诱导组比较,阿托伐他汀钙组和黄连素中、高剂量组TLR4、MyD88蛋白的相对表达量以及各给药组iNOS蛋白的相对表达量均显著降低,阿托伐他汀钙组和黄连素高剂量组CD206蛋白的相对表达量均显著升高,且黄连素高剂量组CD206蛋白的相对表达量显著高于阿托伐他汀钙组(P<0.05),详见图1、表4。
4 讨论
冠状动脉粥樣硬化性心脏病(CHD)简称“冠心病”,AS是其主要病因之一[13]。关于AS的发病机制,目前已有炎症学说、脂质浸润学说、内皮损伤-反应学说、平滑肌细胞克隆学说等多种学说[1,14-15]。其中,由Ross R[1,15]提出的炎症学说受到学者的普遍关注,现已成为学界共识[16]。炎症反应可按致炎物质分为生物性炎症、免疫性炎症和化学性炎症[16]。在各种炎症反应中,巨噬细胞在细胞因子的刺激下释放炎症因子,后者参与炎症级联反应,与AS早期形成密切相关[3,17]。有研究指出,巨噬细胞在不同诱因下可被活化,生成两种极化分型,即M1型和M2型。M1型巨噬细胞主要分泌TNF-α、IL-6等促炎因子,促进AS的发生;M2型巨噬细胞主要产生抗炎因子并促进血管新生,可减轻炎症反应、增加斑块的稳定性[4,18-19]。此外有研究发现,AS斑块组织中同时存在M1和M2型巨噬细胞,且两种分型细胞的比例与CHD患者病情的严重程度相关[20-21]。然而,M1和M2型巨噬细胞的比例并非一成不变,因巨噬细胞可塑性高,即便已经极化,不同分型之间仍可相互转化[22],故可通过调节二者的比例来改善AS患者的转归与预后。由此可见,寻找可调节巨噬细胞极化的药物已成为AS防治研究的新热点之一。
黄连素是从黄连等药用植物中提取的活性生物碱类成分,可通过抑制血小板聚集、调节一氧化氮和一氧化氮合酶、减少活性氧、抑制炎症因子的生成等途径来保护血管[23]。AS的病理过程较为复杂,而近年来有关黄连素抗AS的研究亦是从多机制、多靶点进行阐述:Wang Q等[24]认为,黄连素可通过激活腺苷一磷酸活化蛋白激酶(AMPK)而加速低密度脂蛋白(LDL)受体的表达,从而降低AS模型小鼠的脂质代谢;侯宏等[25]研究发现,黄连素可降低机体血脂水平以减轻AS斑块病变程度;陈略等[26]研究发现,黄连素可通过促进平滑肌细胞在受损内膜中的增殖来延缓AS的进展;Zhu L等[27]研究发现,黄连素可通过调节肠道菌群、增加益生菌来促进代谢紊乱的恢复,从而改善模型小鼠的AS症状。但目前少有研究从巨噬细胞极化这一方面进行探讨。为此,本研究以小鼠巨噬细胞RAW264.7为对象,初步探讨了黄连素对巨噬细胞极化的影响。
阿托伐他汀钙具有调脂、稳斑的作用,已被广泛应用于AS及其相关疾病的临床治疗中,且亦有研究证实该药具抗炎、抗血小板等生物活性[28],因此本研究选用阿托伐他汀作为阳性对照药物。LPS是一种内毒素,其所致炎症模型是最常见的炎症模型。LPS可与位于细胞表面的TLR4结合,活化的TLR4可通过MyD88依赖途径,激活大量的NF-κB,进而促进巨噬细胞极化调控[29];同时,LPS还可刺激巨噬细胞分泌炎症因子TNF-α、IL-6,上述炎症因子的基因调控区均包含NF-κB的结合位点[30]。NF-κB为一种蛋白因子,可多向转录以调控机体免疫功能,其介导的炎症反应可促进AS的发生与发展[31]。本研究结果显示,经LPS诱导后,细胞培养液中TNF-α、IL-6、NF-κB含量以及细胞中TRL4、MyD88蛋白及其mRNA的相对表达量均较空白对照组显著升高;经药物预处理后,阿托伐他汀钙组和黄连素中、高剂量组TNF-α、IL-6含量,TRL4、MyD88蛋白及其mRNA的相对表达量以及各给药组NF-κB含量均显著降低,且高剂量组NF-κB含量显著低于阿托伐他汀钙组。这提示黄连素可降低炎症模型细胞的炎症因子含量,且高剂量黄连素对NF-κB的下调作用优于阳性对照药物;该作用可能与调控TLR4/MyD88/NF-κB信号通路有关。
在非活化状态下,NF-κB通常以其p50亚基/p65亚基异二聚体的形式与NF-κB抑制蛋白结合后被激活,然后与抑制蛋白解离并进入细胞[32]。在激活NF-κB的同时,NF-κB通路可启动iNOS转录,释放一氧化氮,故iNOS可作为M1型巨噬细胞的标志物[33];CD206在M2型巨噬细胞中呈高表達,是M2型巨噬细胞的标志因子,具有较高的特异性[34];二者的表达高低反映了巨噬细胞主要的极化分型。本研究结果显示,经LPS诱导后,细胞中iNOS蛋白的相对表达量较空白对照组显著升高。经药物预处理后,各给药组细胞中iNOS蛋白的相对表达量均显著降低,阿托伐他汀钙组和黄连素高剂量组细胞中CD206蛋白的相对表达量均显著升高,且高剂量组CD206蛋白的相对表达量显著高于阿托伐他汀钙组。这提示各剂量的黄连素均可下调iNOS的表达;高剂量的黄连素可上调CD206的表达,且作用强于阳性对照组。这初步证实了黄连素抑制M1型巨噬细胞极化、促进M2型巨噬细胞极化的作用。
综上所述,黄连素抗AS的机制可能与通过调控TLR4/MyD88/NF-κB信号通路,抑制M1型巨噬细胞极化、促进M2型巨噬细胞极化,从而发挥抗炎作用有关。但其具体作用机制有待后续研究进一步验证和完善。
参考文献
[ 1 ] ROSS R. Atherosclerosis is an inflammatory disease[J]. Am Heart J,1999,138(5 Pt 2):S419-S420.
[ 2 ] LEGEIN B,TEMMERMAN L,BIESSEN EAL,et al. Inflammation and immune system interactions in atherosclerosis[J]. Cell Mol Life Sci,2013,70(20):3847-3869.
[ 3 ] 王新,李春阳,苏平,等. 动脉粥样硬化发病机制及治疗的研究进展[J].实用心脑肺血管病杂志,2017,25(2):1-4.
[ 4 ] JETTEN N,VERBRUGGEN S,GIJBELS MJ,et al. Anti- inflammatory M2,but not pro-inflammatory M1 macrophages promote angiogenesis in vivo[J]. Angiogenesis,2014,17(1):109-118.
[ 5 ] ZHANG Q,LENARDO MJ,BALTIMORE D. 30 years of NF-κB:a blossoming of relevance to human pathobiology[J]. Cell,2017,168(1/2):37-57.
[ 6 ] CHIANG CF,CHAO TT,SU YF,et al. Metformin-treated cancer cells modulate macrophage polarization through AMPK-NF-κB signaling[J]. Oncotarget,2017,8(13):20706-20718.
[ 7 ] CHENG N,LIANG Y,DU X,et al. Serum amyloid A promotes LPS clearance and suppresses LPS-induced inflammation and tissue injury[J]. EMBO Rep,2018. DOI:10. 15252/embr.201745517.
[ 8 ] TAKEDA K,AKIRA S. Toll-like receptors[J]. Curr Protoc Immunol,2015. DOI:10.1002/0471142735.im1412s- 109.
[ 9 ] BARTON GM,MEDZHITOV R. Toll-like receptor signa- ling pathways[J]. Science,2003,300(5625):1524-1525.
[10] JEONG HW,HSU KC,LEE JW,et al. Berberine suppresses proinflammatory responses through AMPK activation in macrophages[J]. Am J Physiol Endocrinol Metab,2009,12(9):E955-E964.
[11] FAN X,WANG J,HOU J,et al. Berberine alleviates ox- LDL induced inflammatory factors by up-regulation of autophagy via AMPK/mTOR signaling pathway[J]. J Transl Med,2015. DOI:10.1186/s12967-015-0450-z.
[12] 张选明,安冬青,张华,等.芳香新塔花总黄酮对脂多糖诱导的RAW264.7细胞分泌炎症因子的影响及机制[J].辽宁中医杂志,2020,47(2):158-161、221.
[13] 葛均波,徐永健,王辰.内科学[M]. 9版.北京:人民卫生出版社,2018:218.
[14] 陈臻毅,徐强,梁自豪,等.动脉粥样硬化发病机制及其动物模型研究进展[J].实验动物科学,2015,32(4):54-58.
[15] ROSS R. The pathogenesis of atherosclerosis:an update[J]. N Engl J Med,1986,314(8):488-500.
[16] 刘俊田.动脉粥样硬化发病的炎症机制的研究进展[J]. 西安交通大学学报(医学版),2015,36(2):141-152.
[17] 阎雨,何阳阳,方莲花,等.巨噬细胞在动脉粥样硬化中的研究进展[J].中国药学杂志,2014,49(1):7-10.
[18] RAHMAN K,VENGRENYUK Y,RAMSEY SA,et al. Inflammatory Ly6Chi monocytes and their conversion to M2 macrophages drive atherosclerosis regression[J]. J Clin Invest,2017,127(8):2904-2915.
[19] LIU YC,ZOU XB,CHAI YF,et al. Macrophage polarization in inflammatory diseases[J]. Int J Biol Sci,2014,10(5):520-529.
[20] BOUHLEL MA,DERUDAS B,RIAGMONTI E,et al. PPARgamma activation primes human monocytes into alternative M2 macrophage with anti-inflammatory properties[J]. Cell Metab,2007,6(2):137-143.
[21] HITARA Y,TABATA M,KUROBE H,et al. Coronary atherosclerosis is associated with macrophage polarization in epicardial adipose tissue[J]. J Am Coll Cardiol,2011,58(3):248-255.
[22] 祝甜甜,段菊,张刘强,等.巨噬细胞极化在动脉粥样硬化中的作用和药物靶标[J].中国药理学通报,2014,30(6):748-751.
[23] 胡诚毅,莫志贤.黄连素的药理作用及机制研究进展[J].中国实验方剂学杂志,2017,23(20):213-219.
[24] WANG Q,ZHANG M,LIANG B,et al. Activation of AMP-activated protein kinase is required for berberine-induced reduction of atherosclerosis in mice:the role of uncoupling protein 2[J]. PLoS One,2011. DOI:10.1371/journal.pone.0025436.
[25] 侯宏,孙胜亮,黄静,等.黄连生物碱抗高脂血症及动脉粥样硬化实验研究[J].时珍国医国药,2011,22(10):2462-2464.
[26] 陈略,朱飞奇,刘纯钢,等.盐酸小檗碱联合阿托伐他汀对脑梗死患者血脂水平和颈动脉粥样硬化斑块的影响[J].中国神经精神疾病杂志,2014,40(6):348-352.
[27] ZHU L,ZHANG D,ZHU H,et al. Berberine treatment increases Akkermansia in the gut and improves high-fat diet-induced atherosclerosis in Apoe-/- mice[J]. Atherosclerosis,2018. DOI:10.1016/j.atherosclerosis.2017.11. 023.
[28] 胡小菁,迟丽屹,张文韬,等.动脉粥样硬化炎症机制及阿托伐他汀药物多样性的研究进展[J].心血管病学进展,2014,35(2):261-265.
[29] XING J,LI R,LI N,et al. Anti-inflammatory effect of procyanidin B1 on LPS-treated THP1 cells via interaction with the TLR4-MD-2 heterodimer and p38 MAPK and NF-κB signaling[J]. Mol Cell Biochem,2015,407(1/2):89-95.
[30] RITCHIE MH,FILLMORE RA,LAUSCH RN,et al. A role for NF-kappa B binding motifs in the differential induction of chemokine gene expression in human corneal epithelial cells[J]. Invest Ophthalmol Vis Sci,2004,45(7):2299-2305.
[31] WANG XM,CHEN QJ,PU HW,et al. Adiponectin improves NF-κB-mediated inflammation and abates atherosclerosis progression in apolipoprotein E-deficient mice[J]. Lipids Health Dis,2016. DOI:10.1186/s12944-016- 0202-y.
[32] 王曉晨,吉爱国. NF-κB信号通路与炎症反应[J].生理科学进展,2014,45(1):68-71.
[33] 高源.大黄酸在LPS活化巨噬细胞中发挥抗炎与促炎双向作用的机制研究[D].北京:北京协和医学院,2014.
[34] 钱志英. IL-4对LPS致炎小鼠子宫M2型巨噬细胞的诱导及其抗炎作用机理研究[D].新乡:河南师范大学,2016.
(收稿日期:2020-01-21 修回日期:2020-05-28)
(编辑:张元媛)

