壳聚糖-苄基脲衍生物手性固定相的制备与性能
张宇航,熊金辉,何保江,郝菊芳,柏正武*
1.武汉工程大学化学与环境工程学院,湖北 武汉430205;
2.中国烟草总公司郑州烟草研究院,河南 郑州450001;
3.中国烟草总公司职工进修学院,河南 郑州450008
多糖分子具有高度有序的螺旋结构,其衍生物可用来制备高效液相色谱的手性固定相(chiral stationary phase,CSP)[1-2]。在1973年,Hesse和Hagel[3]合成了微晶纤维素三乙酸酯,发现其在高效液相色谱中有一定的手性识别能力。而后,相继出现了用各种不同纤维素酯制备高效液相色谱中CSP的报道[4-6]。目前,已商业化的CSP大多是用纤维素或直链淀粉的衍生物制备的。虽然将纤维素或直链淀粉衍生物涂覆在载体上得到的CSP有良好的手性分离性能,但这些衍生物溶于许多有机溶剂,或在这些溶剂中高度溶胀[7],因而极大地缩小了流动相的适用范围。故此,发掘对有机溶剂耐受性和手性分离能力都很强的多糖衍生物固定相仍然是一项重要的研究工作。
因与纤维素有相似的一级结构,近几年壳聚糖也被用来制备手性分离材料[8-10]。而且发现一些用壳聚糖-3,6-二(芳香基氨基甲酸酯)-2-酰胺和壳聚糖-3,6-二(芳香基氨基甲酸酯)-2-脲制备的CSP有很好的手性识别能力,且在绝大多数流动相中有很好的耐受性能[11-13]。相较于纤维素-三(苯甲酸酯)和纤维素-三(苯基氨基甲酸酯),壳聚糖衍生物2-位上是酰胺或脲,而不是氨基甲酸酯,酰胺或脲应该形成了更强的氢键,使相应的衍生物难以溶解于一般的有机溶剂。因此,用壳聚糖衍生物制备CSP能提高其对流动相的耐受性能。在本文工作中,用壳聚糖(脱乙酰度约为98.3%)制备一种新的手性选择体(chiral selector,CS),即壳聚糖-3,6-二(3,5-二甲基苯甲酸酯)-2-苄基脲(CS1),并将其涂覆于7μm的大孔氨丙基硅胶上,制备成CSP1,讨论流动相的组成以及外消旋体的结构对CSP1手性分离能力的影响。
1 实验部分
1.1 试剂与仪器
壳聚糖按文献[14-15]方法制备,其粘均分子量为1.4×105[16],以1H NMR测得脱乙酰度约为98.3%;3,5-二甲基苯甲酰氯(阿拉丁试剂有限公司);苄胺(安耐吉化学);N,N-二甲基乙酰胺(N,N-dimethylacetamide,DMAc)、N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)等其它试剂均购自国药集团化学试剂有限公司。
红外光谱仪(Bruker TENSOR 27,德国Bruker公司);元素分析仪(Elemental Vario EL III CHNOS,德国Elementar公司);核磁共振仪(Bruker AVANCE III 600 MHz,瑞士Bruker公司);高效液相色谱仪(Waters e 2695,美国Waters公司)。
1.2 手性选择体的制备
将1.50 g(9.32 mmol重复单元)壳聚糖加入到20 g 0.8%(质量分数)的稀盐酸中,搅拌至完全溶解后加入约20 g甲醇。冰水浴冷却,当溶液温度低于8℃时,加入2.02 g(18.61 mmol)氯甲酸乙酯。8℃下反应15 min后,再间歇加入1.88 g(18.60 mmol)三乙胺与10 g甲醇的混合溶液,使反应体系的pH值维持在6~7之间,再于4~5℃下搅拌7 h。将反应混合物倾入乙醇溶液中,搅拌2 h,过滤,用乙醇洗至中性,干燥,得乙氧基羰基壳聚糖,产率:86%。此产物未经纯化可直接用于下一步反应。
取1.50 g干燥的氯化锂溶于干燥的15 mL DMAc中,在80℃下加入1.00 g(4.27 mmol重复单元)乙氧基羰基壳聚糖,待溶解后冷却至室温。向溶液中加4.61 g(43.02 mmol)苄胺,搅拌均匀后将反应液倒入反应釜中,以4-二甲氨基吡啶为催化剂,120℃下反应12 h。将粗产物与乙醇相混合,碾碎凝胶状固体,用乙醇反复洗涤,干燥,得到壳聚糖-苄基脲,产率:93%。1H NMR(600 MHz,CF3COOD,25℃,δ):7.80~7.19(5H,Ph-H),5.37~3.50(9H,氨基葡萄糖骨架H和苄基中的CH2);IR(KBr,cm-1)υ:3 472,3 336(-OH,-NH-),3 064,3 030,795,745(Ph-),2 929,2 872(-C-H),1 645~1 566(-CONH-);EA(%):Calcd(C14H18N2O5·0.9H2O)nC:54.15,H:6.43,N:9.02,Found C:54.62,H:6.54,N:8.49。
取2.00 g干燥的氯化锂溶于20 mL干燥的DMAc中,在90℃下加入1.50 g(5.34 mmol重复单元)壳聚糖-苄基脲和催化量的4-二甲氨基吡啶,搅拌使之完全溶解。向此溶液中加入4.33 g 3,5-二甲基苯甲酰氯(25.68 mmol),搅拌约15 min后,再加入2.60 g三乙胺(25.69 mmol),于90℃下反应30 h。反应结束后,先过滤除去反应液中的三乙胺盐酸盐,再将澄清滤液逐滴滴加到200 mL甲醇中,得到白色沉淀。将干燥后的固体溶解在20 mL DMF中,用150 mL甲醇重沉淀。反复重沉淀,直至滤液经薄层色谱检测显示无残留物质为止。将固体干燥至恒重,得到壳聚糖-3,6-二(3,5-二甲基苯甲酸酯)-2-苄基脲,即CS1,产率:74%。IR(KBr,cm-1)υ:3 391~3 316(-CONH-),3 100,2 949,2 928(-C-H),1 724,1 268(-CO-),1 603(-Ph);EA(%):Calcd(C32H34N2O7·1.2H2O)nC:66.24,H:6.32:N:4.83,Found C:65.49:H:6.70:N:5.67。
1.3 手性固定相的制备与填充
按照文献方法[11],将CS1以质量分数20%涂覆在3-氨基丙基硅胶上[17],制备成CSP1。本文所涉及的色谱参数包括:容量因子(k),分配因子(α)和分离度(Rs)。k1=(t1-t0)/t0,k2=(t2-t0)/t0,α=k2/k1,Rs=2(t2-t1)/(w1+w2),其中t0为1,3,5-三叔丁基苯的保留时间,t1和t2分别是先后被洗脱的对映体的保留时间,w1和w2是两对映体的峰底宽。k反映CSP与分析物相互作用的强弱,α及Rs则反映CSP的分离性能。
2 结果与讨论
2.1 壳聚糖衍生物的表征
壳聚糖与氯甲酸乙酯反应后生成了乙氧基羰基壳聚糖,在其IR谱图上出现了乙氧基羰基(1 704 cm-1)和酰胺Ⅱ带(1 555 cm-1)的吸收峰,而在1 750 cm-1附近未出现酯羰基峰,说明氯甲酸乙酯只选择性地与壳聚糖中的氨基反应,不与羟基反应。壳聚糖-苄基脲的红外光谱图出现酰胺Ⅰ(1 645 cm-1)和酰胺Ⅱ(1 566 cm-1)的特征吸收峰,乙氧基羰基峰消失,证明胺酯交换反应较彻底。图1为壳聚糖-苄基脲的1H NMR谱图,图中化学位移δ=5.37~3.50处的峰为壳聚糖骨架的质子峰和苄基上亚甲基的质子峰,δ=7.80~7.19处的峰为苄基中苯环上的质子峰,这两组峰的积分面积比约为9∶5,而氯甲酸乙酯和苄胺只选择性地与壳聚糖的氨基反应,因此可认为壳聚糖-苄基脲几乎为完全脲基化产物。考虑到壳聚糖-苄基脲的吸湿性,壳聚糖-苄基脲元素分析的拟合值分别是C:54.15,H:6.43,N:9.02,而实际测得值为C:54.62,H:6.54,N:8.49,两者相吻合。相似地,所制备的壳聚糖-3,6-二(3,5-二甲基苯甲酸酯)-2-苄基脲的元素分析拟合值与其实测值也相吻合。
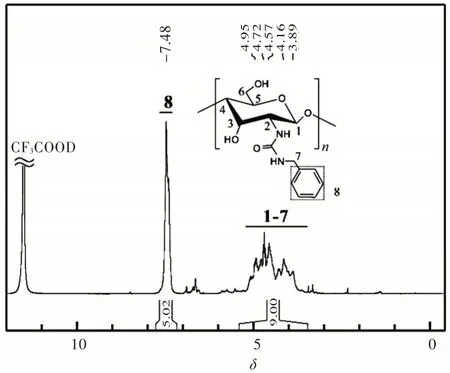
图1壳聚糖-苄基脲的1H NMR谱图(600 MHz,CF3COOD,25℃)Fig.1 1H NMR spectrum of chitosan benzylurea(600 MHz,CF3COOD,25℃)
2.2 CSP1的手性分离性能
以联苯为分析物,用高效液相色谱测得填充着CSP1色谱柱的对称因子为1.06,柱效为3.23×104理论塔板数/米。用19种手性化合物(图2)为样品,在三种流动相中对CSP1的手性识别性能进行了评估,分离结果如表1所示。由表1可知,CSP1共识别了13个手性样品(α>1.0),基线分离了其中的9个(Rs≥1.50)。如手性样品7、9和11的对映体在CSP1上均得到较好的分离,其色谱图如图3所示。
多糖衍生物类CSP能识别手性化合物对映体的关键原因是手性选择体(本文中的CS1)与手性化合物之间存在π-π、氢键、偶极-偶极和空间位阻等相互作用,以及多糖衍生物本身所具有的高度有序的螺旋结构。手性化合物上的取代基对手性识别有很大的影响,如与2号化合物相比,18号化合物的苯环对位上多了一个甲基,18号化合物能在CSP1上得到基线分离,而2号化合物仅能被识别,这可能是因为甲基增强了羰基中氧原子的电子云密度,18号化合物更容易与CS1形成氢键,使18号化合物在CSP1上的分离度更大。对于含有苯甲醇结构的手性化合物,CSP1不能识别8、13、15、16号化合物,但是却能基线分离11号化合物,这可能是由于11号化合物中咪唑环上的氮原子与CS1中的酰胺形成较强的氢键所致。此外,CS1螺旋结构的形状及大小与手性样品分子是否匹配对手性识别也应有影响。
2.3 流动相对手性分离性能的影响
从分离结果可看出,CSP1在正己烷/乙醇(90/10,体积比,下同)流动相中的手性分离能力最强,能够识别12个手性化合物对映体,基线分离9个;在正己烷/乙醇/甲醇(90/5/5)流动相中分离能力较差,仅识别8个手性化合物对映体,基线分离5个;大多数手性化合物对映体在正己烷/异丙醇(90/10)中的分离度最大,这可能是由流动相中醇的黏度和极性不同引起的。异丙醇黏度较大,使手性样品扩散速度变慢,对手性样品与CS1之间的相互作用有利,而当流动相的极性增强时(如含甲醇),手性样品与流动相之间的作用也增强,这就减弱了手性样品与CS1之间的相互作用。从表1中可以看出,手性样品在CSP1上的k1值随流动相的黏度降低和极性增强而减小,这一现象与上述的推论相符合,只有手性样品与CS1之间有足够的相互作用,才有可能发生手性识别。因此,对于相同的手性样品在不同的流动相的条件下会有不同的分离结果,如在CSP1上,1号、3号、17号和18号在正己烷/异丙醇(90/10)和正己烷/乙醇(90/10)中都能被识别,甚至基线分离,而在正己烷/乙醇/甲醇(90/5/5)中不能被识别。

图2手性化合物的结构式Fig.2 Structures of chiral analytes
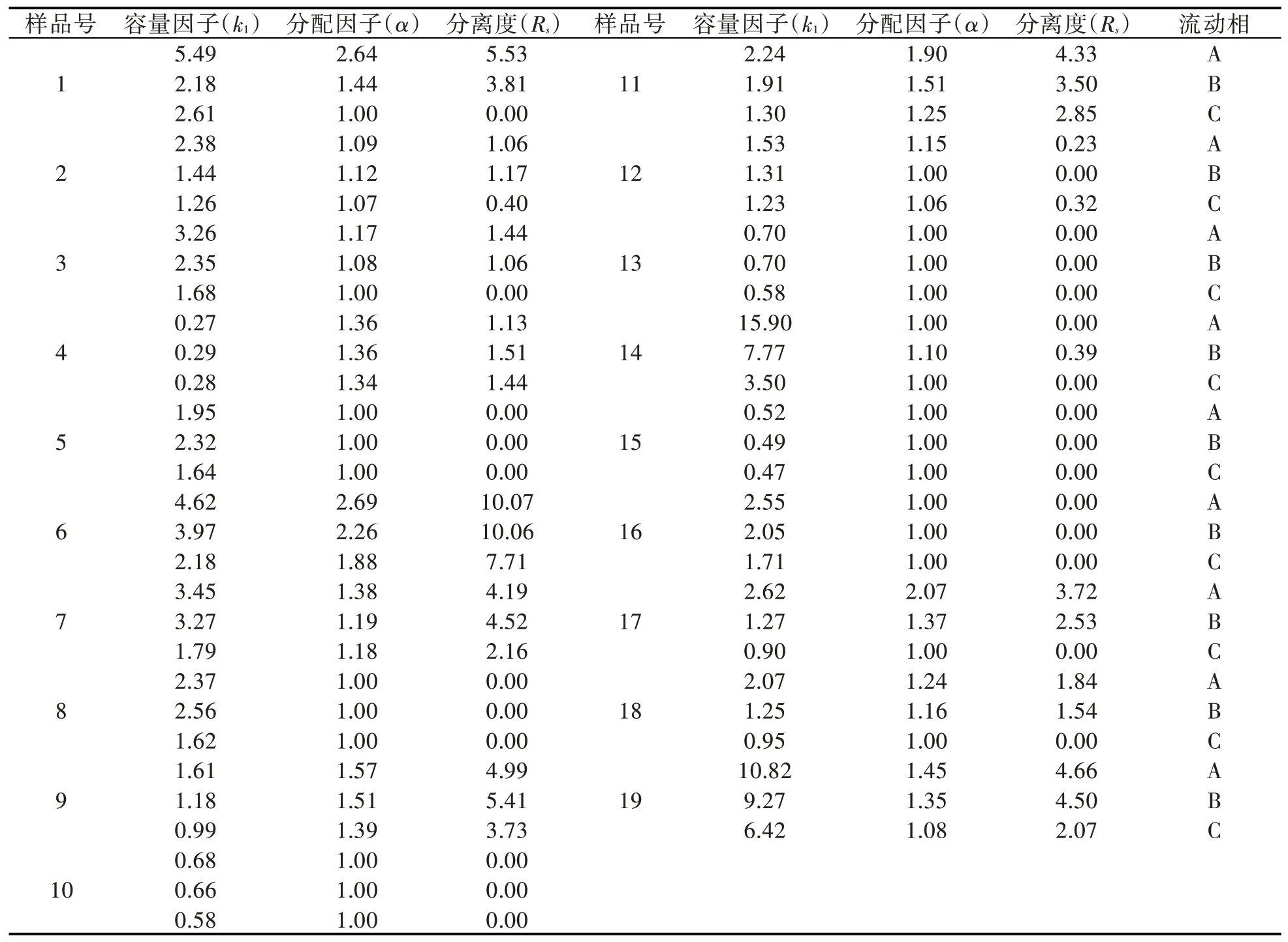
表1 CSP1的手性分离性能Tab.1 Enantioseparation capability of CSP1

图3分析物7、9和11号在CSP1上的分离色谱图[流动相:正己烷/乙醇(90/10)]Fig.3 Chromatograms of analytes 7,9 and 11 separated by CSP1[Mobile phase:n-hexane/ethanol(90/10)]
3 结论
本文选择性地修饰壳聚糖上的氨基得到壳聚糖-苄基脲,再用3,5-二甲基苯甲酰氯修饰壳聚糖-苄基脲上的羟基,制得一种新的手性分离材料,即壳聚糖-3,6-二(3,5-二甲基苯甲酸酯)-2-苄基脲。用这种壳聚糖衍生物为手性选择体,将其涂覆在3-氨基丙基硅胶上制成CSP1,在3种正相模式下,用高效液相色谱分离19种手性分析物对映体,以此评价其手性分离能力。结果显示CSP1对化合物6、11和19等药物或药物中间体,以及一些含酰胺和脲基官能团的化合物(如化合物1、17和18)有很好的分离性能,而对含1-苯基乙醇结构的手性化合物分离效果相对较差。比较在不同流动相条件下CSP1对19种手性化合物的分离结果,发现在正己烷/乙醇(90/10)中CSP1的手性分离性能最好,而在正己烷/异丙醇(90/10)中的分离度最大。

