过表达miR-22-3p抑制肝癌Li-7细胞增殖、迁移和上皮间质转化
刘长兵,胡惠贞,黄海良
(1.宣城职业技术学院医护学院,安徽 宣城 242000;2.安徽卫生健康职业学院基础教学部,安徽 池州 247100;3.安徽医科大学生物化学与分子生物学教研室,安徽 合肥 230032)
肝癌在全球癌症发病率中居于第六位,其在癌症死亡率中高居第四位[1]。肿瘤细胞的转移是导致患者预后不佳和复发率高的最主要因素,该过程涉及很多内外因素[2]。因此,深入探寻影响及决定肝癌早期转移的分子机制对肝癌的临床治疗具有重要作用。
MicroRNAs(miRNAs)属于内源性非编码RNA,主要在转录后或翻译水平靶向调控目标基因表达而发挥生物学功能[3-4]。研究证实,MiR-22的表达失调与前列腺癌、乳腺癌、胆管癌、肝癌和多发性骨髓瘤均具有相关性[5-6]。然而,miR-22失调在肿瘤发生发展中的作用及机制仍然难以捉摸。因此,我们通过构建miR-22过表达载体并进一步研究miR-22对肝癌的影响,为深入研究其生物学功能奠定基础。
1 材料与方法
1.1 材料dulbecco's modified eagle medium(DMEM)细胞培养液、胎牛血清(美国Gibico公司);RNA提取试剂盒、反转录试剂盒(Thermo Fisher公司);Real-time PCR试剂盒(宝日医生物技术(北京)有限公司);GAPDH、Bcl-2、Bax、E-cadherin、N-cadherin、Vimentin和β-catenin抗体(美国Santa Cruz公司);蛋白提取及定量试剂盒、CCK8细胞增殖检测试剂盒(上海碧云天生物技术研究所);ECL检测试剂盒(美国Affinity公司);miR-22-3p过表达质粒(上海吉凯基因化学技术有限公司);Li-7细胞株(中科院上海细胞库)。
1.2 方法
1.2.1 miR-22-3p过表达细胞株建立 Li-7细胞置于37℃,5%CO2恒温细胞培养箱中进行培养,隔天换液、观察细胞状态,待细胞铺满培养瓶时进行传代。按1×106/mL的标准将细胞接种于6孔培养板,并按照lipofectamine 3000操作说明进行细胞转染,实验设置正常对照组(N)、阴性对照组(GV251/NC)和miR-22-3p过表达组(GV251/miR-22-3p)。转染8h后按1∶4进行细胞传代,同时加入浓度为200μg/mL G418筛选出miR-22-3p过表达细胞株。
1.2.2 Real-time PCR Trizol法裂解并提取细胞总RNA,定量后以此为模板参照反转录试剂盒说明书进行反转录操作。具体反转录程序设置如下:65℃,5min;42℃,60min;70℃,5min。反应产物即为cDNA,-20℃保存备用。以上述反应产物为模板,应用ABI 7500型Real-time PCR仪按下述反应程序:95℃5s,60℃34s,设置循环数为40,检测各目的基因Ct值。分析miR-22-3p时以U6为内参,其它基因均以GAPDH作为内参,采用2-△△Ct法分析各基因的相对表达量。引物序列见表1。

表1 Real-time PCR引物序列
1.2.3 Western blot 参照RIPA(强)细胞裂解液试剂盒说明书提取细胞总蛋白,BCA法定量并将各样品蛋白浓度调整一致。按照SDS-PAGE操作进行电泳,湿法转膜后,应用封闭工作液室温封闭2.0h,TBST洗膜3min。参考抗体说明书进行抗体稀释,4℃孵育过夜,TBST洗膜3次,每次5min。相应的IgG二抗室温孵育1.5h,TBST洗膜3次,每次10min;ECL发光、显影、曝光。应用Quantity One灰度分析软件检测各蛋白条带灰度值,以GAPDH为内参,各蛋白的相对表达量=目的蛋白灰度值/GAPDH灰度值。
1.2.4 CCK8实验 调整细胞状态至对数生长期,然后按2×103/孔的量将其接种于96孔细胞培养板,按照CCK8细胞增殖检测试剂盒说明书进行相应操作,分别与细胞培养后0h、24h、48h和72h加入10μL CCK8,并使用酶标仪于450nm波长检测各组细胞的吸光度值,并计算出相应的细胞增殖率。
1.2.5 细胞划痕实验 根据检测时效安排,将生长状态良好的细胞按1×106/孔的量接种于6孔细胞培养板,待细胞汇合度为60%时应用Φ1.0μm的细胞划痕器垂直于细胞培养板在每孔划出3条平行线,DMEM培养基洗去脱落细胞,倒置显微镜下观察、拍照,即为0h细胞划痕宽度。然后继续培养24和48h,并分别进行拍照。应用Image Pro Plus 6.0软件测量每孔多个点划痕间距,计算细胞迁移率,即细胞迁移率=(划痕宽度0h-划痕宽度24h/48h)/划痕宽度0h。
1.3 统计学处理采用SPSS 17.0进行统计分析,数据结果以“均数±标准差”表示,组间比较采用F检验和t检验,P<0.05为差异有统计学意义。每组实验均重复3次。
2 结果
2.1 miR-22-3p过表达细胞株的建立经过8周浓度为200μg/mL的G418筛选后,成功建立miR-22-3p过表达Li-7细胞株。Real-time PCR检测表明,N组、GV251/NC组和GV251/miR-22-3p组miR-22-3p的表达水平分别为(1.076±0.210)、(1.083±0.222)和(32.401±4.668)。见图1。
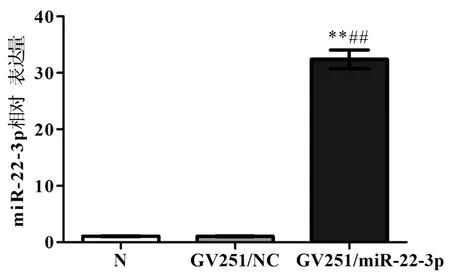
图1 Real-time PCR检测miR-22-3p表达
2.2 miR-22-3p过表达对Li-7细胞增殖能力的影响CCK8实验检测及分析结果表明,与N组和GV251/NC组相比,GV251/miR-22-3p组在48h、72h和96h细胞增殖率均显著降低,差异有统计学意义(F=1.277,P<0.01;F=3.443,P<0.01;F=5.278,P<0.01)。见图2。
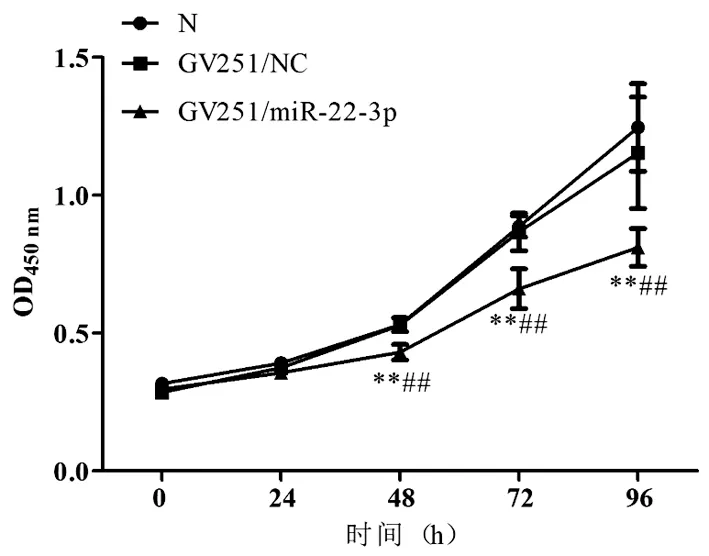
图2 CCK8检测细胞增殖能力
2.3 miR-22-3p过表达对Li-7细胞迁移能力的影响测量0h和48h两组细胞划痕宽度,比较分析不同组别细胞在48h的迁移率。结果显示,与N、GV251/NC组相比,GV251/miR-22-3p组细胞迁移率明显降低,迁移能力显著减弱(F=5.843,P<0.01)。见图3。

图3 细胞划痕实验检测细胞迁移能力
2.4 miR-22-3p过表达对Bcl-2和Bax表达的影响经Real-time PCR和Western blot检测及统计分析表明,与N组和GV251/NC组相比,GV251/miR-22-3p组Bcl-2基因mRNA和蛋白表达均显著降低(F=2.175,P<0.01;F=5.789,P<0.01),而Bax基因mRNA和蛋白表达则明显升高(F=6.737,P<0.01;F=1.674,P<001)。见图4。

图4 Real-time PCR和Western blot检测Bcl-2和Bax表达
2.5 miR-22-3p过表达对EMT标志性基因mRNA表达的影响Real-time PCR分析结果表明,与N组和GV251/NC组相比,GV251/miR-22-3p组上皮标志性基因E-cadherin和β-catenin的mRNA表达均显著升高(F=17.520,P<0.01;F=43.920,P<0.01),同时间质标志性基因N-cadherin和Vimentin的mRNA表达则明显降低(F=3.332,P<0.01;F=3.981,P<0.01)。见图5。
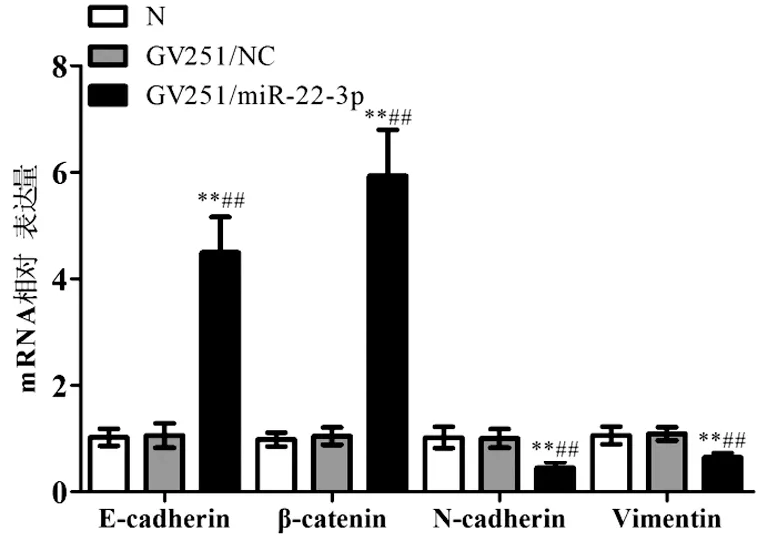
图5 Real-time PCR检测EMT标志性基因mRNA的表达
2.6 miR-22-3p过表达对EMT标志性基因蛋白表达的影响Western blot检测及灰度结果分析显示:与N组和GV251/NC组相比,GV251/miR-22-3p组上皮标志性基因E-cadherin和β-catenin的蛋白表达均显著升高(F=2.124,P<0.01;F=2.810,P<0.01),同时间质标志性基因N-cadherin和Vimentin的蛋白表达则明显降低(F=6.360,P<0.01;F=1.249,P<0.01)。见图6。

图6 Western blot检测EMT标志性基因蛋白的表达
3 讨论
MiR-22是一种新型的小单链非编码RNA,可靶向调控目标基因的表达进而在转录后或翻译水平发挥生物学功能[7-8]。研究表明,miR-22在不同的肿瘤中可表现出促癌或抑癌的不同效果[9]。Zhang[10]等研究表明,miR-22可通过靶向负调控SIRT1,激活P53及其下游相关基因P21和PUMA,同时通过切割凋亡相关因子Caspase-3和PARP,进而抑制肾细胞癌EMT,降低肿瘤的增殖、侵袭和迁移[7]。Zhang[11]等研究证实,miR-22在肝癌组织中的表达水平显著低于相应的癌旁组织,并且其低表达亦导致患者的预后不良。并且,miR-22可通过靶向调控HDAC4抑制肝癌细胞的增殖和致瘤性。同样,本研究发现过表达miR-22-3p可降低肝癌Li-7细胞的增殖能力。同时,miR-22-3p可抑制Bcl-2的表达及促进Bax的表达,这表明miR-22-3p可通过促进细胞凋亡进而抑制Li-7细胞增殖。
上皮-间质转变(epithelial-mesenchymal transition,EMT)在肿瘤细胞侵袭和迁移方面具有重要的作用,EMT的程度越高细胞的侵袭和迁移能力越强[12-13]。其中,上皮性标志基因E-钙黏蛋白(E-cadherin)和β-链蛋白(β-catenin)降低的程度以及间质性标志基因N-钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)增加的多少是反应EMT的重要指标。EMT可降低肿瘤细胞间的黏附能力,增加肿瘤细胞远处转移和形成转移灶的能力[14-15]。同样,本研究表明过表达miR-22-3p可抑制Li-7细胞EMT,降低细胞的迁移和远处转移能力,将为肝癌的临床治疗提供新思路。
然而,miR-22-3p是如何靶向调控下游基因以及通过哪些信号通路促进Li-7细胞增殖和迁移等仍需要深入研究。

