安徽地区不同规模猪场猪伪狂犬病毒感染情况调查与分析
黄晓慧 耿鹤鸣 李郁*
1.安徽农业大学动物科技学院 230036
2.安徽省合肥市动物疫病预防控制中心 230061
伪狂犬病(PR)是由伪狂犬病病毒(PRV)感染引起的一种以发热、奇痒(猪除外)及脑脊髓炎为主要症状的高度接触性、急性传染病[1-2],我国将其列为二类动物疫病。猪是PRV的传播者和自然宿主[3],不同日龄猪感染PRV后临床症状不同:母猪出现流产或产死胎、木乃伊胎、弱仔等繁殖障碍疾病;新生仔猪表现为发热、腹泻、运动失调并伴有神经症状,死亡率可高达100%;成年猪感染后易发呼吸系统疾病[4]。我国自1947年首次报道以来[5],此病几乎遍布我国大江南北,严重阻碍了我国养猪业的健康发展。PRV主要通过母猪胎盘和公猪精液垂直传播,也可水平传播[6]。伪狂犬病病毒属于双股DNA病毒,为疱疹病毒科成员,动物一旦被其感染,病毒可在动物体内呈长期潜伏感染状态,在受到体内或者外界因素的刺激后,往往可与其他病原体协同作用引起多种疾病的发生,从而引起疫病的爆发[7]。
疫苗免疫接种是控制伪狂犬病的重要手段,目前我国使用最为广泛的是猪伪狂犬病毒gE基因缺失苗[8]。由于疫苗的使用,在近20年来猪伪狂犬病在我国得到有效的控制。自2011年以来,PRV变异毒株的出现导致猪伪狂犬病的发病率有上升趋势[9]。为进一步了解安徽省伪狂犬病毒的感染情况,为防治伪狂犬病作出合理的评估。2013-2017年期间我们陆续收集或采集来自336个猪场的897份样品,对伪狂犬病原进行了调查分析。
1 材料与方法
1.1 材料
1.1.1 样品来源 897份病原检测样品来自安徽地区336个疑似感染PRV野毒的不同规模猪场的不同生长阶段的猪。样品包括病死猪以及病猪精液、血液、脑组织、肾脏、淋巴组织以及明显病变其它脏器组织。样品按照以下猪场规模及猪只生长阶段进行归类分析。
自繁自养型基础母猪数大于3000头为大型猪场,小于1000头为中型猪场,小于100头为小型猪场,小于10头为散养户。
猪只生长划分为六阶段,即哺乳仔猪(1周龄~4周龄)、保育猪(4周龄~8周龄)、育肥猪(9周龄以上)、种公猪、后备母猪及生产母猪。
1.1.2 试剂 DNA提取试剂盒,OMEGA公司产品;2×GC-rich PCR Master Mix、无菌双蒸水(ddH2O),北京天根生物科技公司产品;DNA Marker DL600、DNA Marker DL2000,Takara公司产品。
1.1.3 引物的设计与合成 根据GenBank上登录的PRVgE基因序列(登录号KP098534.1)设计一对特异性 引 物,P1:5’-CCGTGTTCTTTTGGCGGTG-3’,P2:5’-ACCTCCTCGCCGAAGGCGTCGAAG-3’,目的片段大小为423bp,引物由南京金斯瑞生物科技有限公司合成。
1.2 方法
1.2.1 待检病料的准备 主要采集病猪的脑组织、肾脏、淋巴组织以及明显病变其它脏器组织等,研磨后,反复冻融3次,5000r/min离15min,取上清液,置于-20℃保存。
1.2.2 PCR检测 根据OMEGA的Micro Elute Genomic DNA Kit(50)DNA提取试剂盒的操作步骤提取PRV病毒的基因组DNA。提取的DNA直接进行病毒基因检测,反应体系如下:2×Taq plus PCR Master Mix 12.5μL(Taq DNA 聚合酶、dNTPs 、标准Taq反应缓冲液),上游引物1μL,下游引物1μL,DNA模板3μL,ddH2O7.5μL。反应条件为:94℃预变性4min;94℃变性1min;63℃退火1min;72℃延伸 1min,40个循环;72℃延伸10min。取5μL PCR产物进行1%琼脂糖凝胶电泳,利用凝胶成像系统观察试验结果。
1.2.3 结果判定 PCR病原检测结果判定PRV阳性对照出现423bp扩增带,阴性对照无条带出现时,试验结果成立。被检样品出现423bp扩增带为阳性,否则为阴性。
1.2.4 数据分析 采用SPSS statistics 20.0,对数据进行统计分析。利用单因素方差分析LSD多重比较与卡方检验进行数据间比对,将数据进行分类,进而将每一类别数据中的数据组进行单因素方差分析,当p≥0.05时说明数据中不存在显著性差异,p< 0.05时说明比较的两组数据间存在显著性差异,若p< 0.01时则两组数据间差异极显著。
2 结果
2.1 PRV gE基因PCR检测结果 对897份发病猪样品进行PRV gE-PCR检测,结果共检出PRV核酸阳性样品139份,总体阳性率为15.50%。部分猪场的PCR阳性病料检测检测结果见图1。
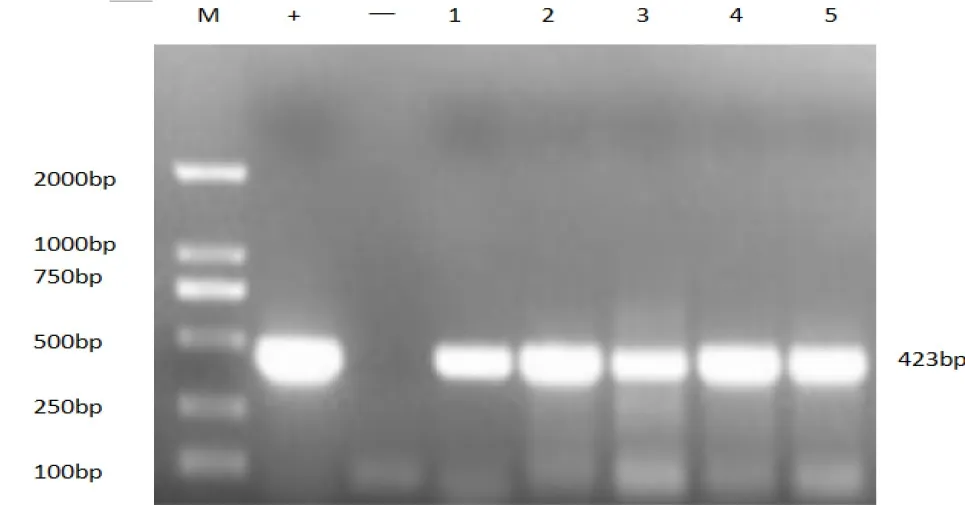
图1 PRV gE基因PCR扩增结果
2.2 不同年份PRV检出情况 2013年、2014年、2015年、2016年与2017年的PRV阳性检出率分别为1.11%(1/90)、5.35%(9/168)、28.64%(55/192)、21.39%(43/201)、12.60%(31/246)。2013年、2014年之间差异不显著,2014-2015年病原阳性检出率呈上升趋势;2015年的病原阳性检出率最高且与其他年份对比差异显著。2016-2017年的病原阳性检出率开始下降且差异显著,但病原阳性检出率始终高于2013年与2014年(表1)。
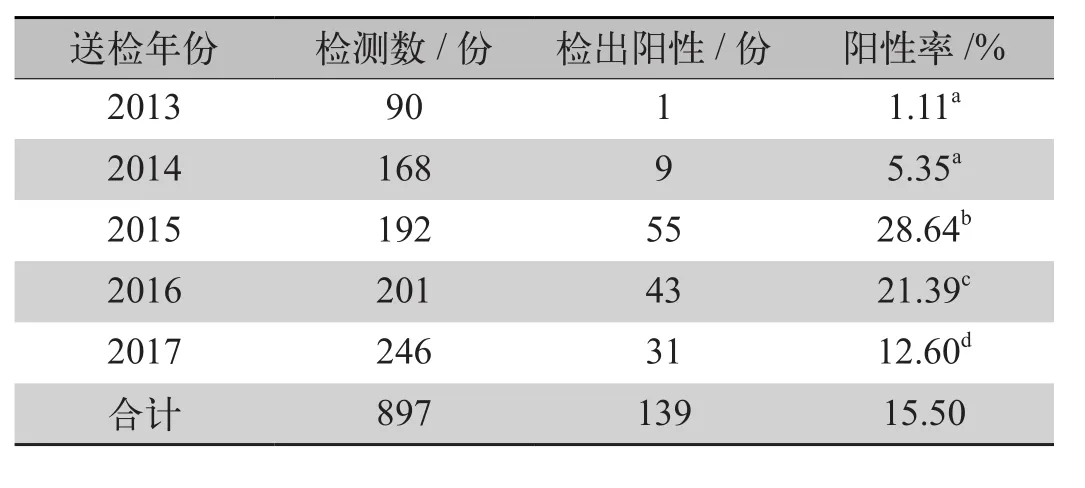
表1 不同年份PRV阳性检出率
2.3 不同生长阶段PRV检出情况 将送检病料生长阶段清晰的样品653份样品进行分类检测,PRV阳性检出率分别为仔猪17.90%(29/162)、保育24.42%(32/132)、育肥14.51%(9/62)、母猪(48/206)、公猪18.68%(17/91),不同生长阶段的PRV阳性检出率差异不显著(表2)。
2.4 不同规模猪场猪群PRV检测结果 不同规模养殖场的PRV检测结果(表3)显示安徽地区不同规模养殖场均存在PRV的野毒感染,小规模养殖场及散养户的抗体阳性率最高为19.88%(34/171),大规模养殖场和中等规模养殖场阳性率分别为12.87%(35/272)、15.38%(18/117)。小规模养殖场及散养户与大规模养殖场、中等规模养殖场比较差异极显著(p< 0.01)。
3 讨论
本次调查分析的897份样品来自安徽地区336个疑似感染PRV野毒的不同规模猪场,结果显示所有收检样品PRV野毒阳性率为15.50%;说明安徽地区猪场确实存在PRV野毒的感染,对猪场猪群整体健康造成极大的危害,急需制定有效措施进行防控。近年来,PRV野毒在我国猪场中仍普遍存在,并保持一个相对稳定的状态,不同猪场PRV野毒感染阳性率差异较大,尤其是2012年以来,PR的发病率有上升趋势,但是没有大规模的爆发,呈地方流行性。
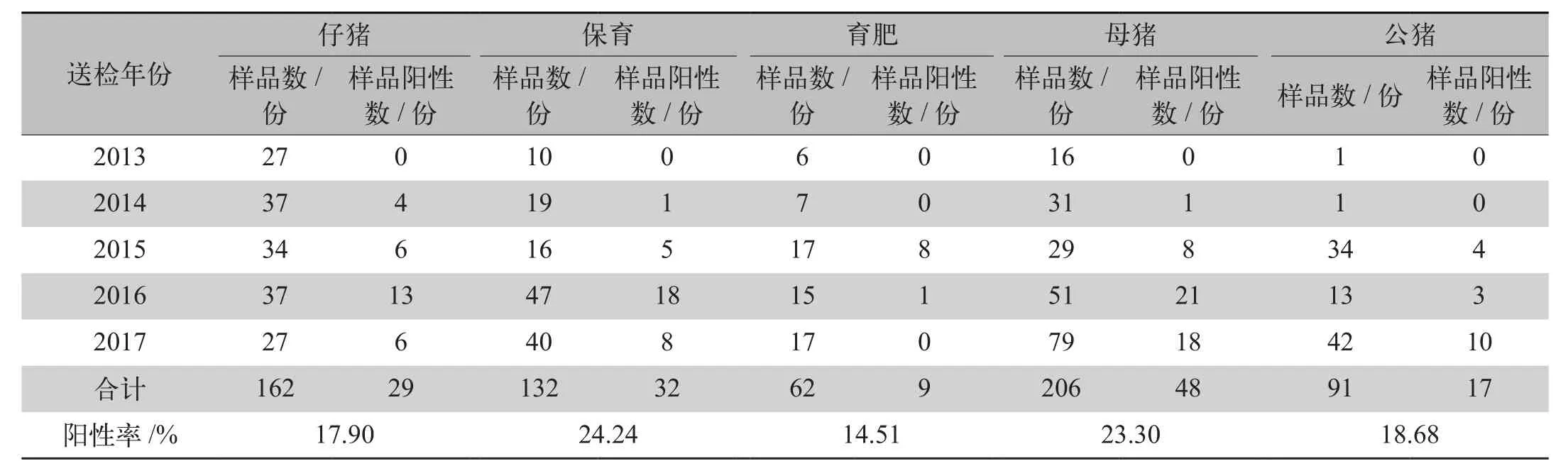
表2 不同生长阶段PRV病原阳性检出率

表3 不同规模猪场猪群PRV阳性检出率
安徽地区不同规模养殖场PRV阳性率的对比结果表明,小规模养殖场及散养户的病原阳性率最高,大规模养殖场和中等规模养殖场病原阳性检出率较低且二者不存在显著性差异。这可能与小规模养殖场与散养户由于资金及技术的限制不能有效监控病毒的传播,往往在猪群发病时才能发现猪群感染了PRV,造成隐形感染和带毒猪长期共存而互相感染。同时其生产管理水平也相对薄弱,缺乏有效的隔离检疫制度,对伪狂犬病的防控意识及防控措施均重视不够。
由不同生长阶段猪的PRV野毒感染阳性率统计分析结果可知,母猪、哺乳仔猪、保育猪、中大猪均有检出,说明不同生长阶段的猪群对PRV均易感。保育猪猪群的PRV野毒检出率最高,且这一阶段的猪群PRV的发病率和死亡率都很高,这提示我们保育仔猪免疫受到母源抗体干扰等因素,造成免疫效果不佳,成为高风险的易感猪群。其次母猪群较高的PRV感染会造成整个猪场伪狂犬病毒的持续性感染,因为母猪饲养时间较长,一旦感染PRV野毒,可长期带毒排毒。制定合理的免疫程序,免疫接种能够有效的降低感染的发生,减少病毒扩散,有计划的实行PRV的净化工作,降低母猪群的PRV野毒感染至阴性状态。
疫苗免疫接种是控制该病的主要方法,选择使用具有较强抗潜伏感染能力的基因缺失弱毒疫苗对于伪狂犬病控制可能更有帮助。而我省不同地区、不同猪场种猪伪狂犬阳性率的差异可能与选择不同的疫苗有一定关系。但是仅仅依靠疫苗免疫并不能彻底控制伪狂犬病的流行,为有效预防和控制该病的发生与流行,应借鉴发达国家消灭猪伪狂犬病的成功经验,引导猪场采取综合防控措施:1)坚持自繁自养、全进全出的养殖模式。2)严格引种管理,做好隔离检疫工作,从源头上切断病原。3)定期监测PRV野毒感染抗体,结果病原学检测结果,及时剔除阳性动物,净化种群。4)加强猪场的饲养管理、营养保健,以提升群体抗病能力。此外,还应加强猪场的灭鼠、消毒工作,严格禁止外来人员及车辆。总之,集约化、规模化养殖场是今后养猪业的发展方向,而集约化养殖无疑对于传染病的控制有着更高的要求。对于伪狂犬的控制,我们的最终目标是逐步净化以达到最终的清除,促进养猪业的健康发展。


