大乳头水螅增殖细胞核抗原基因的克隆及再生进程中的表达分析
吴香恒 程秀珍 王茹梦 段丽丽 潘红春
(安徽师范大学生命科学学院,重要生物资源保护与利用研究安徽省重点实验室,生物环境与生态安全安徽省高校省级重点实验室,芜湖 241000)
再生是生物的基本特性和本能,生物体的一部分因自然损伤或人为切割丢失后其自身能进行一定程度的形态和功能的重建[1]。动物的再生能力可分为3个层次,最基础的为组织层次的再生,如皮肤组织的创伤愈合;其次为器官层次的再生,如两栖纲有尾类幼体或成体的附肢或尾部被切断后可再生出失去的部分;最强的为整体层次的再生[2],如1个水螅个体被横切为两段,这两部分可分别再生成为两个个体。再生现象在进化地位不同的动物中均普遍存在,但不同动物类群之间再生能力的差别较大[3]。进化地位较高等的动物类群已丧失器官及整体层次再生能力,尚保留一定程度的组织再生能力;而进化地位较低等的动物再生能力比较强,其中一部分类群如海绵、水螅和涡虫等具备整体层次的再生能力。淡水水螅具有在实验室易大规模培养、无性繁殖速度快等优点,已成为动物再生的细胞和分子机制研究的模式生物[4]。
水螅强再生能力的主要物质基础是其体内存在的大量可塑性强的细胞[5],但这些细胞是通过去分化,还是通过有丝分裂产生新生细胞参与再生进程,目前未有定论[1,6]。细胞去分化进程的检测目前在技术上较为困难[7],因此追踪和检测水螅再生进程中细胞分裂及DNA复制相关指标来反映细胞增殖活动是可行的切入点[8]。增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)是与DNA复制直接相关的DNA聚合酶δ的一种辅助蛋白质[9]。PCNA蛋白只在增殖细胞中表达,因此,PCNA蛋白被广泛用作肿瘤细胞等活跃增殖细胞的监测标记物[10]。基于此,本研究首先克隆了大乳头水螅(Hydra magnipapillata)PCNA基因的cDNA序列,再利用原核表达系统表达了PCNA重组蛋白;以该重组蛋白为抗原制备了PCNA多克隆抗体,并采用实时定量PCR (quantitative Real-time PCR,qPCR)及免疫印迹分析(Western blotting assay,WB)方法检测了水螅头部再生进程中PCNA表达动态。
1 材料与方法
1.1 实验材料
大乳头水螅(H. magnipapillata)原种采集于重庆市郊区湿地,挑取单只水螅活体标本通过无性繁殖建立大乳头水螅单克隆无性繁殖系[11]。
1.2 大乳头水螅SMART RACE cDNA文库的建立、5′RACE及3′RACE
首先使用Clustal 2.0软件[12]比对3种刺胞动物(GenBank登录号分别为: HAAD01005160、KT452624和LSMT01000220)PCNA基因cDNA序列,再根据比对后筛选出的保守序列设计用于RACE反应的引物5′PCNA及3′PCNA(表1)。从上述大乳头水螅单克隆无性繁殖系中取50只水螅个体,饥饿处理2d后先提取其总RNA,再从中分离和纯化mRNA[11]。RACE cDNA文库制备、5′RACE及3′RACE相关实验操作均按SMART RACE cDNA Amplification Kit(Clontech,美国)说明书进行[11]。
1.3 PCNA基因全长cDNA序列的克隆
为扩增大乳头水螅PCNA基因全长cDNA序列,基于5′RACE和3′RACE产物的测序结果设计一对引物PCNA-F及PCNA-R(表1)。PCR产物采用TA克隆试剂盒(TaKaRa,日本)进行分子克隆,阳性克隆经测序鉴定后扩大培养,进一步提取重组质粒pMD18-T-PCNA备用。
1.4 生物信息学分析
参考Pan等[11]的方法进行大乳头水螅PCNA氨基酸序列预测、PCNA蛋白二级及三级结构的预测。另外,为获得同源蛋白质氨基酸序列,进行BLAST分析(https://blast.ncbi.nlm.nih.gov/Blast.cgi)[11];再通过Clustal 2.0软件将大乳头水螅PCNA氨基酸序列与其同源蛋白质氨基酸序列数据一起进行比对[11]。基于PCNA氨基酸序列数据进行系统发生分析时,外群为2个植物界的同源序列,内群为动物界的29个同源序列。采用Modeltest 3.7筛选建树参数模型后[13],再分别使用PAUP 4.0b10及MrBayes 3.2.3软件重建系统发生树[14—16]。

表 1 本文所用引物序列Tab.1 Primers used in the study
1.5 PCNA基因的原核表达及重组蛋白的纯化、浓缩与鉴定
首先基于PCNA蛋白二级和三级结构特点进行其抗原表位分析[17],再参考抗原表位分析结果把大乳头水螅PCNA基因编码区cDNA序列第67至第657位点的片段确定为原核表达的靶基因。根据原核表达质粒pET-28b(+)酶切位点及靶基因序列特征设计及合成引物PE-PCNA-F(含BamH Ⅰ酶切位点)及PE-PCNAR(含Hind Ⅲ酶切位点,表1),继而通过由质粒pET-28b(+)和E. coliBL21(DE3)组成的原核表达系统[18]制备重组PCNA蛋白。重组蛋白通过亲和层析Ni柱试剂盒(Qiagen,德国)纯化,进而通过离心方法浓缩重组蛋白,再参照Pan等[18]的方法测定重组蛋白N末端15个氨基酸残基的序列以鉴定该重组蛋白。
1.6 多克隆抗体制备
用于免疫的新西兰兔(约5 kg)分为免疫组(2只)与对照组(1只),参照张行等[19]的方法用重组PCNA蛋白免疫实验兔,采用ELISA试剂盒(默沙克生物,中国)检测抗血清效价,最后参照Koolivand等[20]的方法从抗血清中分离PCNA多克隆抗体。
1.7 大乳头水螅头部再生进程中PCNA表达分析
大乳头水螅的切割手术及头部再生实验选取饥饿48h无芽体的水螅个体进行再生实验,用手术刀在每只水螅个体靠近垂唇占水螅体长(垂唇与基盘之间的总长度)1/5处切断,身体前段丢弃,身体后段用于头部再生实验(图1)。第一批总共270只水螅进行切割手术,把得到的水螅身体后段转移到新鲜培养液,并放进黑暗的培养箱[温度(25±0.5)℃]进行再生实验。为准备qPCR的实验材料,在切割手术后0、8h、16h、24h、32h、40h、48h、56h及64h时间段分别取30只再生体放入Trizol溶液(生工生物,中国)保存(分装在3个1.5 mL离心管,每管放0.5 mL Trizol溶液和10只水螅再生体)。此外,第二批总共540只水螅进行切割手术,把得到的水螅身体后段转移到新鲜培养液,并放进黑暗的培养箱[温度(25±0.5)℃]进行再生实验。为准备Western blotting的实验材料,在切割手术后0、8h、16h、24h、32h、40h、48h、56h及64h时间段分别取60只再生体放入液氮中保存(分装在3个1.5 mL冻存管,每管放20只水螅再生体)。
qPCR分析首先基于大乳头水螅PCNA基因编码区序列设计用于qPCR的一对引物(表1),第一链cDNA通过逆转录试剂盒(生工生物,中国)合成,再通过CFX96-qPCR系统(Bio-Rad,美国)和SYBR®Premix ExTaq™ Kit(TaKaRa,日本)进行qPCR反应[21]。每个qPCR反应设3个生物学重复,以大乳头水螅Actin基因作为内参(表1)。2-ΔΔCt法进行原始数据处理[22],运用SSPS 22.0进行单因素方差分析,P<0.05设定为差异显著。
Western blotting分析通过Western Blotting试剂盒(百奥莱博,中国)进行Western Blotting检测[19,23],使用ECL试剂盒(碧云天,中国)进行显色反应。以Actin为内参蛋白,所用大乳头水螅Actin多克隆抗体为本实验室自备。所有Western Blotting实验均设3个生物学重复,运用SSPS 22.0进行单因素方差分析,P<0.05设定为差异显著。
2 结果
2.1 大乳头水螅PCNA基因cDNA及编码蛋白氨基酸序列分析
本研究首先进行了3′RACE及5′RACE,再根据RACE产物的测序结果设计特异性引物通过分子克隆方法获得了总长为1240 bp的大乳头水螅PCNA基因cDNA序列(GenBank登录号: MK123983),其中包括101 bp的5′非编码区,302 bp的3′非编码区及837 bp的编码区,编码的蛋白质预测分子量为
30.93 kD。
与人类PCNA氨基酸序列比对结果表明,二者间完全保守位点为156个,氨基酸序列保守性占比约56%。另外,基于分子系统发生分析的结果表明,以植物界2个物种PCNA序列为外群,动物界框架中拓扑结构基本符合基于形态学的各种动物类群间系统发生关系,其中大乳头水螅PCNA所在的刺胞动物支系与扁形动物支系聚合成一单系群,该单系群位于系统树的基部(图2)。
蛋白质二级结构分析结果显示大乳头水螅PCNA包含36.20%的α-螺旋、24.73%的β-折叠、5.38%的β-转角及33.69%的无规则卷曲线。SWISS-MODEL同源建模结果显示该蛋白三级结构整体形似哑铃,其中α-螺旋和β-折叠分别位于哑铃状结构纵轴方向的两侧。
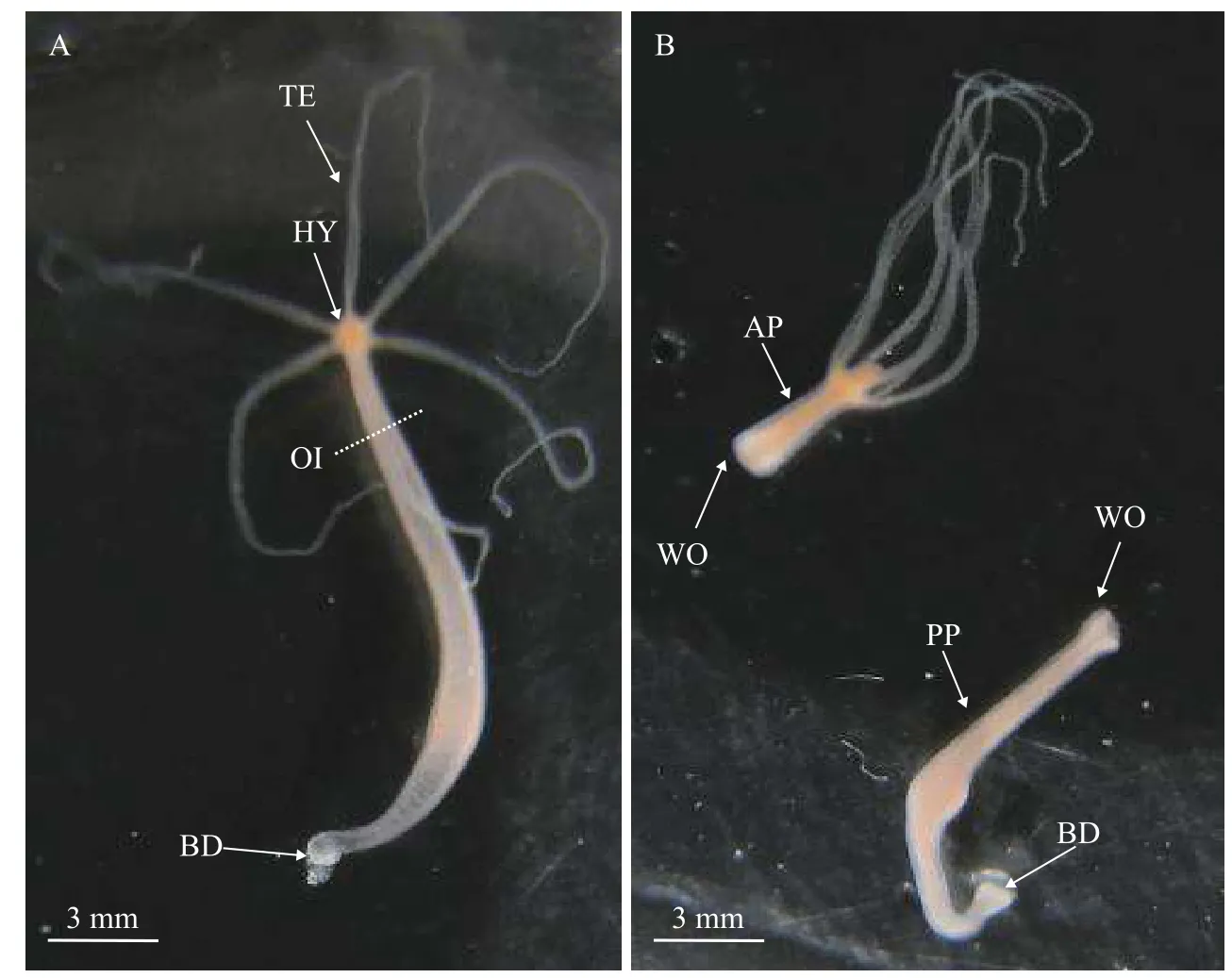
图1 切割手术前及切割手术后水螅的形态Fig.1 The morphology of H.magnipapillata before and after operation
2.2 大乳头水螅PCNA基因的原核表达及多克隆抗体制备
根据抗原表位预测结果(图3A),再结合相关区域cDNA序列特征,选择了大乳头水螅PCNA基因编码区cDNA序列第67位点至657位点的片段为原核表达的靶区域。DNA测序及双酶切的结果均证实本研究成功制备了原核表达重组质粒pET-28b(+)-PCNA(图3B),细胞内含有pET-28b(+)-PCNA的E.coliBL21(DE3)菌株经IPTG诱导后成功表达重组PCNA蛋白(图3C),其分子量与预期大小(26.84 kD)接近。经优化诱导表达条件后发现在诱导温度27℃时该重组蛋白主要以可溶性形式表达(图3C第5—6泳道)。亲和层析Ni柱纯化重组蛋白(图3C第7泳道),进一步浓缩后其浓度约为350 μg/mL。N末端氨基酸残基序列测定结果(MGSSHHHHHHS SGLV)也直接证明了本研究成功表达了重组PCNA蛋白。另外,ELISA检测结果表明以上述浓缩后的重组PCNA蛋白为抗原对实验兔进行免疫后得到的抗血清效价为1:364500(图3D)。
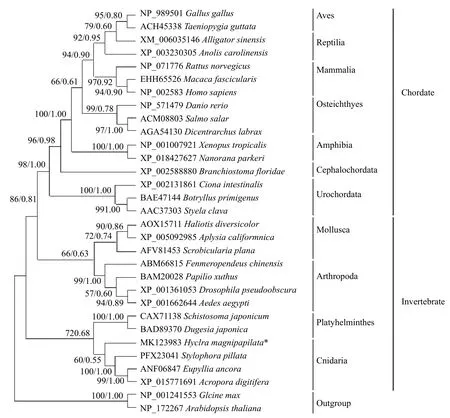
图2 基于PCNA氨基酸序列数据重建的ML树及BI树Fig.2 Maximum likelihood tree and Bayesian inference tree based on amino acid sequences of PCNA
2.3 大乳头水螅头部再生进程中PCNA表达分析
qPCR结果表明,切割手术后0、8h及16h时水螅再生体PCNA基因转录水平较为平稳,而切割手术24h后再生体PCNA基因转录水平逐渐升高,56h后开始降低,64h时降至与切割手术后0、8h及16h相类似的表达水平(图4A)。WB检测结果表明切割手术后32h、40h及48h时水螅再生体PCNA蛋白表达水平明显上调(图4B、4C)。
3 讨论
从水螅身体上分离的片段(至少包含数百个细胞,触手和基盘部位除外)可以再生成独立的小水螅[24];甚至将完整的水螅个体通过特殊的物理和化学方法“打散”成独立的单细胞,再把含有这些水螅单细胞的溶液用离心机离心,待离心完成后离心管底部的沉淀即为这些细胞的聚集体,2—3d后该细胞聚集体将重建成一条完整的水螅[25]。水螅这种强大再生能力的物质基础可能源于以下两个方面:(1)相对简单的身体结构。一只水螅个体是由体壁围成的中空柱状结构,柱状结构中间空腔为原肠腔,柱状结构的一端是其头部(主要由口、垂唇和触手组成),另一端为起固着作用的基盘。其体壁由外胚层、中胶层和内胚层构成[26];(2)水螅体内富含干细胞性质的细胞。体壁的中胶层无细胞分布,而外胚层和内胚层主要由上皮肌肉细胞(Epitheliomuscular cell,简称皮肌细胞)组成,皮肌细胞是一种特殊的上皮细胞,其通过细胞分裂只能形成新的皮肌细胞、而不能形成其他类型细胞[27];除此之外,水螅还具备一种干细胞,即相对于皮肌细胞而言体积较小的间质干细胞(Interstitial stem cell),该细胞主要分布在外胚层。间质干细胞是一种多能干细胞,能分化成其他功能终端细胞(不具备干细胞性质,主要包括刺细胞(Stinging cell)、腺细胞(Gland cell)、感觉细胞(Sensory cell)和神经细胞(Nerve cell))[28],以及在环境条件剧烈改变(如水温骤降或食物缺乏)时分化为性细胞以形成临时性的生殖腺[29]。
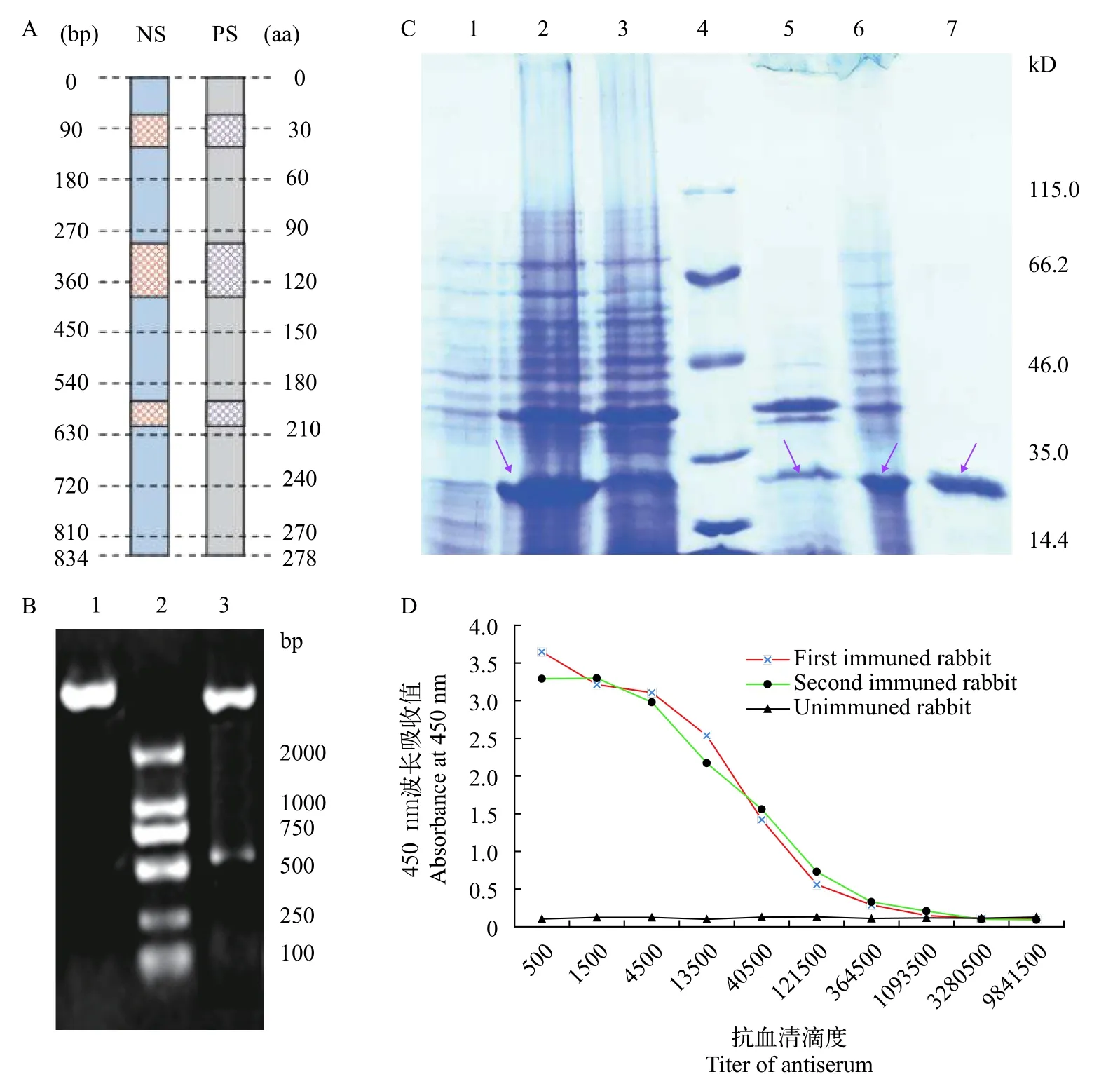
图3 PCNA抗原表达及抗体制备Fig.3 PCNA antigen expression and antibody preparation

图4 大乳头水螅头部再生进程中PCNA的表达动态Fig.4 Dynamic expression of PCNA during the process of head regeneration of H. magnipapillata
干细胞有两个重要特性,即具备转分化能力和分裂增殖形成新生细胞的能力[30]。水螅再生进程中其体内的干细胞是通过转分化的形式(Morphallaxis,或称为“变形再生”,指的是在没有细胞增殖的情况下发生的再生类型,涉及将现有身体部位或组织转化为新组织的结构)、还是通过分裂增殖的形式(Epimorphosis,或称为“新建再生”,通过细胞增殖在伤口部位产生新组织)参与再生过程? 这个问题目前颇有争议[1,6]。为了探讨该问题,基于增殖细胞核抗原(PCNA)蛋白的表达水平与细胞分裂增殖水平直接相关[10],本研究克隆了大乳头水螅的PCNA基因,并在重组PCNA蛋白的基础上制备了多克隆抗体,进而运用实时定量PCR(qPCR)及免疫印迹(WB)方法分析PCNA基因及编码蛋白在水螅头部再生进程中表达水平的动态变化。qPCR结果显示,水螅头部再生进程的早期(切割手术后0、8h及16h)再生体PCNA基因转录水平波动较小,而切割手术后24h后再生体PCNA基因转录水平逐渐升高,56h后开始降低,致64h时降至与再生进程早期类似的转录水平(图4A)。WB检测结果表明切割手术后32h、40h及48h时水螅再生体PCNA表达水平明显上调(图4B、4C)。从形态发育结构特点看(图4B),水螅头部再生进程的早期主要是手术伤口的愈合,这个时期PCNA表达水平较低,反映了这个阶段可能是外胚层和内胚层中的原有旧皮肌细胞进行转分化参与伤口的愈合;而再生进程的中后期(切割手术后32h、40h及48h)PCNA表达水平明显上调,这个时期主要涉及水螅垂唇和触手等头部重要结构重建,特别是切割手术后40h时垂唇和触手开始萌芽,至48h时垂唇和触手结构已基本形成。垂唇和触手的主体结构也是由外胚层和内胚层中的皮肌细胞构成[31],这些部位的皮肌细胞仍然可能来自伤口附近原有旧皮肌细胞的转分化;但为了辅助捕食,水螅头部结构的表面(外胚层),特别是在触手外胚层的皮肌细胞之间通常分布有大量刺细胞[32],触手再生时势必要及时补充外胚层中的刺细胞。而刺细胞与腺细胞、感觉细胞和神经细胞等其他功能终端细胞一样,不能通过转分化途径获得,只能由外胚层中的间质干细胞自身先分裂增殖,再由获得的新生细胞分化而来[33]。所以本研究发现在水螅再生进程的中后期PCNA表达水平上调的现象实际上可能反映了间质干细胞在这个时期启动了分裂增殖,以此及时补充再生体中刺细胞等功能终端细胞。到再生进程晚期(切割手术后64h)口、垂唇和触手等头部主要结构全部再生完成,其PCNA表达水平降至与再生进程早期类似的基础水平(图4A—C)。
综上所述,本研究揭示的大乳头水螅头部再生进程中PCNA基因及其编码蛋白的表达水平动态特点的解释都是基于以下两个推测: (1)再生组织两个胚层中的皮肌细胞是由伤口附近区域旧的皮肌细胞转分化而来;(2)再生组织中的功能终端细胞是由间质干细胞增殖形成的新生细胞分化而来。这两个推测根据何在? 首先,水螅身体结构简单仅具两个胚层,没有像许多三胚层动物具备的专门储存营养的结构[34]。如连续给水螅喂食,水螅身体无法储存过多的营养,但这些获得的营养能直接刺激水螅体内皮肌细胞及间质干细胞连续分裂,结果就是在水螅身体出芽区(Budding region)产生许多芽体(Bud),芽体不断长大直至自身发育完全后脱离母体[35]。在高频率喂食水螅的情况下,水螅体就是靠干细胞不断分裂形成芽体的方式排除过多的营养;而在低频率喂食水螅的条件下(如3d喂一次水螅),水螅获得的营养可能刚满足其基本生命活动的需要,水螅体不产生芽体,水螅身体也不缩小;但停止喂食水螅后,水螅不但不产生芽体,反而身体逐渐缩小,这是因为水螅饥饿后无法从体外获得营养物质,但水螅体自身一部分细胞以细胞自噬或细胞凋亡的形式被分解和吸收以保持其基本生命活动需要[36],所以水螅个体越来越小。以上的事实说明了由于水螅无储存营养的结构导致必须通过喂食让水螅临时获得营养使其体内干细胞启动分裂增殖;反过来说就是水螅体内干细胞分裂增殖的先决条件是通过喂食获得临时性的营养积累,没有临时的营养积累水螅干细胞不会启动分裂增殖。水螅切割手术后其头部再生过程类似于正常水螅体饥饿状态时的情况,因为头部再生完成前水螅无法进食,继而无法获得外部营养,所以再生组织中构成水螅身体结构主体的新生皮肌细胞最有可能由伤口附近区域旧皮肌细胞转分化而来(变形再生);其次,水螅身体中的刺细胞、腺细胞、感觉细胞和神经细胞等功能终端细胞不具备干细胞性质,无转分化能力,因此再生组织中的这些功能终端细胞的来源只有一个,即由间质干细胞分裂后获得的新生细胞分化而来[5,32,37]。而间质干细胞分裂增殖的营养和能量从何而来? 有报道认为是来源于部分皮肌细胞的自噬
或凋亡[36,38]。总之,本研究初步揭示了水螅头部再生进程的中后期阶段水螅PCNA表达量呈现一定程度的上调,这个结果暗示水螅头部再生进程的中后期阶段其伤口及附近区域可能存在细胞分裂增殖活动,其中涉及的细胞和分子机理值得深入研究。

