分离技术对直链麦芽低聚糖组分含量的影响
李家宬陈殿宁顾正彪,2李才明,2李兆丰,2
(1. 江南大学食品学院,江苏 无锡 214122;2. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122)
直链麦芽低聚糖是指由3~10个葡萄糖单元以α-1,4-糖苷键连接而成的寡糖聚合体,具有甜度较低、保湿能力强、吸湿性小等特点,在改善食品质地、风味及延长面包、速冻食品保质期方面具有良好的应用效果[1-2];此外,直链麦芽低聚糖还具有良好的生理功能,可在不引起血糖急剧升高的情况下,缓慢持续地为人体供能,是最具潜力的新型低聚糖之一[1]。其中,聚合度3~6的直链麦芽低聚糖(G3~G6)具有适中的黏度,可作为磷酸寡糖合成的前体,促使人体对Ca2+的吸收[3],还可以抑制肠道腐败菌生长,促进益生菌增殖,维护肠道健康[4-5],因此,具有更好的应用前景。
直链麦芽低聚糖的工业化生产主要采用酶法工艺,即通过麦芽糖生成酶(EC 3.2.1.1)作用淀粉而成[6]。其酶解产物中不仅含有G3~G6,还含有单、双糖和六糖以上的组分,产物中G3~G6所占比例不高,限制了其工业化应用。目前鲜有直链麦芽低聚糖分离纯化的报道,但市场上存在两种产品形式:① 以“mg”为订购单位的高纯度纯品,用于仪器分析,价格昂贵;② 纯度较低的直链麦芽低聚糖糖浆,并未实现高纯度样品的大批量、连续化生产,因而限制了其研究与应用。
课题组[7]前期已成功构建来源于BacillusstearothermophilusSTB04的直链麦芽低聚糖生成酶(Bst-MFA酶,GenBank: AIV43245.1)的BacillussubtilisWB600表达系统,并研究了该酶制备直链麦芽低聚糖的情况。结果显示,该酶生产的直链麦芽低聚糖主要为G5和G6,G3~G6所占比例也相对较高。试验拟以该酶酶解产物为原料,探究膜分离、活性炭吸附分离、葡聚糖凝胶柱层析分离和离子交换树脂柱层析分离等技术对直链麦芽低聚糖组分的影响,以G3~G6、G5+G6比例和回收率为指标,综合评判各技术对直链麦芽低聚糖各组分的分离能力,并分析了相关机理。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
玉米淀粉:山东大宗生物开发股份有限公司;
普鲁兰酶:2 000 U/mL,日本天野公司;
G3~G7标准品:上海惠诚生物科技有限公司;
葡聚糖凝胶G-25:西宝生物科技(上海)股份有限公司;
钠型、钙型离子交换树脂:天津南开大学树脂有限公司;
钾型K310离子交换树脂:陶氏化学(罗门哈斯)中国有限公司;
其他试剂:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
高效阴离子交换色谱仪(HPAEC-PAD):CS-5000 plus型,美国Thermo Scientific有限公司;
管式陶瓷膜超滤设备:CeraMen-0100型,厦门福美科技有限公司;
阿贝折射仪:WAY-2S型,上海始恒仪器设备有限公司;
电导率仪:STARTER3100C型,奥豪斯国际贸易(上海)有限公司;
顺序式模拟移动床:小试设备-1型,上海兆光色谱分离技术有限公司。
1.2 试验方法
1.2.1 玉米淀粉的酶解 配制质量分数为45%的玉米淀粉乳,调节pH至5.0,60 ℃保温15 min,按底物干基加入Bst-MFA酶20 U/g,以2.0 ℃/min的速率升温至90 ℃,保温30 min,以10 ℃/min的速率将温度降为65 ℃,稳定后加入普鲁兰酶20 U/g,反应24 h。
1.2.2 直链麦芽低聚糖的组分分析 取1 mL样品,沸水浴30 min灭酶[8]、定容、离心(10 000 r/min,10 min),上清液过0.22 μm水系滤膜,稀释一定倍数后用HPAEC-PAD分析产物组成[9]。
HPAEC-PAD分析参照文献[7]的方法。分别按式(1)、(2)计算G1~G7(G1、G2分别表示葡萄糖、麦芽糖,其他组分由于缺乏相应的标准品,未做定量分析)的产率和G1~G7中各糖组分的比例。
(1)
(2)
式中:
Y——目标产物的产率,%;
c1——稀释后样品中目标产物的浓度,mg/mL;
m1——取样质量,mg;
ω——目标产物的比例,%;
c——样品中G1~G7的浓度,mg/mL。
1.2.3 直链麦芽低聚糖浓度的测定 采用阿贝折射仪[10]。
1.2.4 酶解产物的预处理 酶解产物经灭酶、离心后保留上清液,在最佳温度和活性炭负载量下,进行活性炭脱色处理[11]。此外,为避免待分离样品中的金属离子置换出离子交换树脂上的功能离子,脱色样品需依次泵入阴、阳离子交换树脂柱以去除杂离子[12],水洗流速230 mL/min,上样流速140 mL/min,待有糖液流出时开始收集。经此处理的样品,电导率在10 μS/cm以下时可用于后续分离[13]。
1.2.5 直链麦芽低聚糖的分离纯化
(1) 膜分离:依次用陶瓷膜、有机膜[14]对酶解液中的直链麦芽低聚糖进行分离纯化,每进行一次膜分离均收集透过液和截留液,并用HPAEC-PAD分析直链麦芽低聚糖的组成变化。以分离前后样品中目标产物的增量和回收率为评价指标,并按式(3)、(4)进行计算。
(3)
(4)
式中:
Δ——目标组分比例的增量,%;
ω1——初始酶解液中目标组分的比例,%;
ω2——分离后样品中目标组分的比例,%;
γ——目标组分的回收率,%;
σ1——初始酶解液的糖度,%;
σ2——分离后样品的糖度,%。
(2) 活性炭吸附分离:参照文献[15]并做适当修改。层析柱尺寸为Φ1 cm×90 cm,上样量为1 mL。用超纯水洗脱G1,再分别用体积分数为5%,7%,10%的乙醇溶液洗脱G2、G3和G4,最后用15%的乙醇溶液洗脱其他糖,洗脱流速1.0 mL/min,自动部分收集器每管收集4 mL洗脱液,采用阿贝折射仪测定洗脱液中的糖浓度,并用HPAEC-PAD分析洗脱液中直链麦芽低聚糖的组成变化。
(3) 葡聚糖凝胶柱层析分离:参照文献[16]并做适当修改。操作温度为60 ℃,洗脱剂为超纯水,洗脱流速为1.0 mL/min,自动部分收集器每管收集4 mL洗脱液,分析洗脱液中直链麦芽低聚糖的组成变化。
(4) 离子交换树脂柱层析分离:参照文献[17]并做适当修改。操作温度为60 ℃,洗脱剂为超纯水,用恒流泵控制流速,自动部分收集器每管收集4 mL洗脱液,分析洗脱液中直链麦芽低聚糖的组成变化。将钠型树脂转化为钙型的方法为:钠型树脂溶胀后先用1 mol/L的盐酸溶液浸泡24 h,用去离子水洗至中性,再用1 mol/L的CaCl2溶液将其转化为钙型,最后用去离子水洗至无Ca2+流出。钾型树脂用去离子水浸泡溶胀24 h即可使用。
(5) 模拟移动床分离:将样品糖浓度浓缩至50%,顺序式模拟移动床操作条件为填料总体积8 L,12根尺寸为Φ3.9 cm×65 cm的分离柱,操作温度60 ℃,洗脱剂为去离子水,进样流速19.5 mL/min,进水及循环流速39 mL/min,通过调整模拟移动床的阀切换时间控制目标产物的组成。
1.2.6 数据处理 试验结果为3次独立试验的平均值,用平均值和标准偏差表示。采用SPSS软件进行统计学分析(P<0.05)。
2 结果与讨论
2.1 酶解产物分析
按照1.2.1所示方法制备直链麦芽低聚糖,并对产物组分进行分析。结果显示,复合使用Bst-MFA酶和普鲁兰酶作用于质量浓度45%的玉米淀粉乳24 h后,所得产物中含有大量的麦芽低聚糖,其中G1~G7的产率为85.89%。G5+G6的总质量占G1~G7总质量的55.46%,G3~G6占G1~G7的比例达到77.08%,产物中G3~G6、G5+G6的比例还有待进一步提高。
2.2 膜分离效果分析
以5 nm陶瓷膜和1 000 Da的有机膜组合对酶解液中的直链麦芽低聚糖进行分离纯化。酶解液经5 nm陶瓷膜过滤处理,以除去大分子颗粒;将透过液用1 000 Da的有机膜进行二次分离,以除去G1~G4等小分子糖。
膜分离对G5+G6和G3~G6的分离效果见表1。结果显示,相比于初始酶解液,透过液中G5+G6和G3~G6的比例分别提高了14.07%和8.04%,表明膜分离可以在一定程度上分离直链麦芽低聚糖。但G5+G6和G3~G6的回收率低于60%,大量目标产物损失于膜分离的过程中,且G5+G6和G3~G6所占比例还未达到较高水平。这可能是因为膜分离技术主要通过分子量大小和颗粒形状对产物进行分离,而不同的直链麦芽低聚糖分子量差异较小,且为链状结构,相比于球状分子更难利用膜分离的方式进行分离。
2.3 活性炭吸附分离效果分析
活性炭具有较大的表面积,其内、外表面和孔隙均可吸附直链麦芽低聚糖分子,当用去离子水洗脱时,G1首先脱吸附,依次增加洗脱剂中乙醇的浓度,G2~G7可相继被洗脱[15]。试验结果显示,相比于初始酶解液,分离产物中G5+G6和G3~G6的比例分别提高了23.52%和0.91%(表1)。然而,G5+G6和G3~G6的回收率均低于50%,可能是因为活性炭对G1~G7的吸附能力过强,使得洗脱剂不能将被吸附的糖完全洗脱回收。
2.4 葡聚糖凝胶柱层析分离效果分析
葡聚糖凝胶可通过分子筛原理对直链麦芽低聚糖进行分离纯化,其对G5+G6和G3~G6的分离效果见表1。相比于初始酶解液,分离产物中G5+G6和G3~G6所占比例分别达到84.43%和86.09%,分离效果优于膜分离和活性炭吸附分离。

表1 直链麦芽低聚糖不同分离纯化方法对比†
葡聚糖凝胶可比较高效地分离不同组分的直链麦芽低聚糖,可能是由于当直链麦芽低聚糖流经葡聚糖凝胶层析柱时,分子量较大、链长较长的G5~G7只能在凝胶颗粒的网孔外移动,流速较快因而先从凝胶层析柱中流出;分子量较小的组分(如G1和G2)可以进入凝胶颗粒内部,流速较慢而后从层析柱中流出。流速差异使得不同组分流经色谱柱的时间不同,从而实现G1~G7中不同组分的高效分离。但葡聚糖凝胶成本较高,黏度和密度均较大的糖浆在分离过程中易产生较高的柱压,使部分凝胶的糖苷键水解或交联结构受损[18],分离效果下降。
2.5 离子交换树脂柱层析分离效果分析
2.5.1 钠型离子交换树脂柱层析分离 钠型离子交换树脂的可交换离子为Na+,其对G5+G6和G3~G6的分离效果见表1,相比于初始酶解液,分离产物中G5+G6和G3~G6的比例分别提高了2.76%和2.10%,但回收率均低于20%,可见钠型离子交换树脂柱对目标产物的分离效果不明显。
2.5.2 钙型离子交换树脂柱层析分离 参照1.2.5(4)方法将钠型离子交换树脂转为钙型,其对G5+G6和G3~G6的分离效果见表1,相比初始酶解液,分离产物中G5+G6和G3~G6的比例分别提高了36.07%和10.85%,回收率分别为63.52%和51.48%,可见,钙型离子交换树脂柱对目标产物的分离效果优于钠型。这可能是因为虽然二者分离直链麦芽低聚糖主要基于Na+和Ca2+与糖分子所带羟基间的配位络合交换原理,但Ca2+与糖分子所带羟基的络合作用强于Na+。
2.5.3 钾型离子交换树脂柱层析分离 钾型K310树脂层析柱是以分子体积排阻作用为主导对直链麦芽低聚糖进行分离纯化,其分离效果见表1。当上样体积为1 mL,洗脱剂流速为1.0 mL/min时,与初始酶解液相比,分离产物中G5+G6和G3~G6的比例分别升高至77.38%和83.35%,回收率分别高达78.11%和63.89%,分离效果优于钠型和钙型树脂。这可能是因为钠型和钙型两种树脂孔隙较大,粒径分布不均且交联度较低,G1~G7均可通过孔隙,分子体积排阻效应未得到很好的体现。而钾型K310树脂的孔径介于G4和G5之间,G1~G7通过树脂时被分成两部分,G1~G4随洗脱剂在树脂孔径内移动,而G5~G7通过层析柱时只能随洗脱剂在孔径外(树脂颗粒间)移动,流出色谱柱的时间差异使得G1~G4和G5~G7得以分离。钾型树脂柱的分离原理类似于葡聚糖凝胶柱,可见分离直链麦芽低聚糖时应使分子体积排阻发挥主导作用。
2.6 顺序式模拟移动床分离
对比上述几种直链麦芽低聚糖的分离方法,选用钾型K310树脂为吸附剂填料对目标产物进行分离纯化。参照1.2.5(5)方法设置模拟移动床条件,周期时长是指连续分离过程中一个分离周期(从进样到下一次进样)的时间。测定不同周期时长下所收集样品中的目标产物含量,发现随着周期时长的缩短,提余液中G3~G6的比例和回收率均逐渐降低,G5+G6的比例和回收率先升高后降低。当周期时长为1 378 s时,G5+G6的比例和回收率均达到最高,分别为84.74%和84.23%(表2),此时直链麦芽低聚糖分离前后的HPAEC-PAD色谱图如图1所示,分离效果较好。
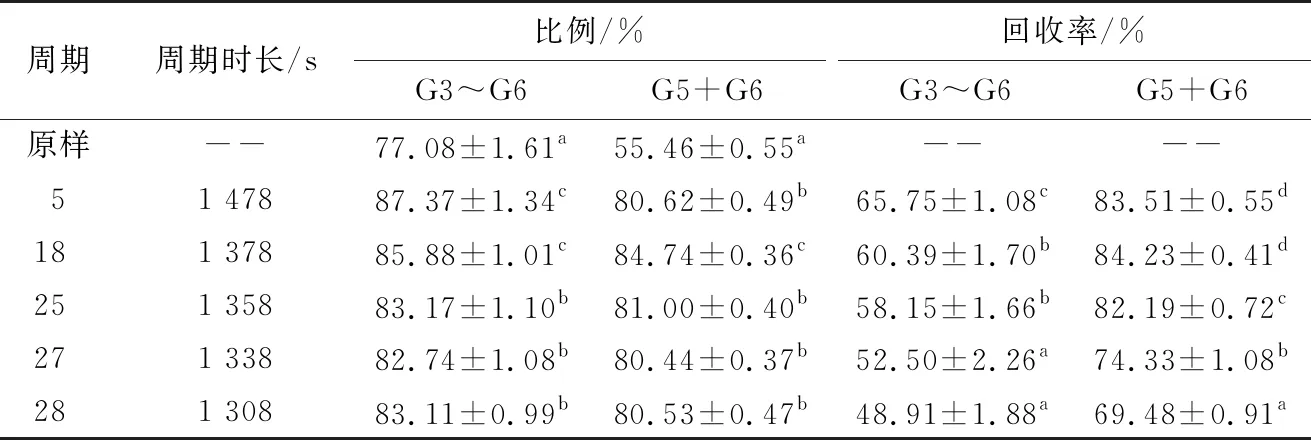
表2 模拟移动床分离纯化直链麦芽低聚糖†
从模拟移动床的分离过程来解释,待分离原料F从串联色谱柱的中部加入色谱柱系统,分离过程中洗脱剂D从左端进入并自左向右流动,色谱柱向左移动。提取液A中各组分(G1~G4)在色谱柱中的移动速度较慢,从串联色谱柱左端收集,而提余液B中各组分(G5~G7)移动速度较快,从色谱柱右端收集。要实现两组分分离,色谱柱系统阀切换速度需介于A和B在色谱柱中的移动速度之间。随着阀切换时间的缩短,色谱柱向左移动的速度越来越快,直链麦芽低聚糖分子更多地随色谱柱向左移动,提余液自B处流出要经历的色谱柱长度增加,使得G5~G7与G1~G4分离得更为彻底,而G1~G4在提取液A处被收集的作用也更加明显,这时,在B处收集的提余液中G5+G6的比例和回收率升高而G3~G6的比例和回收率略有下降;然而,若阀切换时间进一步缩短,G5~G7随色谱柱向左移动的速度越来越快也会在A处被部分收集,导致提余液B中G5+G6的比例和回收率有所降低,G3~G6的比例和回收率进一步降低。当模拟移动床的分离周期为1 378 s时,提余液中G3~G6比例和回收率均较高,且G5+G6达到最高的比例和回收率,通过喷雾干燥可制备含高比例G5+G6的直链麦芽低聚糖固体粉末。
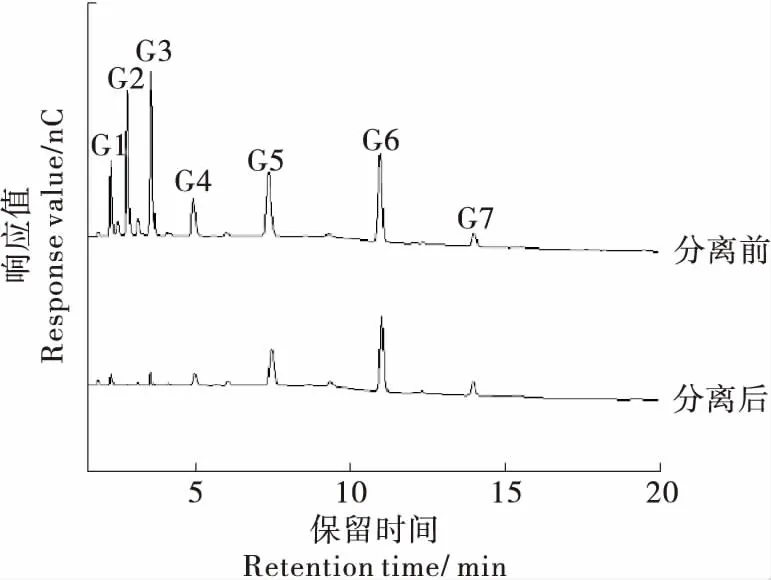
G1. 葡萄糖 G2. 麦芽糖 G3. 直链麦芽三糖 G4. 直链麦芽四糖 G5. 直链麦芽五糖 G6. 直链麦芽六糖 G7. 直链麦芽七糖
3 结论
采用多种手段对直链麦芽低聚糖生成酶的酶解产物进行分离纯化。结果显示,基于选择透过性原理的膜分离技术对不同分子量的直链麦芽低聚糖分离效果不佳,目标产物的比例及回收率均较低;活性炭对低聚糖的吸附能力过强,导致目标产物回收率低且耗时耗能;基于分子筛原理的葡聚糖凝胶柱层析分离效果较好,但其在分离过程中易产生过高的柱压,不利于连续化批量操作;不同离子类型的离子交换树脂对直链麦芽低聚糖的分离效果不同,其中,基于配位络合交换原理的钠型与钙型树脂对G5+G6的纯化效果并不理想,而主要依靠分子体积排阻效应的钾型K310树脂对G3~G6和G5+G6的分离效果较好。在此基础上,以钾型K310离子交换树脂为固定相吸附剂,采用模拟移动床对直链麦芽低聚糖进行连续分离纯化,通过优化模拟移动床的分离周期,可将G3~G6和G5+G6所占比例进一步提高。

