腰大池引流治疗动脉瘤夹闭术后脑血管痉挛的作用
孙铁霖,张振兴,苗野
(锦州医科大学附属第一医院神经外科二病区,辽宁 锦州 121000)
颅内动脉瘤是风险极高的脑血管疾病,发生率为1%~5%,发生的高峰年龄是55~60岁,动脉瘤破裂出血可致患者发生自发性蛛网膜下腔出血,30%~83.99%的蛛网膜下腔出血是由于动脉瘤破裂等原因所致,患者30 d内病死率约为45%,存活者大多存在不同程度后遗症。颅内动脉瘤再次破裂出血是致残、致死的主要原因。2 w内破裂比例为1.7%~25.4%,高达50%的患者会立即死亡,故应早期手术降低再出血[1-2]。动脉瘤夹闭术可在显微镜下直视瘤体,夹闭效果更确切可靠,术中可对积血进行冲洗,减轻迟发的脑血管痉挛风险,但术后仍有约50%的患者会出现继发性脑血管痉挛,无法恢复到SAH前的生活质量,有7%的患者出现严重的功能缺失,预后极差,故必须积极预防[3-4]。为防治动脉瘤夹闭术后发生的脑血管痉挛,临床常采用间断腰椎穿刺和持续腰大池引流两种办法。本研究旨在评价两种方式对动脉瘤夹闭术后脑血管痉挛的疗效差异。
1 资料与方法
1.1 一般资料
收集自2017年9月至2019年2月收入神经外科二病区的动脉瘤破裂出血伴蛛网膜下腔出血患者,严格执行入选标准及排除标准,共有79例患者符合标准纳入研究。根据术后行腰椎穿刺或腰大池引流,分为反复腰穿引流组(对照组组)34例和腰大池持续引流组(观察组)45例。其中观察组男14例,女20例,年龄24~82岁,平均年龄(54.27±11.77)岁;对照组年龄男16例,女29例,年龄39~80岁,平均年龄(57.48±10.51)岁。两组患者的年龄分布、性别构成、入院时 Hunt-Hess分级、改良 Fish分级、不同程度NHISS评分比较以及患者发病到穿刺引流时间等一般资料无显著差异(P>0.05),具备可比性。
1.2 治疗方法
患者给予常规的止血、降压、抗脑血管痉挛等对症治疗,缓解脑血管痉挛,控制血压,防止再出血,经 CTA或 DSA明确动脉瘤诊断后,于入院1~3 d内行开颅动脉瘤夹闭术,全麻成功后,设计翼点入路切口,打开视神经池及视交叉池,缓慢释放并用生理盐水冲洗血性脑脊液,锐性分离动脉周围蛛网膜,暴露动脉瘤颈,以合适的动脉瘤夹夹闭瘤颈部,术后给予增加血容量、提高脑灌注压、提高血液稀释度(3 H)等对症治疗,密切监测病人的生命体征变化。术后给予不同的引流方式。对照组给予常规腰椎穿刺,每日1次行腰椎穿刺术,根据患者病情,每次引出脑脊液30~50 mL,连续治疗7~9 d,若连续3次脑脊液常规化验回报无明显异常且颅内压控制在120~160 mmH2O,或头CT显示积血完全清除,则可提前拔管。观察组给予腰大池引流术,麻醉成功后选取 L3~L4或 L4~L5间隙为穿刺点垂直进针,有突破感后停止进针,拔出针芯将带导丝的引流管置于蛛网膜下腔,距皮肤8~10 cm,抽出导丝,见脑脊液引出后连接引流袋,缝合穿刺口,调整引流袋高度,根据患者病情,将引流量控制在200~300 mL/ d,给予每日换药处置,若考虑腰大池引发颅内感染则拔出引流管,更换穿刺点重新置管,放置7~9 d,若连续3次脑脊液常规化验回报无明显异常且颅内压控制在120~160 mmH2O,或头CT显示积血完全清除,则可提前拔管。
1.3 观察指标
(1)脑脊液NO、ET-1水平检测:采取患者入院后3、7、14 d脑脊液标本,测定NO、ET-1浓度;(2)脑脊液红细胞计数:采取患者入院后3、7、14 d脑脊液标本,测定脑脊液红细胞数目;(3)大脑中动脉流速检测:采用床旁经颅多普勒超声检查,测定3、7、14 d大脑中动脉血液流速;(4)观察患者入院及治疗14 d时的临床表现,比较神经功能缺损评分。
1.4 统计学方法
使用SPSS 21.0软件对所有数据进行统计学分析,所有计数资料采用(均数±标准差)表示,计数资料使用t检验,P<0.05表示差异有统计学意义,计量资料采用χ2检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 入院一般资料
腰椎穿刺组患者共计45人,其中男性16人,女性29人,50岁以下有17人,50~69岁有21人,70岁及以上有7人;入院时的NHISS评分4分及以下7人,5~14分29人,15分及以上9人;入院时Hunt-Hess分级2级患者21人,3级患者19人,4级患者5人;入院时改良 Fisher分级2级26人,3级16人,4级患者3人。腰大池引流组患者共计34人,其中男性14人,女性20人;50岁以下有12人,50~69岁有19人,70岁及以上有3人;入院时Hunt-Hess分级2级患者14人,3级患者17人,4级患者3人;入院时改良 Fisher分级2级23人,3级10人,4级患者1人;NHISS评分4分及以下3人,5~14分26人,15分及以上5人。两组患者的入院一般状况:年龄、性别、NHISS评分、改良Fisher分级及Hunt-Hess分级的差别无统计学意义(P>0.005),见表1。

表1 患者入院时一般资料对比
2.2 脑脊液红细胞数、NO、ET-1水平、VMCA
观察组采集的脑脊液中脑脊液红细胞数、NO、ET-1水平、VMCA等数据均优于对照组,差异具有统计学意义(P<0.05),见表2。
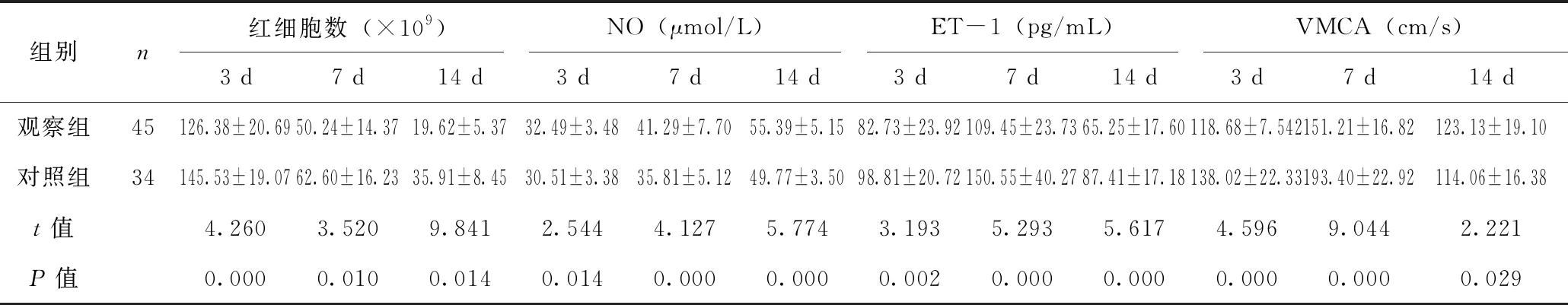
表2 两组患者脑脊液红细胞数、NO水平、ET-1水平、VMCA比较
2.3 两组患者入院时与14 d时的神经功能缺失评分比较
通过比较两组患者的NHISS评分来比较其神经功能缺损情况,入院时两组患者的NHISS评分无明显差异,见表1;在第14 d观察组患者的得分情况优于对照组,差异具有统计学意义(P<0.05),见表3。
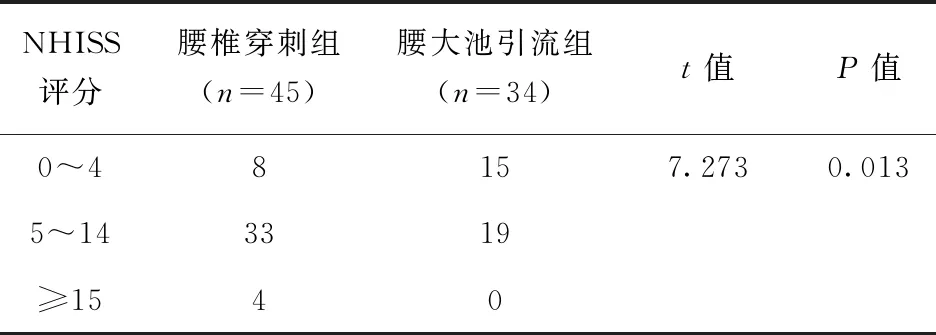
表3 两组患者入院14 d时NHISS评分对比
3 讨 论
临床CVS几乎不早于SAH后前3 d,常发生在3~14 d,峰值在SAH后4~12 d[5]。为降低血管痉挛风险,术前 Hunt- Hess分级较低的患者一般建议早期进行动脉瘤夹闭术,对于术前 Hunt- Hess分级Ⅲ~Ⅴ的患者,早期或晚期手术后发生 CVS的风险无明显差异。故为降低术后血管痉挛风险,若动脉瘤诊断明确,无明显手术禁忌都应尽早手术治疗[6]。血管痉挛是由血管内的平滑肌收缩所致,由舒张因子表达减少、收缩因子表达增强或二者共同作用引起。内源性收缩和舒张因子之间的平衡对调节血管张力十分重要,许多研究表明内皮素在动脉瘤性SAH后发生血管痉挛和迟发缺血性神经功能缺失的关键因素。其机制十分复杂,目前仍未明确,亦无治愈方法。SAH后,受损的血管内皮中的 ET-1直接泄露,因缺氧、缺血刺激的血管内皮,更多的ET-1得到释放 ,激活受体并诱导血管收缩,导致灌注压降低和血管阻力增加。NO对维持脑血管张力发挥十分重要的作用, SAH后血管内皮 eNOS及 cGMP表达水平降低,并受 ET-1浓度影响,其产物 NO减少,由 NO介导的血管舒张功能减弱[7]。同时,流入蛛网膜下腔的红细胞破裂分解释放氧合血红蛋白等其他物质,刺激血管同时也会抑制NO的合成,进一步加重痉挛[8]。腰大池引流可引出血性脑脊液,减少蛛网膜下腔积血,改善脑脊液循环,加速至痉挛因子的排放,减轻对舒张因子的抑制,并可以调节脑缺血状态,降低颅内高压,从而降低脑梗死、脑水肿、脑积水的发生[9]。本研究结果显示,观察组患者脑脊液中红细胞数目、ET-1、NO浓度水平均优于对照组,差异具有统计学意义(P<0.05),可见腰大池引流组可更有效改善脑血管痉挛相关指标;经多普勒超声测得 VMC水平,观察组指标优于对照组,与化验所得结论相符合;观察组患者神经功能缺损情况较对照组轻,符合上述结果。
综上所述,对于此类患者实施腰大池引流可更理想的排出脑脊液中红细胞,减少脑脊液ET-1含量,减轻对 NO生成的抑制,改善脑血管痉挛的风险,患者临床缺血症状,改善神经功能恢复,一定程度的缩短了住院时间,提高患者预后。

