污泥堆肥过程中细菌群落结构分析
李卓琼, 黄升日, 张皓楠, 李光春, 黄世臣, 王 娟, 朴春香
(延边大学农学院,吉林 延吉 133002)
随着我国经济和社会的快速发展,污水排放量不断增加,产生的污泥量也不断增多,2014年,我国年产干污泥量为3×106t[1]。污泥处理不当,会造成水体、大气、土壤等2次污染[2],而目前污泥处理速度远不及污泥产生速度,给我国环保工作造成了沉重的负担。污泥的处理方法主要有焚烧、卫生填埋和堆肥(好氧发酵法)等3种方法,其中,堆肥因其经济性、环境生态性及其资源再利用性较高,普遍被国内外所应用[3-4]。堆肥是利用微生物分解原料中的有机物而达到处理的目的[5],因此,了解堆肥化进程,不仅要看发酵温度、pH值、C/N等参数,更应把堆肥微生物多样性结构作为焦点。以目前的研究技术,能够培养的微生物不到10%[6],而且不能充分反映环境中的微生物多样性,因此,近年来,变性梯度凝胶电泳(Denaturing Gradient Gel Electrophoresis,DGGE)等分子生物学方法用于微生物分析的研究较多,在堆肥领域中也得到广泛应用[7-9]。
我国污泥的堆肥化处理尚处于起步阶段,虽然化肥具有营养成分含量高, 体积小, 单位面积用量少, 使用广泛、方便、肥效快等特点, 在农业生产中发挥了重要作用。但是大量施用化肥, 虽短期内一定程度上提高了作物产量, 但长期施用, 其累加效用导致了土壤微生态环境恶化, 养分比例失调,从而造成农作物品质下降, 进一步威胁到食品安全及人体健康。利用自制活性污泥及农业生产过程中的废弃物如麦糠、玉米秆、鸡粪等, 通过活性污泥中有益微生物种群的发酵作用, 生成大量适合土壤中微生物利用的如低聚糖等有机质, 既可以达到改良土质和供给作物营养的目的, 又能减少对环境的污染[10]。一些废弃的城市污泥和廉价的禽畜粪便对植物的生长发育有促进作用, 这些基质的应用可用来培育优质的苗木[11]。城市污泥是污水处理厂对污水处理过程中产生的固体或半固体沉淀物质, 通常包括初沉污泥和剩余污泥。城市污泥的特点是:1)产量大。根据中国环保总局提供的数字, 中国城市污水处理厂含水率97%的污泥产量为7.602~12.07万m3/d。2)成分复杂。城市污泥不仅含有大量的有机质和N、P、K等植物营养成份, 而且含有很多的病原微生物, 同时还含有一定的重金属和其他有害成份。这些污泥任意堆放和投弃将对环境造成新的污染, 如何妥善处置这些污泥已成为全世界共同关注的问题[12]。
有机肥施用是我国传统的农业生产方式,有关有机肥的研究文献较多,但对于有机肥的研究主要集中在有机肥在农作物的使用技术和土壤肥力影响等方面,而对于以不同物料进行有机肥的堆制研究文献很少[13]。对污泥堆肥化的研究主要集中于实验室内的试验研究,对实际应用过程中的效果,特别是对细菌菌群结构分析的研究尚不多见。该试验选择我国某污泥堆肥厂发酵过程中的污泥为研究对象,对其发酵各阶段的温度、pH值、C/N等进行了测定,用PCR-DGGE法对发酵细菌菌群结构进行了分析研究,该研究结果为评价我国城市污泥堆肥技术的应用现状提供理论依据,并为优化我国污泥堆肥处理技术提供更多信息。
1 材料与方法
1.1 材料
样品来自于我国某污泥堆肥厂的5个发酵堆,发酵原料为城市污泥。把原料及发酵产品以一定比例进行混合,致使发酵原料水分达到50%~60%。在发酵阶段,每7 d用铲车搅拌均匀,以提高堆肥的质量和蒸发水分,并避免形成厌氧条件。该堆肥厂共24个发酵槽,该试验分别选择了发酵时间为第11、15、19、23和30 d的5个发酵槽进行了采样。采样方法为:每次进行搅拌前,在堆肥体中间形成纵断面,分别在如图1所示的A、B、C、D 4点进行采样,供测含水率、pH值、C/N及DGGE分析等所用。
发酵槽的结构:宽550 cm,长1 350 cm,深度200 cm(图1)。底部布置3根排气管连接于鼓风机,以1.2 m3/h的速度进行通氧。
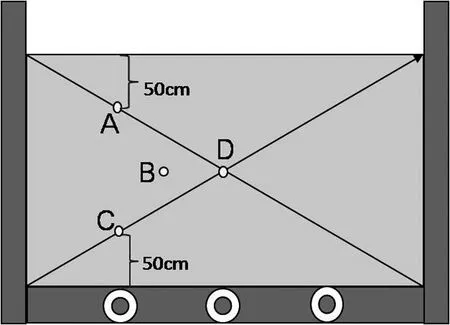
图1 发酵槽的结构(纵断面)及采样点布点情况
1.2 测定方法
1.2.1 温度的测定
对发酵堆进行搅拌前,形成纵断面,对如图1所示的A、B、C、D 4个采样点进行温度测定。测定用100 cm长的酒精温度计,形成纵断面后迅速插入温度计50 cm深,待温度计温度稳定后读取数据并记录。
1.2.2 含水率的测定
用国家标准法:称取30 g堆肥样品,在105 ℃烘箱内将样品烘24 h至恒重,然后测定烘干样品,记作样品的干重。
土壤含水量=(烘干前铝盒及土样质量-烘干后铝盒及土样质量)/(烘干后铝盒及土样质量-烘干空铝盒质量)×100%。
1.2.3 pH值的测定
称取10 g堆肥样品,放入三角瓶中加蒸馏水50 mL,振荡30 min,放置5 min,待溶液澄清后,用酸度计测定。
1.2.4 C/N(碳氮比)的测定
C/N用仪器(CN coder MT-700,yanaco,Tokyo,Japan)测定。
1.2.5 样品总DNA提取
样品的DNA抽出采用土壤DNA抽出专用试剂盒(ISOIL:Nippon Gene,Tokyo,Japan)。称取0.5 g样品放入2 mL灭菌离心管中,加入950 μL Lysis solution HE和Lysis solution 20S 50 μL,混合均匀后,在65 ℃下水浴60 min,10 000 r/min室温离心1 min。移取上清液600 μL于另一1.5 mL离心管中,加入400 μL Purification solution,混合,再加入600 μL氯仿后充分振荡混匀,10 000 r/min室温离心15 min。取水层800 μL,再次加入800 μL Purification solution,混合,15 000 r/min 4 ℃离心15 min。弃上清,在沉淀中加入1 mL Wash solution,充分混匀,15 000 r/min 4 ℃离心10 min。弃上清,在沉淀中加入1 mL70%乙醇和2 μL Ethachinmate,振荡混匀,15 000 r/min 4 ℃离心5 min。弃上清,倒置于吸水纸上空气干燥10~15 min,使乙醇挥发。加入100 μL TE(8.0)或dd H2O 溶解DNA,混匀后置于4 ℃待用或-20 ℃冰箱中保存。
1.2.6 PCR扩增
PCR引物序列如下:357F-GC,5'-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GCC TACGGG AGG CAG CAG-3';907R,5'-CCG TCA ATT CMT TTR AGT TT-3'。PCR用TaKaRa Bio,Ohtsu,Japan。
反应程序:94 ℃,10 min,1个循环;93 ℃,30 s,10个循环;65 ℃,30 s,10个循环;72 ℃,1 min,10个循环;93 ℃,30 s,10个循环;60 ℃,30 s,10个循环;72 ℃,1 min,10个循环;93 ℃,30 s,10个循环;55 ℃,30 s,10个循环;72 ℃,1 min,10个循环;72 ℃,5 min,1个循环。
反应体系:由 1 μL16S rDNA,2 μL dNTP混合物,19.8 μL 10×扩增缓冲液,0.2 μLTaq DNA聚合酶和2 μL底漆组成,共25 μL。
在进行DGGE之前,PCR扩增产物用1%(w/v)琼脂糖凝胶电泳检测。
1.2.7 PCR-DGGE法
PCR-DGGE分析用 DCode Universal Mutation Detection System(Bio-Rad,Hercules,CA,USA)。变性梯度凝胶厚1 mm,大小160×160 mm,缓冲液使用1×TAE。聚丙烯酰胺凝胶浓度梯度为8%~12%,变性剂浓度梯度30%~70%。电泳电压100 V,60 ℃条件下进行850 min。电泳后用SYBR Green I(Invitrogen,Carlsbad,CA,USA)染色 30 min,清洗后在凝胶呈像仪下呈像。
1.2.8 基因序列分析
在紫外灯下用1 000 μL移液枪把凝胶吸回,获得DGGE条带,放置在50 μL蒸馏水中。切下来的条带中的DNA用357F-GC和 907R引物重新扩增,PCR反应体系和反应条件同上。扩增产物再用DGGE法确定原始条带的位置。这些步骤重复进行,直至唯一1条单带出现。之后用Wizard® SV Gel and PCR Clean-Up System(Promega)对 PCR产物进行纯化处理,并送往生物技术公司进行测序。测序结果利用DNA数据库提供的DDBJ-BLAS(http://blast.ncbi.nlm.nih.gov/)程序进行系统进化分析。
2 结果与分析
2.1 发酵温度、水分含量、pH值和C/N的变化
表1~4各表示发酵第11、15、19、23和30 d发酵槽中A、B、C、D 4个点的温度、水分含量、pH值和C/N的测定结果。
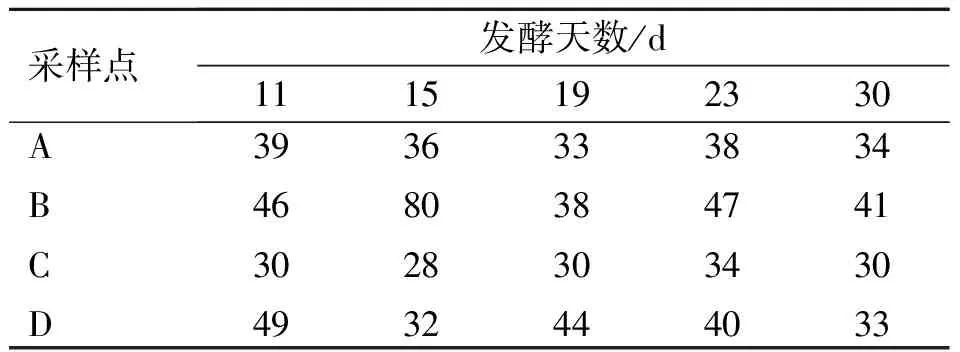
表1 堆肥过程中发酵温度的变化
发酵温度在一定程度上反映发酵的进程及发酵效果的好坏,实验过程中,发酵温度最高80 ℃,最低28 ℃,20个采样点中,除了2个温度最高点和最低点之外,均在30~50 ℃之间。总体上,发酵温度比采样时室温(28 ℃)偏高,说明该堆肥发酵正常进行,但发酵温度跟理想值(50 ℃左右)相比偏低(50 ℃),不到40 ℃的点数为13个,超过50 ℃的只有1个点,发酵温度低会影响发酵速度及水分蒸发,也不利于杀死病原菌。A、B、C、D 4个点中,B点温度相对最高,其次为D点和A点,C点最低。这可能与离排气管的距离有关,C点离排气管最近,虽然增大与氧气接触面积,但由于冷空气的干扰导致温度最低,A点虽然离排气管最远,但因离外部环境距离近,损失热量相对多,温度也不高,而B点和D点处于发酵体中间位置,而D点比B点离排气管更近,受供气影响更大,因此,B点温度最高。发酵第15天发酵堆的条带数相对少于其他点,这可能与该发酵堆发酵温度高于其他发酵堆有关(B点80 ℃),高温环境下微生物不易生存,在B点只有1个明显条带和3个不明显条带。但发酵第15天发酵堆中,除了B点外,其他3个点的高亮度的条带相对多,表明该发酵堆优势菌种种类丰富,有利于发酵的进行,有一部分菌种可能来自于原料。
表2显示堆肥水分含量的变化,5个发酵堆水分含量在35.5%~54.9%之间,发酵堆之间差距大,不同发酵堆同一个采样点之间最大差距17.5%,同一个发酵堆不同采样点之间差距小,最大3.7%。总体上,5个发酵堆水分含量均在好氧发酵允许范围之内,但发酵堆之间水分含量差距较大,且发酵末期水分含量偏高,这不利于再加工和搬运。
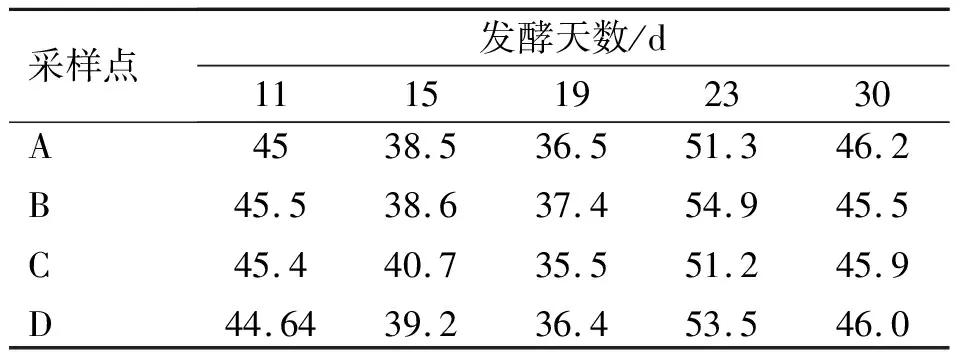
表2 堆肥过程中水分含量的变化
污泥堆肥过程中容易产生有机酸,致使pH值下降[10],导致反应速度减慢甚至停止,该次调查中,pH值在7.2~8.3之间(表3),基本处于好氧发酵最佳pH值范围(6.5~8.0)内[14]。
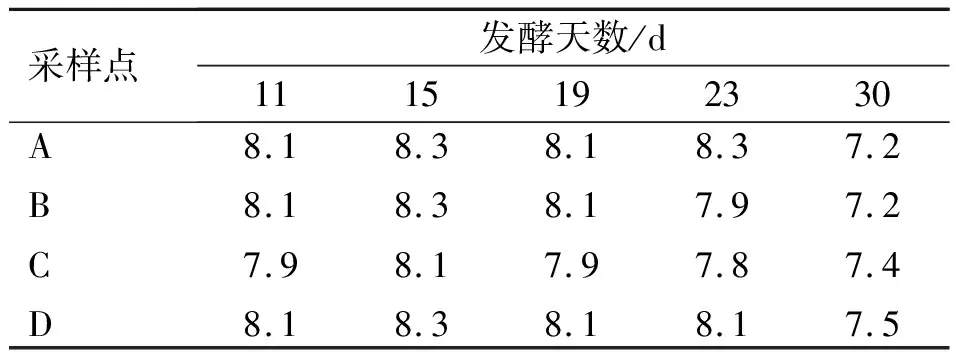
表3 堆肥过程中pH值的变化
堆肥中的碳和氮为微生物提供能量和细胞构成基本材料[14]。由表4可知,C/N为8.52~11.13时,发酵堆之间和各采样点之间差距小。因发酵堆不同,原料也不同,因此,未能观察到C/N随时间推移的变化规律。
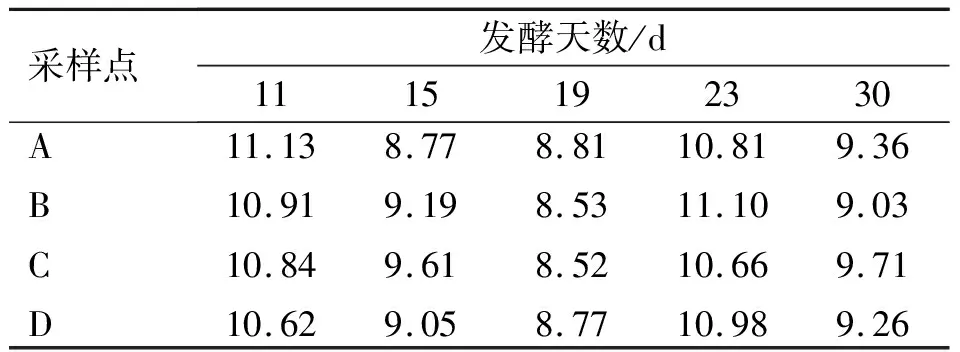
表4 堆肥过程中碳氮比(C/N)的变化
2.2 PCR-DGGE分析结果
对5个发酵堆20个采样点进行现场采样,提取了DNA,并用DGGE法针对细菌16S rDNA基因片段进行分类鉴定。5个发酵堆的菌群结构呈现了基本相同的电泳图谱,从条带位置、个数、亮度等方面均类似(图2)。5个发酵堆原料进厂时间不同,来源和成分也不尽相同,但发酵过程中的菌群结构相似,说明该厂发酵菌群非常稳定,其中理由之一为该厂把发酵最终产物作为水分调节剂与原料进行混合并发酵,最终产物里含有大量发酵菌群,再次发酵时可以继续发挥分解作用,起到了添加菌剂的作用。
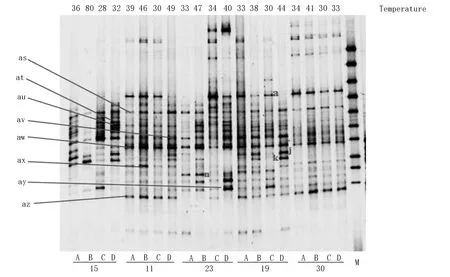
图2 DGGE分析结果
其中a、as、av、aw在不同堆肥堆的不同点均能发现,可能是该堆肥厂的优势菌种,对好氧发酵起重要作用,j和k在较高温度下表现更亮,表明可能在中高温区主要由这2种菌种起主要作用。发酵第15天发酵堆的条带数相对少于其他点,这可能与该发酵堆发酵温度高于其他发酵堆有关(B点80 ℃),高温环境下微生物不易生存,在B点只有1个明显条带和3个不明显条带。但发酵第15天发酵堆中,除了B点外,其他3个点的高亮度条带相对多,表明该发酵堆优势菌种种类丰富,有利于发酵的进行,有一部分菌种可能来自于原料。这次分析中未能观察到微生物菌群随发酵时间的变化趋势,这可能与试验选择了不同的发酵堆有关,因5个发酵堆起始点的原料、水分、pH值,C/N等均不相同,发酵进程也不同,将会导致参加发酵的微生物菌群也不同(表5)。
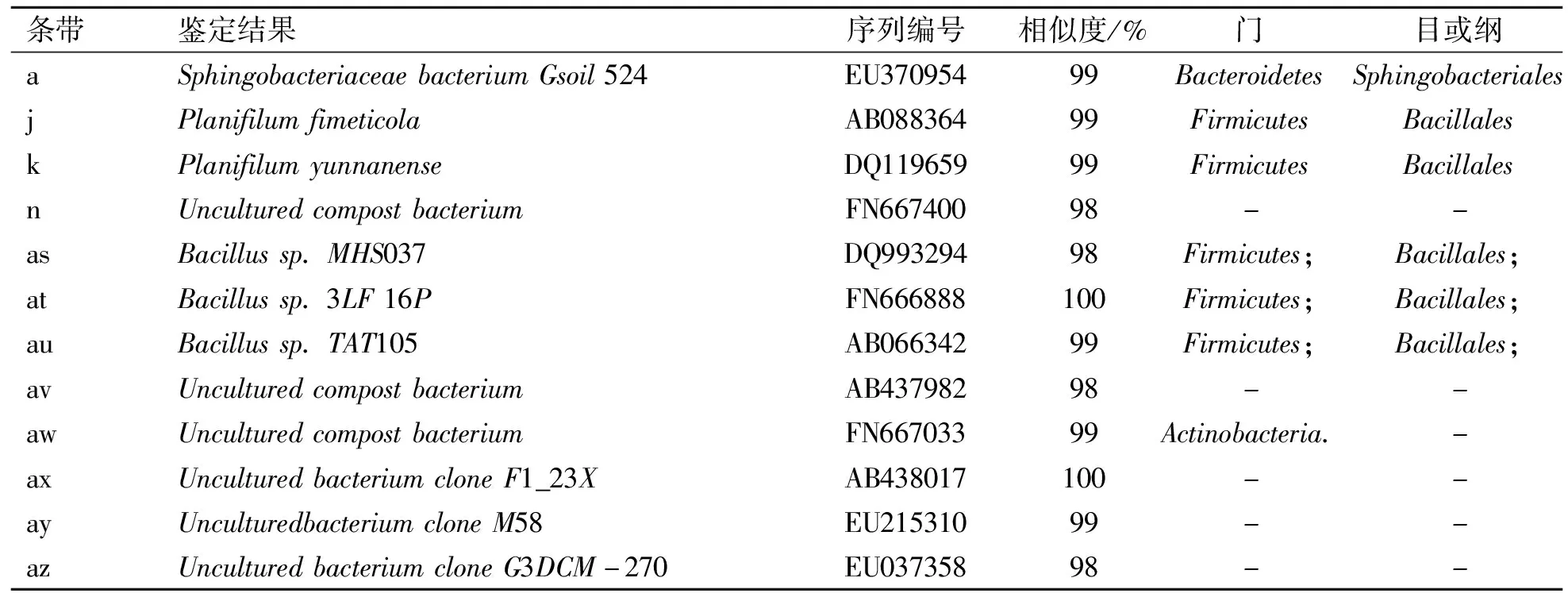
表5 菌种类似性分析对比表
这次PCR-DGGE分析中共鉴定出3个门(Bacteroidetes,Firmicutes和Actinobacteria)3个目(Sphingobacteriales,Bacillales和不明目)的7种菌和不确定菌种5种。a点菌种与SphingobacteriaceaebacteriumGsoil524(EU370954)相似度达99%,SphingobacteriaceaebacteriumGsoil524发现于人参养殖地的土壤中,属于好氧细菌[15]。Bacillales目是各种好养发酵过程中最常出现的菌属之一,在发酵初期和高温期最容易出现,是典型好养细菌。Actinobacteria门经常出现在土壤、好氧堆肥中,大部分为好气性。不确定所属的6个菌种中3种曾在其他堆肥中发现,其他3种为难培养微生物。j和k属于Bacillales目,很可能属于好热性细菌,属高温细菌。总体上,该堆肥厂优势菌种主要为芽胞杆菌属,这与其他好氧发酵的分析结果相同。
3 结论与讨论
虽然我国堆肥历史较长,但因对堆肥的重视程度不够,发展较慢,因此对堆肥的基础研究不够深入,对堆肥的微生物研究近几年才开始逐渐活跃起来,只有了解微生物菌群多样性、优势菌种、动态等,才能更深入了解其发酵机理,并能更好的控制其他条件而提高效率,改善发酵技术。
该研究选择了我国某新建堆肥厂发酵过程中的污泥为对象,了解了发酵基本情况,用PCR-DGGE法进行了微生物群落结构分析。该堆肥厂好氧发酵基本良好,但也存在发酵温度偏低、水分偏高等问题,可通过控制初始原料的条件和加强发酵过程管理提高发酵效率。微生物群落分析中,共鉴定出Bacteroidetes,Firmicutes和Actinobacteria3个门的7种菌和不确定菌种5种,推断Bacillales目是该堆肥厂优势菌种。但PCR-DGGE法有条带共迁移等缺陷,不能以此结果完全了解堆肥情况,可以结合培养法和其他分子生物学方法提高客观准确性。在该试验中,因客观原因,没有对发酵初期(1~10 d)的样品进行分析,因此没能观察到发酵温度、水分、C/N以及微生物菌群随发酵时间而变化的过程,近期将继续对该部分进行研究。

