过表达KAR2基因对毕赤酵母产米黑根毛霉脂肪酶的影响
黄金金 孙梦雪 王一洲 赵庆伊 张馨 张恺倪

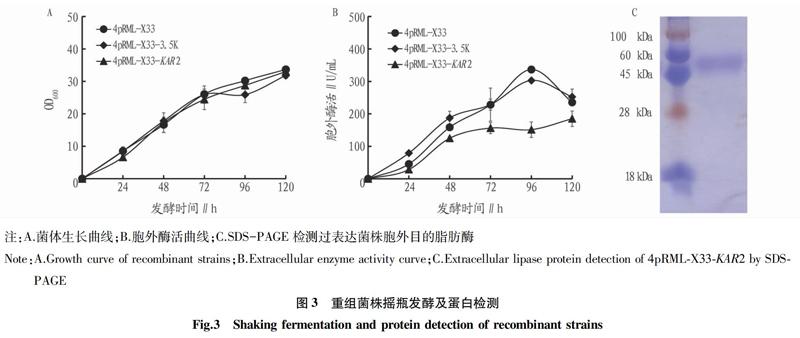
摘要 Kar2p是分子伴侣蛋白,可与新生肽结合,促进新生肽进入内质网。为研究其对米黑根毛霉脂肪酶 (RML) 在毕赤酵母中表达的影响,通过PCR方法从毕赤酵母菌株中克隆到 KAR2 基因,并用毕赤酵母胞内表达载体pPIC3.5K构建过表达质粒 KAR2 -pPIC3.5K。用电转化的方法,将 KAR2 -pPIC3.5K二次转化到含4-拷 贝rml基 因的毕赤酵母重组菌株4pRML-X33中,获得能同时过表达RML和KAR2p的二次转化子4pRML-X33- KAR2 。摇瓶发酵发现,过表达 KAR2 基因对菌株生长无明显影响,但RML胞外酶活降低。采用RT-qPCR方法分析菌 中rml 及UPR相关基因的转录水平,发现 KAR2 基因转录水平上调了3.7倍,虽然仅引起与UPR相关的 HAC1 基因转录水平的下调,但却 使rml的 表达下调43%。说明 KAR2 过表达导致RML产量降低是降低了 rml 的mRNA量,而不是增加内质网中蛋白折叠的压力。
关键词 米黑根毛霉脂肪酶; KAR2 ;过表达;毕赤酵母;UPR
中图分类号 Q78 文献标识码 A
文章编号 0517-6611(2020)14-0103-05
doi:10.3969/j.issn.0517-6611.2020.14.028
Abstract Kar2p is a molecular chaperone that binds to new peptides and facilitates their entry into the endoplasmic reticulum (ER).In order to study its effect on the expression of Rhizomucor miehei lipase (RML) in Pichia pastoris,KAR2 gene was cloned from Pichia pastoris gDNA by PCR method.And it was ligated to vector pPIC3.5K to obtained the intracellular overexpression plasmid KAR2 -pPIC3.5K. KAR2 -pPIC3.5K was then transformed into Pichia pastoris recombinant strain 4pRML-X33 which containing 4 copies of rml gene used electroporation transformation method.The twice transformant 4pRML-X33- KAR2 that could overexpress both RML and KAR2p was obtained.Shaking flask fermentation found that overexpression of KAR2 gene had no significant effect on strain growth,but the extracellular enzyme activity of RML decreased.Then rml mRNA level and transcription level of UPR-related genes were analyzed used RT-qPCR method.Results found that the transcription level of KAR2 increased 3.7 times,and only caused downregulation of the transcription level of the HAC1 gene associated with UPR,while rml mRNA decreased 43%.Those results suggested that the decrease in RML production after overexpression of KAR2 was due to the reduction of rml mRNA,rather than increased the protein folding pressure in ER.
Key words Rhizomucor miehei lipase; KAR2 ;Overexpression; Pichia pastoris; UPR
巴斯德畢赤酵母 (Pichia pastoris) 作为异源基因的表达体系已有近30年的历史,该表达体系成功表达了多种饲料酶、食品酶等,目前已发展成生产异源蛋白质最重要的工业宿主之一[1]。巴斯德毕赤酵母具有其他蛋白表达宿主不可替代的优势:严格的醇氧化酶启动子调控机制;基因操作方法简单;工业发酵过程成熟;内源蛋白分泌少;可对异源蛋白进行翻译后修饰等[2]。2009年,巴斯德毕赤酵母完整的基因组序列被公布[3]。据统计,有超过5 000种异源蛋白在巴斯德毕赤酵母表达体系中成功表达[4]。目前在该表达体系中报道的异源蛋白产量最高的是里氏木霉纤维素酶,产量高达18 g/L[5]。
尽管毕赤酵母成功表达多种异源蛋白,但异源蛋白的产量受诸多因素影响。提高异源蛋白产量的研究主要集中在优化培养条件[6]、启动子类型[7]、外源基因密码子[8]、外源基因拷贝数[9]以及蛋白折叠过程和分泌途径的改造[10]。特别是在多拷贝重组菌株中共表达蛋白合成分泌途径中的伴侣蛋白,以缓解因异源蛋白过表达引起的宿主蛋白折叠压力和分泌阻力,从而达到增加异源蛋白产量的目的[10]。其中与内质网中未折叠蛋白反应 (unfolded protein response,UPR) 相关的 HAC1、KAR2、PDI和ERO1等 基因的共表达可分别增加内聚葡萄糖1[11]、生物表面活性剂HFPI[12]、人类免疫缺陷病毒Ⅰ型的抗体片段(2F5mAb)[13]和α-半乳糖苷酶[14]的产量。但不是共表达伴侣蛋白都可以提高蛋白产量,研究发现,过表达 PDI 降低了猪胰岛素前体在毕赤酵母中的表达水平[15]。
在4个UPR相关基因中,Kar2p可与新生肽结合,促进其进入内质网[9]。研究表明在毕赤酵母中过表达 KAR2 基因虽然抑制了假黑盘菌素表达[16],但提高了解脂耶氏酵母脂肪酶的表达[14]。但上述研究均未阐明异源蛋白产量变化的原因。可见针对不同的异源蛋白,在毕赤酵母中过表达 KAR2 基因对外源蛋白产量影响及机理不清楚。
米黑根毛霉脂肪酶 (Rhizomucor miehei lipase,RML) 是一种重要的工业用酶,因其能够催化水解、酯化、转酯化和氨解等多种反应,广泛用于饲料、油脂加工、食品风味改良、医药和能源等行业中 [9,17]。研究前期,获得了一株胞外产RML的4-拷贝毕赤酵母重组菌株(4pRML-X33)[9]。目前没有 KAR2 基因在多拷贝 rml毕赤 酵母重组菌中过表达对RML产量影响及机制的研究。该研究通过在4-拷贝的RML生产菌株(4pRML-X33)中过表达 KAR2 基因,探讨其对RML胞外酶活的影响及机制,为研究异源蛋白在毕赤酵母中表达提供新的参考依据。
1 材料与方法
1.1 菌株及质粒
巴斯德毕赤酵母野生型菌株X-33 (Pichia pastoris X-33) 和含有4-拷贝 rml 基因的重组菌株 (4pRML-X33) 及胞内蛋白表达载体pPIC3.5K系中国农业大学李颖教授实验室赠与。大肠杆菌Trans1-T1感受态细胞 (CD501-02) 购买于北京全式金生物技术有限公司。
1.2 KAR2 基因克隆及过表达菌株构建
1.2.1 D-2 buffer提取毕赤酵母基因组DNA (gDNA)。
在超净台中,用灭菌的牙签挑取火柴头大小的毕赤酵母单菌落于100 μL D-2 buffer[4 mol/L异硫氰酸胍,50 mmol/L Tris-HCl (pH8.0),5 mmol/L EDTA,0.1 mol/L β-巯基乙醇]中,轻轻混匀。混合液在沸水中煮5 min后置于冰上冷却,12 000 r/min 离心2 min,弃上清。沉淀用200 μL无菌水洗涤,12 000 r/min离心2 min,弃上清。重复洗涤沉淀3次后,用20 μL无菌水悬浮。悬浮液在沸水中煮5 min后放冰上冷却。12 000 r/min离心2 min,保存上清,获得毕赤酵母的gDNA。吸取上清5~10 μL 用作PCR模板。
1.2.2 KAR2 基因过表达质粒的构建。根据 KAR2 (GenBank: NC_012964.1) 的核苷酸序列设计扩增引物 KAR2 -F: 5′-CGGGATCC ( Bam H I) ACCATGCTGTCGTTAAAACCATCTTG-3′ 和 KAR2 -R: 5′-ATAAGAATGCGGCCGC ( Not I) CTACAACTCATCATGATCATAGTCAT-3′。以X-33的gDNA为模板, KAR2 -F 和 KAR2 -R 为引物,采用Q5 超保真DNA 聚合酶 (M0491,NEB) 克隆获得 KAR2 基因。琼脂糖凝胶电泳后回收 KAR2 基因片段。酵母胞内表达载体pPIC3.5K和 KAR2 基因片段分别用 Bam H I和 Not I进行双酶切。双酶切后的基因片段和载体用T4 DNA Ligase (M0202,NEB) 连接后转化到大肠杆菌Trans1-T1,涂布到卡那霉素的LB平板上。待其长出单菌落,取转化子进行菌落PCR验证。验证的引物为5′AOX1 (5′-GACTGGTTCCAATTGACAAGC-3′ ) 和3′AOX1 (5′-GCAAATGGCATTCTGACATCC-3′ )。獲得 KAR2 的胞内表达质粒 KAR2 -pPIC3.5K。
1.2.3 KAR2 基因过表达菌株的构建。用 Bsp E I线性化胞内过表达质粒 KAR2 -pPIC3.5K。将线性化的 KAR2 -pPIC3.5K二次电转化到含有4-拷贝 rml 基因的重组菌株 (4pRML-X33) 中,电转化的条件为1.5 kV、200 Ω和25 μF。转化液涂布于含有G418 (250 μg/mL) 和Zeocin (100 μg/mL) 的YPDS (1%酵母粉、2%蛋白胨、2%葡萄糖、1 mol/L 山梨醇、2%琼脂粉) 平板上,28 ℃倒置培养2~3 d,长出过表达菌株的单菌落。单菌落在YPDS平板上划线扩大培养后,用D-2 buffer快速提取各菌株的gDNA。以gDNA 为模板,5′AOX1和 KAR2 -R为扩增引物,扩增 KAR2 基因,以筛选获得正确的 KAR2 过表达菌株4pRML-X33- KAR2 。同样的步骤将pPIC3.5K电转化到4pRML-X33中,筛选获得只含有pPIC3.5K的重组菌株4pRML-X33-3.5K。
1.3 菌株摇瓶发酵及RML酶活检测
1.3.1 摇瓶发酵。重组菌株4pRML-X33、4pRML-X33-3.5K和4pRML-X33- KAR2 的摇瓶发酵方法参照文献[9]。菌株在YPD平板上长出单菌落,将单菌落接种于BMGY 培养基(1%酵母粉、2%蛋白胨和1%甘油) 的三角瓶中,三角瓶装液量为1/10。摇床28 ℃、200 r/min培养至OD600介于4.0~8.0,作为种子液。取种子液转接到含有BMMY 培养基 (1%酵母粉、2%蛋白胨、1.0%甲醇、100 mmol/L 磷酸缓冲液,pH 7.0) 的三角瓶中,装液量为1/10。三角瓶置于28 ℃摇床发酵、转速为200 r/min。每24 h 向三角瓶中补加甲醇至其终浓度为1% (V/V ),以诱导蛋白表达。当酶活不再增加时停止发酵。每24 h取样检测菌株生长和胞外酶活。
1.3.2 NaOH滴定法检测RML的酶活。
用无CO2的ddH2O 配制成5 mol/L的NaOH储液,准确稀释成0.05 mol/L的工作液。用邻苯二甲酸氢钾确定储液的准确浓度。称20 g PVA-1750于1 L蒸馏水中,反复加热使之溶解。溶解液冷却后用四层纱布过滤,并定容至1 L获得2% PVA-1750。橄榄油与2% PVA-1750按体积比1∶3混合,乳化成PVA-橄榄油乳化液。取5 mL PVA-橄榄油乳化液和4 mL 0.1 mol/L pH 6.0的柠檬酸-磷酸钠缓冲液于150 mL三角瓶中,置于水浴摇床中35 ℃、150 r/min,预热10 min。将1 mL稀释好的发酵液加到上述三角瓶中反应10 min,用15 mL无水乙醇终止反应。空白对照:将1 mL发酵液加入到15 mL无水乙醇中失活10 min,再加入到底物和缓冲液中。以酚酞作指示剂,0.05 mol/L NaOH进行酸碱滴定反应,直至溶液刚刚变为粉红色且30 s不褪色,记录反应消耗的NaOH体积。在该测定条件下,1 min释放1 μmol脂肪酸的酶量定义为一个酶活单位。酶活计算公式: V NaOH×发酵液稀释倍数×5。消耗的NaOH体积需处于1.0~2.5 mL,否则要对发酵液重新稀释。
1.4 SDS-PAGE检测目的蛋白
取1 mL 发酵后的菌液12 000 r/min离心5 min。上清与5× SDS-PAGE 蛋白上样缓冲液混合。上样缓冲液的成分为250 mmol/L Tris-HCl (pH 6.8)、5% (W/V) β-巯基乙醇、0.5% ( W/V) BPB、10% ( W/V) SDS和50%( V/V) 甘油。混合液在沸水中煮10 min,室温冷却,作为SDS-PAGE样品。SDS-PAGE 采用5%浓缩胶和12%分离胶,染色采用考马斯亮蓝R250染色法。具体方法参照文献[18]。
1.5 RNA提取及实时荧光定量PCR (Real-time quantitative PCR,RT-qPCR)
1.5.1 毕赤酵母总RNA提取及反转录成cDNA。取摇瓶发酵96 h的菌体,用TRIzol法提取总酵母RNA[19]。TransScript Green两步法RT-qPCR SuperMix (Transgen biotech Co., Beijing,China) 将RNA反转录成cDNA。
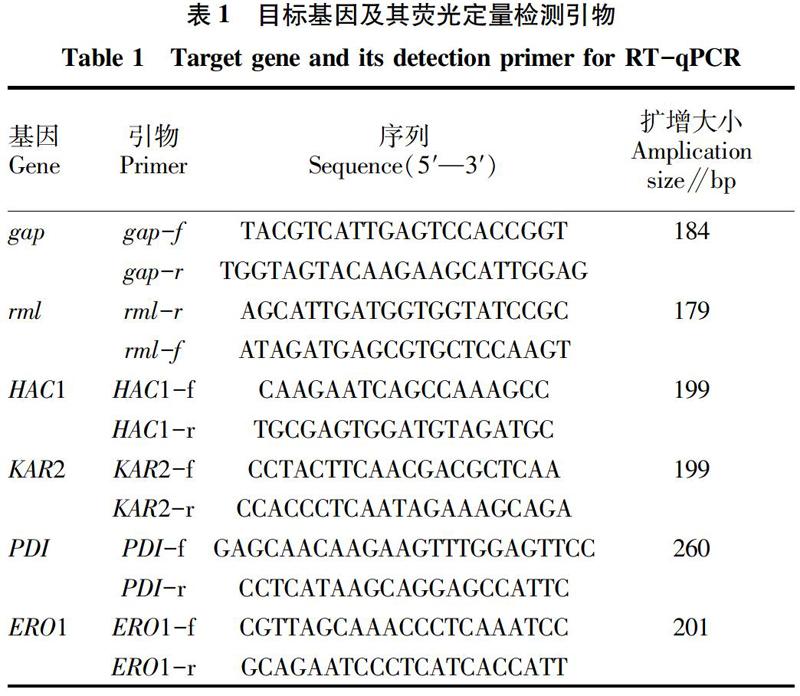
1.5.2 RT-qPCR。RT-qPCR的方法参照文献[9],使用甘油醛-3-磷酸脱氢酶基因 (gap) 为内参基因。不同之处是该试验采用ABI StepOnePlus系统,以ABI PowerUp SYBR Green Master Mix (A25742,ABI,USA)作为荧光染料。 gap、rml 和UPR相关基因 HAC1、KAR2、PDI、ERO1 的qPCR引物列于表1[9]。
2 結果与分析
2.1 过表达质粒 KAR2 -pPIC3.5K的构建
根据pPIC3.5K多克隆位点和 KAR2 基因的特点,在 KAR2 基因的上游和下游引物上分别引入 Bam H I和 Not I酶切位点。以X-33的gDNA为模板,通过PCR扩增获得 KAR2 基因,基因长度为2 037 bp (图1 A)。用质粒提取试剂盒提取pPIC3.5K载体,载体大小为9 004 bp (图1B)。用 Bam H I和 Not I双酶切 KAR2 基因片段和pPIC3.5K载体 (图1C),并通过T4 DNA连接酶将二者连接,转化到大肠杆菌中,提取转化子中的重组质粒。用 Bam H I和 Not I双酶切筛选重组质粒,发现出现2条带:一条大小约为2 037 bp,另一条约为9 004 bp (图1D)。将 KAR2 -pPIC3.5K送至苏州金唯智生物科技有限公司进行序列测定,发现测序结果与GenBank: NC_012964.1中序列完全一致,获得 KAR2 -pPIC3.5K重组质粒。
2.2 过表达菌株4pRML-X33- KAR2 的构建及验证
按照前述方法,用 Bsp E I线性化重组质粒 KAR2 -pPIC3.5K后,采用电转化的方法将线性化的质粒二次转化到4pRML-X33中。G418和Zeocin双抗性平板筛选得到4pRML-X33- KAR2 转化子 (图2A)。将转化子进行平板划线扩大培养,取3个转化子用D-2 buffer 提取转化子的gDNA。分别以3个转化子的gDNA为模板,5AOX1和 KAR2 -R引物进行菌落PCR验证阳性转化子,结果见图2B。结果发现,3个转化子均扩增到目的条带,说明均为阳性转化子,成功筛选到4pRML-X33- KAR2 菌株。对照菌株4pRML-X33-3.5K是将pPIC3.5K线性化后电转到4pRML-X33。
[4]SCHWARZHANS J P,LUTTERMANN T,GEIER M,et al.Towards systems metabolic engineering in Pichia pastoris [J].Biotechnol Adv,2017,35:681-710.
[5]MELLITZER A,RUTH C,GUSTAFSSON C,et al.Synergistic modular promoter and gene optimization to push cellulase secretion by Pichia pastoris beyond existing benchmarks[J].J Biotechnol,2014,191:187-195.
[6]HUANG J J,YANG Z,GUAN F F,et al.A novel mono- and diacylglycerol lipase highly expressed in Pichia pastoris and its application for food emulsifier preparation[J].Process Biochem,2013,48:1899-1904.
[7]HE D,LUO W,WANG Z Y,et al.Combined use of GAP and AOX1 promoters and optimization of culture conditions to enhance expression of Rhizomucor miehei lipase[J].J Ind Microbiol Biotechnol,2015,42:1175-1182.
[8]LUO W,WANG Z Y,MIAO C L,et al.Expression of lipase gene from Rhizomucor miehei in Pichia pastoris and properties of lipase[J].Chem Ind Forest Prod,2016,36:135-140.
[9]HUANG J J,XIA J,YANG Z,et al.Improved production of a recombinant Rhizomucor miehei lipase expressed in Pichia pastoris and its application for conversion of microalgae oil to biodiesel[J].Biotechnol Biofuels,2014,7:1-11.
[10]ZHENG X Y,ZHANG Y M,ZHANG X Y,et al.Fhl1p protein,a positive transcription factor in Pichia pastoris, enhances the expression of recombinant proteins[J].Microb Cell Fact,2019,18:207.
[11]LI L,HUANG C,ZHAO F G,et al.Improved production and characterization of Volvariella volvacea Endoglucanase 1 expressed in Pichia pastoris [J].Protein Expres Purif,2018,152:107-113.
[12]SALLADA N G,HARKINS L E,BERGER B W.Effect of gene copy number and chaperone coexpression on recombinant hydrophobin HFBI biosurfactant production in Pichia pastoris [J].Biotechnol Bioeng,2019,116:2029-2040.
[13]GASSER B,SAUER M,MAURER M et al.Transcriptomics-based identification of novel factors enhancing heterologous protein secretion in yeasts[J].Applied and environmental microbiology,2007,73:6499-6507.
[14]HAN Z G,ZHANG J W,JIANG X F,et al. Gene dosage and coexpression with endoplasmic reticulum secretion-associated factors improved the secretory expression of alpha-galactosidase[J].Protein Expres Purif,2019,153:83-91.
[15]ZHU T,GUO M,TANG Z,et al.Efficient generation of multi-copy strains for optimizing secretory expression of porcine insulin precursor in yeast Pichia pastoris [J].J Appl Microbiol,2009,107:954-963.
[16]王楠,李剛强,郭文芳,等.毕赤酵母KAR2p过表达对假黑盘菌素表达量的影响[J].生物技术通报,2016,32(1):180-186.
[17]DIAO X Q,GUAN H N,KONG B H,et al.Preparation of diacylglycerol from lard by enzymatic glycerolysis and its compositional characteristics[J].Korean J Food Sci An,2017,37:813-822.
[18]SHEN Q,WU M,WANG H B,et al.The effect of gene copy number and co-expression of chaperone on production of albumin fusion proteins in Pichia pastoris [J].Appl Microbiol Biotechnol,2012,96:763-772.
[19]HUANG J J,WANG Q,BU W,et al.Different construction strategies affected on the physiology of Pichia pastoris strains highly expressed lipase by transcriptional analysis of key genes[J].Bioengineered,2019,10(1):150-161.
[20]DELIC M,VALLI M,GRAF A B,et al.The secretory pathway:Exploring yeast diversity[J].FEMS Microbiol Rev,2013,37:872-914.

