不同土壤含水量下槟榔幼苗形态和生理特性
李晗 杨福孙 李昌珍 陈奇 张瀚 纠凤凤 陈才志

摘 要:為了明确土壤水分与槟榔生长之间的关系,从而确定合理的槟榔灌溉技术。以槟榔幼苗为对象,设置5个水分梯度,分别是T1:(30±5)%、T2:(45±5)%、T3:(60±5)%、T4:(75±5)%、T5:(90±5)%,测定槟榔幼苗的形态、光合特性以及叶绿素含量和根系活力等指标。结果表明:(1)55%~65%的土壤相对含水量可以提高槟榔幼苗的株高、茎粗、叶面积和叶长,其中槟榔幼苗的株高和茎粗比在25%~35%的土壤相对含水量下分别提高了26.89%、19.89%,并且槟榔幼苗的净光合速率、蒸腾速率均达显著水平。当土壤相对含水量大于65%时,槟榔幼苗的裂叶长不断增加,但叶绿素含量逐渐降低。(2)当土壤相对含水量低于55%时,槟榔幼苗的叶绿素含量和根系活力出现下降趋势,随着土壤相对含水量的不断降低,槟榔幼苗的根冠比不断增加。(3)在30%左右土壤相对含水量下槟榔幼苗叶绿素含量达最低值11.16 mg/g,但水分利用率相对其他处理较高,植株叶片发黄且矮小,根系活力也较小。综上所述,当土壤相对含水量为55%~65%时,有利于槟榔幼苗生长。
关键词:槟榔幼苗;土壤水分;光合特性;生理特性中图分类号:S31 文献标识码:A
Morphological and Physiological Characteristics ofAreca catechu L. Seedlings under Different Soil Moisture Contents
LI Han, YANG Fusun*, LI Changzhen, CHEN Qi, ZHANG Han, JIU Fengfeng, CHEN Caizhi
College of Tropical Crop, Hainan University, Haikou, Hainan 570228, China
Abstract: Five water gradients, T1: (30±5)%, T2: (45±5)%, T3: (60±5)%, T4: (75±5)%, T5: (90±5)%, were used to clarify the relationship between soil moisture and areca seedlings (Areca catechu L. seedling). The morphology, photosynthetic characteristics, chlorophyll content and root activity of the seedlings were determined. The result showed that the relative soil water content of about 55%–65% could increase the plant height, stem diameter, leaf area and leaf length. The plant height and stem diameter ratio of the seedlings increased by 26.89% and 19.89% respectively under 25%–35% relative soil water content. And the net photosynthetic rate and transpiration rate of the seedlings reached significant levels. When the relative soil water content was more than 55%–65%, the cracked leaves of the seedlings increased, but the chlorophyll content decreased gradually. When the relative soil water content was less than 55%, the chlorophyll content and root activity of the seedlings decreased. With the decrease of soil relative water content, the root-shoot ratio of the seedlings increased. The chlorophyll content of the seedlings reached the lowest value of 11.16 mg/g under 30% relative soil water content, but the water use efficiency was higher than that in other treatments. The leaves of the seedlings were yellow, and the plants were short, and the root activity was also small. In conclusion, when the relative water content in soil was 55%–65%, it was beneficial to the growth of areca seedlings.
Keywords: Areca catechuL. seedling; soil moisture; photosynthetic characteristics; physiological characters
DOI: 10.3969/j.issn.1000-2561.2020.06.009
水是植物生长发育的一个重要生境因子,植物对水分的需求是有一定限度的,过多过少都不利于植物的生长[1]。不同植物或同一植物在不同的生长发育阶段需水量有所差异,这与植物的生长速度、生理生化活动、形态建成的快慢关系密切[2-3]。干旱胁迫发生时,植物首先通过保持水分吸收和减少水分损失来维持体内的水分平衡,比如减少叶面积,增加根冠比等,并以渗透调节作用和细胞壁的弹性来保持一定的膨压,以保障植物在干旱条件下继续生长[4-5]。
光合作用是绿色植物获得能量的主要方式[6]。光合速率的大小与植物的水分状况密切相关,主要是通过蒸腾速率、光合速率、胞间CO2浓度等光合参数表示。植物的光合作用既受其自身结构和生理状况调节的影响,也受外界因子的影响。其中,土壤相对含水量是影响叶片光合特性的重要指標[7]。研究表明,水分供应不足会直接影响光合器官的结构和功能,如叶绿体结构、类囊体膜的透性和流动性以及叶绿素含量[8]。另外,水分供应不足会减小植物叶片气孔导度,导致CO2浓度降低,光合产物运输受阻,光合产物在叶片中过量积累而导致反馈抑制,内源激素平衡失调,继而间接影响到光合作用[9]。随着土壤水分的减少,植物的Pn(净光合速率)、Tr(蒸腾速率)明显下降,而WUE(水分利用率)在一定的水分胁迫范围升高[10]。
槟榔(Areca catechu L.)属棕榈科槟榔属常绿乔木,原产于马来西亚,中国主要分布在云南、海南、台湾等热带及亚热带地区[11]。因其具有利水理气,祛湿驱寒等功效而被称为“四大南药”之一[12]。在海南,槟榔多种植于坡地,其种植者多以农户为主,因槟榔具有很好的抗逆性,所以大多管理粗放,很多槟榔园地因水肥管理不当和农业生产水平较低,造成营养缺失和水肥失衡,严重影响了槟榔的生长发育[12-13]。另外,海南位于热带北缘,有“天然大温室”之称,季节性干旱严重,加上农户不擅管理,槟榔的水分条件不容乐观[14-15]。植物有机物质的积累来源于光合作用,而水分又是光合作用必不可少的条件,也是决定植物生产力高低和生长发育的基础。因此,研究不同土壤水分条件对槟榔生长发育的影响尤为重要[16]。近年来,国内对于槟榔的研究方向主要在药理方面,而对于槟榔完整的生理特性进行系统研究的甚少[17-18]。本研究通过研究不同土壤相对含水量对槟榔幼苗形态、光合以及生理特性的影响,探讨在槟榔生产中适宜的需水量,以期为槟榔的栽培和管理提供理论和技术指导。
1 材料与方法
1.1 材料
试验于2018年10月至2019年1月在海南大学海甸校区农学基地塑料大棚内进行。试验材料为海南槟榔本地品种,选取2叶1心、生长健壮且均匀一致的槟榔幼苗。
1.2 方法
1.2.1 试验设计 设定5个水分梯度(各梯度含水量均为田间持水量的百分数):T1:(30±5)%、T2:(45±5)%、T3:(60±5)%、T4:(75±5)%、T5:(90±5)%,土壤田间持水量为37.44%。每个处理设置3个重复,共30株苗。移栽后,待槟榔幼苗适应生长15 d后进行统一控水,控水方式采用水分速测仪(TPY-6A)耦合称重法进行,1天浇1次水。通常槟榔幼苗在正常生长情况下,15~20 d后长出第一片新叶。因此,自控水那天起,分别于控水后15、30、45、60 d取样测定。
1.2.2 指标测定 (1)形态指标测定。每个处理挑选3株具有代表性的植株,用游标卡尺和卷尺测其株高、茎粗、叶长、裂叶长,用YMJ-D手持叶面积仪测定叶面积(统一以每株的第2片叶为准)。
(2)组织含水量测定。每个处理随机选取3株测定根、茎、叶的鲜重,然后将植株样品放置于75 ℃烘干至恒重,称取干重,计算各组织中含水量以及根冠比(因前期差异较小)。
(3)光合指标测定。采用Li-6400便携式光合测定仪进行测定。光合仪测定时利用LED光源控制光合有效辐射强度[PAR,?mol/(m2·s)]在1500、1200、1000、750、500、300、150、100、60、20、0 ?mol/(m2·s)光合仪自动记录净光合速率[Pn,?mol/(m2·s)]、蒸腾速率[Tr,mmol/(m2·s)]等光合数据,叶温控制在20~27 ℃,相对湿度70%左右,CO2浓度428 mol/?mol。同样,在处理后60 d,选择天气晴朗的上午8:00—11:00进行测定,每组处理测定3个植株。
(4)生理指标测定。叶绿素测定和根系活力测定。每个处理随机选取3株,统一取每株完全展开的第2片叶,采用95%的乙醇浸提法进行叶绿素测定,根系活力的测定方法采用TTC法进行测定。
(5)数据处理。采用Excel 2010和SPSS 20.0进行数据分析及处理,采用Duncans新复极差法进行多重比较。
2 結果与分析
2.1 不同土壤水分下槟榔幼苗的生长情况
选取处理60 d后的槟榔幼苗测定幼苗的生长情况。从表1可见,不同水分处理对槟榔幼苗生长影响显著,随着土壤水分的增加,幼苗的株高呈现出增大的趋势,而幼苗的茎粗没有显著增加的趋势。其中,T4处理和T5处理下的株高明显高于其他处理;槟榔幼苗的茎粗、叶面积和叶长均在T3处理下最高;裂叶长在T5处理下达到最大值,为18.967 cm。槟榔幼苗的根冠比在T1处理下有显著差异,比T5处理高16.8%。
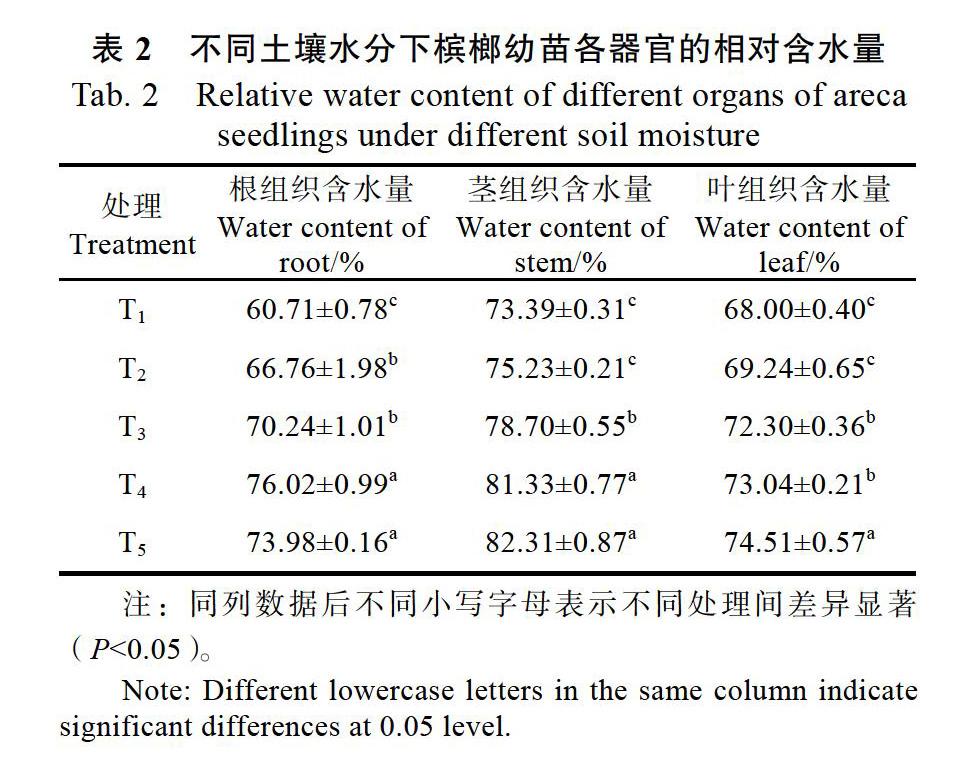
2.2 不同土壤水分下槟榔幼苗各器官的相对含水量
同样选取处理60 d后槟榔幼苗测定各组织含水量。从表2可以看出,茎组织含水量和叶组织含水量随着土壤相对含水量的增加而增加;根组织含水量在T4处理下达最大值76.02%,比T1处理提高了20.1%。茎组织含水量与叶组织含水量以T5处理最佳,其中茎组织含水量比T1处理提高了10.8%,叶组织含水量比T1处理提高了8.7%。
2.3 不同土壤水分下槟榔幼苗的生理特性
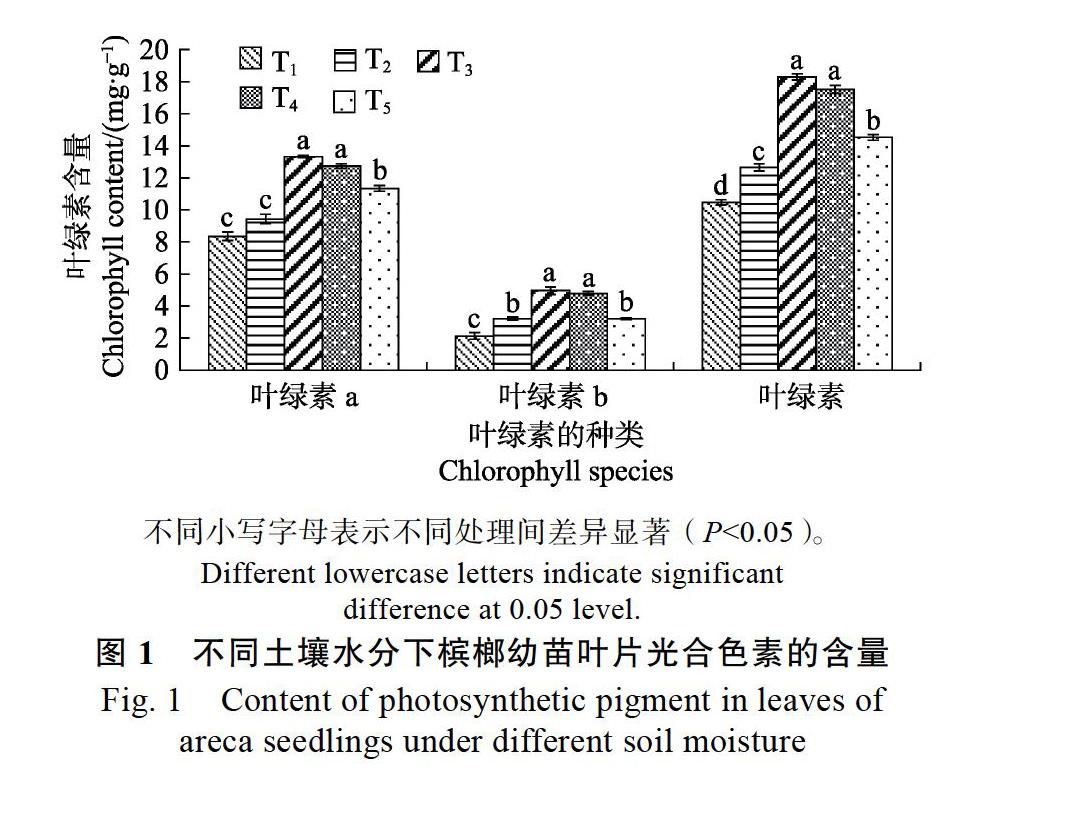
2.3.1 不同土壤水分下槟榔幼苗叶片光合色素的含量 选取处理60 d后的槟榔幼苗测定叶绿素含量变化,该时期叶绿素含量差异显著。从不同土壤水分含量下槟榔幼苗叶片的叶绿素、叶绿素a、叶绿素b的含量变化可以看出,槟榔幼苗叶片的各类叶绿素含量随着土壤水分含量的上升呈现先升高后下降的趋势(图1)。T1处理、T2处理下的各类叶绿素含量相对较低,在T3处理和T4处理下,各类叶绿素的含量显著高于其他处理组,而T3处理下的叶绿素、叶绿素a和叶绿素b又略高于T4处理。当土壤相对含水量超过80%时,各类叶绿素的含量又逐渐减小。
2.3.2 不同土壤水分条件下槟榔幼苗叶片光合作用的光响应 选取处理60 d后的槟榔幼苗测定槟榔幼苗的光响应曲线。从不同土壤相对含水量下的光响应曲线(图2)可以看出,槟榔叶片的Pn呈现出先缓慢上升后下降,再迅速上升的趋势(图2A)。Pn的光响应与光合有效辐射(PAR)和土壤相对含水量同时有关,从图2可以看出,T3随着PAR的上升变化显著,T3处理下Pn明显高于其他处理组,净光合速率大于其他土壤相对含水量下的净光合速率。处于T1处理、T2处理下,Pn明显低于其他处理,光合有效辐射<1200 ?mol/ (m2·s)时,Pn均小于1。Tr随着PAR的增大表现出曲折上升的趋势,T3处理下即土壤相对含水量为55%~65%时,Tr最大(图2B)。随着PAR的增强,槟榔幼苗叶片的水分利用率变化没有明显的规律性,从图中可以看出,T1处理下的WUE明显高于其他处理组(图2C)。
2.3.3 不同土壤水分下槟榔幼苗的根系活力 水分处理15 d时,根系活性差异不显著,随着控水时间的延长,T1、T2处理下根系活力呈逐渐下降趋势;T4和T5处理下的根系活力随处理时间增加而增加,T3处理在45 d后根系活力降低,可能是由于浇水时根系被冲刷裸露出地表而导致根活力的降低。在T5处理下,即土壤相对含水量达到85%~95%时,根系活力下降。
3 讨论
土壤水分对植物的影响主要是通过影响植物的形态、数量和持续的时间来完成,水分过多或过少都会抑制植物的生长[19-20]。因前期取样测定结果无明显差异,所以统一选取处理60 d后的槟榔幼苗,对形态指标、各组织含水量的变化、叶绿素含量进行分析和说明。在本研究中,T1处理下的各形态指标与其他处理相比相对较小,同时,各组织含水量最少,研究结果与前人一致[21]。植物在受到水分限制时,通过调节其形态(高度、叶长、叶宽等)和生物量的分配来适应逆境。增加根冠比是植株缓解干旱的一种方式,干旱发生后植物将生长重心转移到根部,通过增加从土壤吸收的水分和养分来供给自身生长,从而达到缓解植株地上和地下部需水的矛盾[22-23]。当土壤含水量在(90±5)%时,槟榔幼苗的叶长差异不显著,而裂叶长显著高于其他处理,可能是因为土壤水分过多,造成裂叶徒长,叶片窄而细[24]。
当土壤相对含水量较少时,会影响叶绿素的生物合成,促进已合成的叶绿素分解,使其含量降低,这是由于在干旱条件下,植物体内产生的多种活性氧使光合色素分解所致,同时使槟榔的叶片黄化[25-26]。在本研究中,T1、T2干旱处理下叶绿素含量最少,土壤相对含水量在25%~65%的范围内,叶绿素a和叶绿素b的含量不断增加,当土壤相对含水量为55%~65%时,各叶绿素含量达最大值,研究结果与前人一致[27]。
光合作用是植物生长和产量形成的生理基础,其影响因子源自多方面,水分作为植物生长的限制性因子,对植物光合作用的影响最大[28]。植物的光合作用通常以净光合速率、蒸腾速率、气孔导度、胞间CO2浓度及水分利用效率等指标来反映,其中净光合速率和蒸腾速率对于水分亏缺的敏感程度是决定植物水分利用效率的关键[29]。在本研究中,槟榔幼苗的Pn表现为先升高后降低,说明槟榔对水分十分敏感,过低的土壤相对含水量会使槟榔叶片光合作用变得微弱,当土壤相对含水量在55%~65%时,槟榔的净光合速率和蒸腾速率显著高于其他处理,这与前人的研究结果一致[30]。土壤中的相对含水量越少,槟榔叶片的Pn和Tr越小,这与陈歆等[17]与许大全[31]的试验结果一致。研究表明,植物的水分利用率(WUE)也是植物抗逆能力的重要表现,植物可通过协调碳同化速率和蒸腾速率的关系,调节WUE的变化,保持植物生长与耗水的平衡[32-33]。在本研究中,当土壤相对含水量为25%~35%时,WUE最大,叶片对土壤水分的利用效率最高,槟榔叶片通过减少蒸腾作用来提高水分利用率,在银杏[34]、地枫皮[35]上也有同样的现象。
土壤水分是影响根系生长的重要因子,植物的根系可随着外界环境条件的变化进行自我调节[36]。在本研究中,T3和T4处理下根系活力最大,这与李洪立等[37]得出的土壤相对含水量为70%左右时最有利于根系生长的结论一致。杨苹等[38]在研究土壤水分调控对烤烟根系的影响中发现,在土壤缺水时,根尖生长受阻,根系分枝增多。当土壤水分亏缺严重时,粗根增多,根系活力降低,因此对土壤水分粗放管理不利于槟榔根系的生长[39-40]。
综上所述,土壤相对含水量低使槟榔幼苗生长矮小,叶面积减小,叶绿素含量降低,叶片黄化且光合速率下降,根系活力减弱。当土壤中的相对含水量为55%~65%时,槟榔的光合速率高,并且有利于槟榔生长。在本研究中发现,不同土壤相对含水量对槟榔幼苗根系的形态特征有较大影响。因此,在今后的研究中还需深入探讨水分对槟榔幼苗根系的根长、根粗、根系数量以及生理特性的影响,发现适宜槟榔根系生长的土壤相对含水量,为槟榔栽培与管理提供参考。
参考文献
[1] 潘瑞炽. 植物生理学[M]. 7版. 北京: 高等教育出版社, 2012.
[2] Su P X, Liu X M, Zhang L X,et al. Comparison of d13C values and gas exchange of assimilating shoots of desert plantsHaloxylon ammodendronandCalligonum mongolicumwith other plants[J]. Israel Journal of Plant Sciences, 2013, 52(2): 87-97.
[3] Bodegom P M V, Sorrell B K, Oosthoek A,et al.Separating the effects of partial submergence and soil oxygen demand on plant physiology[J]. Ecology, 2008, 89(1): 193-204.
[4] 何凌仙子, 賈志清, 刘 涛, 等. 植物适应逆境胁迫研究进展[J]. 世界林业研究, 2018, 31(2): 13-18.
[5] 赵雅静, 翁伯琦, 王义祥, 等. 植物对干旱胁迫的生理生态响应及其研究进展[J]. 福建稻麦科技, 2009, 27(2): 45-50.
[6] 于文颖, 纪瑞鹏, 冯 锐, 等. 不同生育期玉米叶片光合特性及水分利用效率对水分胁迫的响应[J]. 生态学报, 2015, 35(9): 2902-2909.
[7] 韩 刚, 赵 忠. 不同土壤水分下4种沙生灌木的光合光响应特性[J]. 生态学报, 2010, 30(15): 4019-4026.
[8] 陈 建, 张光灿, 张淑勇, 等. 辽东楤木光合和蒸腾作用对光照和土壤水分的响应过程[J]. 应用生态学报, 2008(6): 1185-1190.
[9] Blum U, Gerig T M. Relationships between phenolic acid concentrations, transpiration, water utilization, leaf area expansionand uptake of phenolic acids: nutrient culture studies[J]. Journal of Chemical Ecology, 2005, 31(8): 1907-1932.
[10] Guo Q Q, Zhang W H, Li H E. Comparison of photosynthesis and antioxidative protection inSophora moorcroftianaandCaragana maximoviczianaunder water stress[J]. Journal of Arid Land, 2014, 6(5): 637-645.
[11] Peng W, Liu Y J, Wu N,et al.Areca catechuL. (Arecaceae): A review of its traditional uses, botany, phytochemistry, pharmacology and toxicology[J]. Journal of Ethnopharma?????????c?ology, 2015, 164: 340-356.
[12] Yang Y H, Lien Y C, Ho P S,et al.The effects of chewing areca/betel quid with and without cigarette smoking on oral submucous fibrosis and oral mucosal lesions[J]. Oral Di?seases, 2005, 11(2): 88-94.
[13] Hung S L, Chen Y L, Wan H C,et al.Effects of areca nut extracts on the functions of human neutrophilsin vitro[J]. Journal of Periodontal Research, 2000, 35(4): 186-193.
[14] 任军方, 王文泉, 唐龙祥. 槟榔的研究概况[J]. 中国农学通报, 2010, 26(19): 397-400.
[15] 何振革. 海南省槟榔产业发展存在问题及对策[J]. 安徽农学通报, 2007(13): 109-110.
[16] 陳思婷, 孙程旭, 曹红星, 等. 干旱胁迫对槟榔幼苗生理生化特性的影响[J]. 江西农业学报, 2009, 21(10): 70-72.
[17] 陈 歆, 杨福孙, 周兆德, 等. 土壤水分胁迫对槟榔幼苗光合特性的影响[J]. 热带农业科学, 2010, 30(2): 8-12.
[18] 王汀忠, 杨安富, 唐树梅. 海南槟榔平衡施肥的现状与发展前景[J]. 广西热带农业, 2007(4): 30-32.
[19] 杨金凤, 郭巧生, 朱再标, 等. 不同水分梯度下垂盆草生长发育、品质及抗氧化活性关系研究[J].中草药, 2018, 49(14): 3382-3388.
[20] 杨建伟, 梁宗锁, 韩蕊莲, 等. 不同干旱土壤条件下杨树的耗水规律及水分利用效率研究[J]. 植物生态学报, 2004(5): 630-636.
[21] Catoni R, Gratani L, Bracco F,et al.How water supply du?ring leaf development drives water stress response inCorylus avellanasaplings[J]. Scientia Horticulturae, 2017, 214: 122-132.
[22] Zandalinas S I, Mittler R, Balfagón D,et al. Plant adaptations to the combination of drought and high temperatures[J]. Physiologia Plantarum, 2018, 162(1): 2-12.
[23] 馬 剑, 刘贤德, 孟好军, 等. 水分胁迫对文冠果幼苗生长及生理特性的影响[J]. 干旱区资源与环境, 2018, 32(1): 128-132.
[24] 杨春艳. 设施蔬菜的徒长及其防治[J]. 中国蔬菜, 2013(3): 59-60.
[25] 吴飞燕. 不同环境胁迫对3种植物叶绿素荧光参数的影响[D]. 杭州: 浙江农林大学, 2011.
[26] 李志军, 罗青红, 伍维模, 等. 干旱胁迫对胡杨和灰叶胡杨光合作用及叶绿素荧光特性的影响[J]. 干旱区研究, 2009, 26(1): 45-52.
[27] 童方平, 方 伟, 马履一, 等. 水分胁迫下湿地松优良半同胞家系光合色素的响应[J]. 中国农学通报, 2006(11): 97-102.
[28] 曾群英, 刘素青, 李林峰, 等. 真红树植物的净光合速率与其相关生理生态因子的关系[J]. 西北林学院学报, 2015, 30(3): 28-34.
[29] 冯晓东, 路苗苗, 常海飞, 等. 不同土壤相对含水量对梨枣蒸腾速率的影响[J]. 延安大学学报(自然科学版), 2017, 36(2): 89-92, 97.
[30] 刘亚丽, 王庆成, 杨远彪, 等. 水分胁迫对脂松幼苗生长和光合特性的影响[J]. 东北林业大学学报, 2011, 39(4): 33-36.
[31] 许大全. 光合作用的光抑制[J]. 植物生理学报, 1997, 33(6): 467.
[32] 刘吉利, 赵长星, 吴 娜, 等. 苗期干旱及复水对花生光合特性及水分利用效率的影响[J].中国农业科学, 2011, 44(3): 469-476.
[33] 张淑勇, 夏江宝, 张光灿, 等. 黄刺玫叶片光合生理参数的土壤水分阈值响应及其生产力分级[J]. 生态学报, 2014, 34(10): 2519-2528.
[34] 刘晓静, 刘佩迎, 张 谦, 等. 土壤干旱胁迫对银杏幼苗光合特性的影响[J]. 山东农业大学学报(自然科学版), 2018, 49(3): 467-472.
[35] 王满莲, 唐 辉, 韩 愈, 等. 水分胁迫与复水对地枫皮生理生态特性的影响[J]. 广西植物, 2017, 37(6): 716-722.
[36] 杨再强, 邱译萱, 刘朝霞, 等. 土壤水分胁迫对设施番茄根系及地上部生长的影响[J]. 生态学报, 2016, 36(3): 748-757.
[37] 李洪立, 李 琼, 杨福孙, 等. 水分胁迫对槟榔幼苗根系形态与活力的影响[J]. 热带作物学报, 2011, 32(11): 2016-2019.
[38] 杨 苹, 程智敏, 陈叙生, 等. 土壤水分调控对烤烟根系、植株形态及生理特性的影响[J]. 贵州农业科学, 2017, 45(9): 21-23.
[39] Sharma B R,Chaudhary T N. Wheat root growth, grain yield and water uptake as influenced by soil water regime and depth of nitrogen placement in a loamy sand soil[J]. Agricultural Water Management, 1983, 6(4): 365-373.
[40] Barraclough P B, Kuhlmann H, Weir A H. The effects of prolonged drought and nitrogen fertilizer on root and shoot growth and water uptake by winter wheat[J]. Journal of Agronomy and Crop Science, 1989, 163(5): 352-360.

