不同调控元件及组合对烟草外源蛋白瞬时表达的效果分析
刘文浩 王瑞丰 刘琬琳 许杰
(上海交通大学生命科学技术学院,上海 200240)
瞬时表达系统是一种快速将目标基因转入靶细胞、且高效表达蛋白的系统[1]。相对于稳定表达系统,瞬时表达无需将外源基因整合到基因组上,消除了外源基因整合过程中位置效应的影响,具有表达周期短,表达量高等优势[2]。因此,瞬时表达系统被广泛应用于分子生物学研究中,包括启动子功能分析、转录因子对下游基因调控分析及蛋白质间互作研究等[3]。但该系统蛋白表达量的稳定性受到多种因素(载体自身组件构成和转化条件)的影响,如何更加高效和稳定的提高瞬时表达系统外源蛋白的表达量,是该系统进一步优化和扩大使用的前提和基础。
植物瞬时表达导入目标外源基因的方法主要包括:基因枪法、农杆菌渗透法、聚乙二醇(PEG)法、电击法及植物病毒载体介导的方法[1]。其中,农杆菌渗透法因其操作简单,转化效率高且比较稳定等特点,是目前最常使用的平台系统[4]。其外源蛋白表达量的提高可以从以下两个方面改进:其一是表达载体自身组件构成的优化,包括表达载体中的作用元件和表达载体骨架等;其二是转化条件的优化,包括菌株、菌液浓度及转化时间等[5],最终目的是希望外源蛋白在该瞬时转化系统中能够快速、高效地表达,从而进一步用于后期功能分析。
目前瞬时转化系统中表达载体自身组件的优化方面,主要集中在启动子、终止子、非编码区、转录后沉默抑制因子等这些主要作用元件上。启动子是转录调控的关键元件,组成型启动子可以调控基因在植物任何组织器官中持续表达[6],而组织特异型启动子引导外源基因在植物特定组织或器官表达,并且大部分组织特异型启动子在植物特定位置驱动外源基因表达的能力高于组成型启动子[7]。表达载体中的5'非编码区(5'UTR)能与宿主细胞竞争转录起始因子和核糖体,还可以减少mRNA降解和转录后基因沉默,避免与有害蛋白或抑制性RNA二级结构相互作用,延长mRNA半衰期,从转录和翻译水平提高转基因产物表达[8]。终止子在提高外源基因表达方面同样发挥重要作用,正确的转录终止和多聚腺苷化能提高mRNA跨核运输效率、维持mRNA稳定性、提高蛋白翻译效率,并能减少基因沉默[9]。Rosenthal等[9]发现表达载体中插入去掉内含子的Extensin终止子(Ext)相较于NOS终止子在烟草叶片和生菜叶片中均能显著提高外源基因表达。此外,Beyene等[10]发现相比单个终止子,将不同终止子串联可以使基因表达达到更高水平。基质附着区(Matrix attachment regions,MAR)序列是一段与核基质特异结合的DNA序列,能使目的基因定位于核基质上而与周围染色质分开,减少基因沉默[11]。Diamos等[12]发现基质附着区Rb7通过动态结合核基质调控临近基因表达,在表达载体终止子后插入基质附着区Rb7使得报告基因GFP表达增强。转录后基因沉默是重组蛋白表达低的原因之一,添加RNA沉默抑制因子能减少外源基因转录后基因沉默从而提高重组蛋白表达[13]。来自葡萄卷叶相关病毒2(GRLaV2)的p24蛋白被鉴定为一种强沉默抑制因子,能阻止植物中双链反向重复序列诱导沉默[14]。目前关于表达载体中影响外源基因表达的单个元件研究较多,而多个作用元件组合效应如何影响外源基因表达的研究却很少。
农杆菌侵染和转化过程中,多种因素可以影响农杆菌介导的重组载体转化效率,从而影响外源基因的瞬时表达[15],例如,Diamos等[12]比较农杆菌菌株GV3101、EHA105和LBA4301发现,EHA105介导的转化可获得更高的蛋白表达。李晓君等[16]研究pCambia1304载体侵染的最佳注射液浓度OD600在0.3-0.7时均有较高的转化效率,而孙春莲等[17]发现pCB302载体的最佳注射液浓度OD600在0.8-1.0之间。因此,不同转化菌株的选择、不同菌液注射液浓度的选择,也是提高瞬时转化中外源蛋白表达的一些重要因素。
因此,本研究在前人研究的基础上,筛选和获得有效提高外源基因表达的6个作用元件(包括烟草叶片特异型启动子rbcS、AtPsaK基因上游63 bp的5'UTR、终止子Ext、CaMV35S 3'UTR、基质附着区Rb7和RNA沉默抑制因子p24),在植物双元表达载体pCambia1300骨架基础上,来分析不同元件的添加及相互组合,是否可以在转录和翻译水平有效的提高外源蛋白(eGFP为报告基因)在瞬时表达系统的表达量;并进一步结合最佳注射液浓度的探索,以期构建新的可以快速高效的表达外源基因的植物瞬时表达体系,从而进一步拓宽瞬时表达体系在基因功能探究和重组蛋白表达方面应用,以及为研究载体中能够有效提高外源基因表达的元件功能及其组合效应提供科学依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 本氏烟草(Nicotianabenthamiana)、拟南芥(Columbia 0,哥伦比亚生态型)。
1.1.2 菌株和质粒 农杆菌(Agrobacterium tumefaciens)菌株:EHA105;大肠杆菌(Escherichia coli)菌 株 DH5α。pCambia1300、pCambia1301、pGreen-0000、pGreen0801、pEHQ-HT载体均为本实验室保存。pEff载体购自Addgene。
1.1.3 试剂和引物 限制性内切酶和Gflex高保真酶均购自NEB有限公司;CE重组酶和RNA提取试剂盒购自诺唯赞公司;RNA反转录试剂盒、质粒小提试剂盒、胶回收试剂盒均购自天根公司;luciferin和鼠源GFP抗体购自Sigma公司;SDS-PAGE凝胶试剂盒购自雅酶公司。引物合成及测序分别由英潍捷基和上海派森诺公司完成,所用引物序列见表1。

表1 引物序列及信息
1.1.4 仪器 96孔PCR仪(Thermo Fisher);定量PCR仪(Roche);凝胶成像仪(Bio-Rad);激光共聚焦显微镜(Leica);Tanon-5200化学发光成像仪(Tanon)。
1.2 方法
1.2.1 调控元件的筛选和克隆 根据已报道的烟草叶片组织特异型核酮糖1,5-二磷酸加氧酶/羧化酶启动子(rbcS启动子)基因序列[18],拟南芥 AtPsaK上 游 63 bp 5' UTR序列[19]以及质粒pCambia1301中CaMV35S序列,采用NCBI Primer设计重叠PCR引物(表1)。用CTAB法提取烟草基因组DNA,并以基因组和质粒pCambia1301-eGFP为模板克隆获得rbcS启动子和CaMV35S启动子,并合成AtPsaK 5' UTR,后以克隆产物为模板通过重叠PCR获得PrbcS-35S-UTR融合片段。根据已报道的烟草细胞壁延伸因子Ext 3' UTR[9],基质附着区Rb7[20]和 CaMV35S 3' UTR[21]序列,分别以烟草基因组,质粒pEHQ-HT为模板,通过表1引物分别克隆获得Ext 3' UTR,CaMV35S 3' UTR和Rb7,并通过重叠PCR分别获得Ext-35S 3' UTR(EU)和Ext-35S 3' UTR-Rb7(EUR)。参照 Mardanova等[13]的方法,以pEff载体为模板,采用NCBI Primer设计引物p24-Fw/p24-Rv,PCR扩增获得35S-p24-NOS片段。取5 μL PCR扩增产物进行凝胶电泳,对大小正确的基因片段用DNA凝胶回收试剂盒进行回收。
1.2.2 重组载体构建与鉴定 首先将获得的EU和EUR连入酶切好的pCambia1300载体,获得pEU和pEUR中间载体。然后用EcoRI和SpeI酶切载体,通过CE重组酶将PrbcS-35S-UTR连入载体获得pREU和pREUR载体。在pREUR载体基础上,将从pEff载体上克隆的35S-p24-NOS连入,获得pREUR-p24载体。以pCambia1301载体为模板,克隆eGFP标签并通过CE重组酶连入pGreen0000载体,以此为模板设计引物克隆获得eGFP标签和FLAG标签(eGFP-2×FLAG)。然后将eGFP-2×FLAG连入中间载体,转化大肠杆菌DH5α感受态细胞,提取质粒进行酶切鉴定,并将阳性重组质粒送至上海派森诺生物技术有限公司进行测序。构建成功的重组表达载体命名为pREU-EF、pREUR-EF和pREUR-p24-EF。
1.2.3 烟草叶片转化[22]将 pCambia1301-eGFP、pREU-EF、pREUR-EF和pREUR-p24-EF重组质粒通过冻融法转化农杆菌EHA105感受态细胞,28℃暗培养3 d后,挑取单克隆,在含有卡那霉素和利福平的YEB培养基中过夜培养至菌液OD600达0.8时收集菌体,用含有10 mmol/L MgCl2、10 mmol/L MES和200 μmol/L乙酰丁香酮的缓冲液重悬菌体,稀释至OD600值为0.3,室温静置3 h后,用去掉针头的注射器注射4周大的烟草叶片。分别稀释至OD600值为0.2、0.3、0.4、0.5,注射烟草叶片。
1.2.4 重组蛋白提取及SDS-PAGE电泳 比较农杆菌侵染烟草叶片48 h后,取注射部位的叶片进行荧光观察。收集侵染后48 h的烟草叶片,以液氮处理后于研钵中研磨成粉,取样品100 mg,加入1 mL蛋白提取液(25 mmol/L磷酸钠缓冲液pH7.4,100 mmol/L NaCl,1 mmol/L EDTA,0.1% TritonX-100,10 mg/mL抗坏血酸钠,0.3 mg/mL PMSF),颠倒裂解30 min后,12 000×g离心10 min,取上清提取总蛋白粗提液。使用雅酶SDS-PAGE凝胶试剂盒配制10%凝胶,将蛋白粗提液与5×SDS loading按4∶1比例混合沸水煮10 min后,12 000×g离心3 min,取10 μL上清进行SDS-PAGE凝胶电泳,并取1 μL上清用5×SDS loading稀释至10 μL后进行SDS-PAGE凝胶电泳,然后进行Western-blot分析,使用鼠源GFP抗体进行检测。以rbcS小亚基为内参,使用Image J软件对SDS-PAGE凝胶GFP目的条带进行灰度值分析。
1.2.5 烟草叶片RNA提取与定量PCR分析 取100 mg研磨后的样品,加入1 mL Trizol室温裂解5 min,后加入200 μL氯仿充分混匀,室温静置3 min后,4℃ 12 000 r/min离心10 min,吸取400 μL上清至1.5 mL离心管中,加入200 μL无水乙醇,吹打混匀后将混合液转移至吸附柱中,后续操作参照诺唯赞植物总RNA提取试剂盒说明书进行。使用天根反转录试剂盒对获得的RNA进行反转录获得cDNA,稀释至100 ng/μL,以此为模板进行定量PCR实验。定量PCR使用编码GFP基因上的特异引物(qeGFPFw/qeGFP-Rv),内参基因选用延伸因子1a(EF1a),其扩增引物为EF-Fw和EF-Rv,每个样品进行3次生物学重复实验。
1.2.6 双荧光素酶报告系统检测实验[23]将构建的重组质粒pREUR-eGFP-MYB80和proUNDEAD-Luc转化农杆菌EHA105,28℃暗培养3 d后,挑取单克隆,过夜培养至菌液OD600达0.8时收集菌体,用重悬缓冲液重悬菌体稀释至OD600值为1。转录因子和启动子按4∶1比例混合,室温静置3 min后注射烟草叶片。弱光培养36 h后取烟草叶片,在叶片上加100 mmol/L的luciferin,涂布均匀后放置5 min,于Tanon-5200化学发光成像仪下检测信号。
2 结果
2.1 瞬时表达载体元件克隆与构建
本研究设计主要从启动子、5' UTR、终止子、基质附着区和RNA沉默抑制因子五个方面筛选和添加作用元件(图1-A)。首先通过PCR克隆获得了烟草叶片组织特异型启动子rbcS,组成型启动子CaMV35S,高效终止子元件Ext和CaMV35S 3'UTR,以及能增强外源基因表达的基质附着区Rb7和减少转录后基因沉默的RNA沉默抑制因子p24(图1-B)。然后对各个载体元件按照图1-A进行了组装,分别获得pREU-EF、pREUR-EF和pREUR-p24-EF载体。用目的片段上特有的SacI酶切位点和载体上的SpeI酶切位点双酶切重组质粒,出现2个与预期值相符的DNA片段(大小约为10 kb和750 bp),证明重组载体构建成功(图1-C)。
2.2 重组表达载体活性分析
根据1.2.3实验方法分别将pREU-EF、pREUREF和pREUR-p24-EF 3个重组表达载体转化烟草叶片,48 h后,利用激光共聚焦显微镜分析烟草叶片中报告基因GFP的表达情况。结果(图2)表明,在细胞质、细胞核、细胞膜中均能观察到GFP的表达,初步说明构建的3个瞬时表达载体都能在烟草叶片中稳定工作。
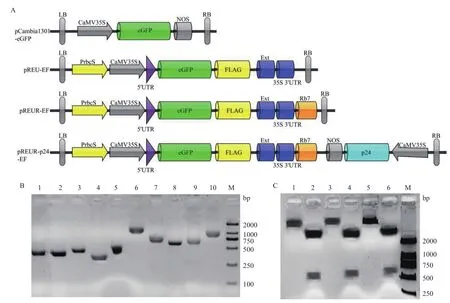
图1 重组表达载体构建及验证

图2 重组表达载体侵染后烟草叶片中GFP表达分析
2.3 作用元件组合与目标蛋白表达相关性分析
为探究不同作用元件组合对外源蛋白表达的影响,对侵染48 h后的烟草叶片中报告基因表达进行分析。qRT-PCR结果(图3-A)显示,在转录水平上PrbcS-35S-UTR和EUR-p24元件组合相比pCambia1301载体中CaMV35S启动子和NOS终止子组合使GFP表达提高28倍,相比PrbcS-35S-UTR和EU与EUR元件组合分别提高7倍和1.4倍,说明增加的作用元件能在转录水平上显著提高报告基因表达,并且在终止子后插入基质附着区Rb7和RNA沉默抑制因子均能提高GFP的转录能力。
SDS-PAGE凝胶Image J灰度值分析结果表明,在蛋白水平上pREUR-EF和pREUR-p24-EF相比pREU-EF增强2倍和1.7倍(图3-B-3-D),说明终止子后Rb7的插入能增强蛋白表达能力,但再增加p24后GFP表达并没有显著性变化(图3-D)。
2.4 菌液注射液浓度对GFP瞬时表达效率的影响
为分析菌液注射浓度对重组载体中外源蛋白表达的影响,对注射不同菌液浓度(载体pREUR-EF,菌液浓度:0.2-0.5,转化48 h)的烟草叶片中报告基因的表达进行了检测分析。定量PCR结果表明,转录水平上报告基因GFP的表达量随着注射液浓度升高而逐渐增强(图4-A)。
SDS-PAGE凝胶Image J灰度值结果(图4-B-4-D)分析显示,OD600为0.4时,报告基因的蛋白水平信号相对最强。结果说明,菌液注射液浓度也是影响外源蛋白表达的重要因素。
2.5 重组表达载体在基因转录调控研究中的应用
为验证改造的瞬时表达系统是否可以用于转录调控Dual-Luciferase分析,将拟南芥花药特异表达的转录因子AtMYB80和AMS(ABORTED MICROSPORES)分别连入pREUR-EF载体,来验证AtMYB80对其下游基因天冬氨酸蛋白酶UNDEAD转录调控关系。Effector和Reporter载体构建示意如图5-A所示。农杆菌侵染烟草叶片36 h后,可在细胞核中观察到AtMYB80的表达(图5-B)。Tanon-5200化学发光成像仪信号检测结果显示,只有Effector时只有本底信号,加入pREUR-eGFP-MYB80后引起Luc信号增强,但是加入AMS转录因子并不能使信号增强(图5-C),这个结果与此前报道利用染色质免疫共沉淀技术在植物体内研究结果一致,说明构建的表达体系可用于Dual-Luciferase系统的转录调控分析。
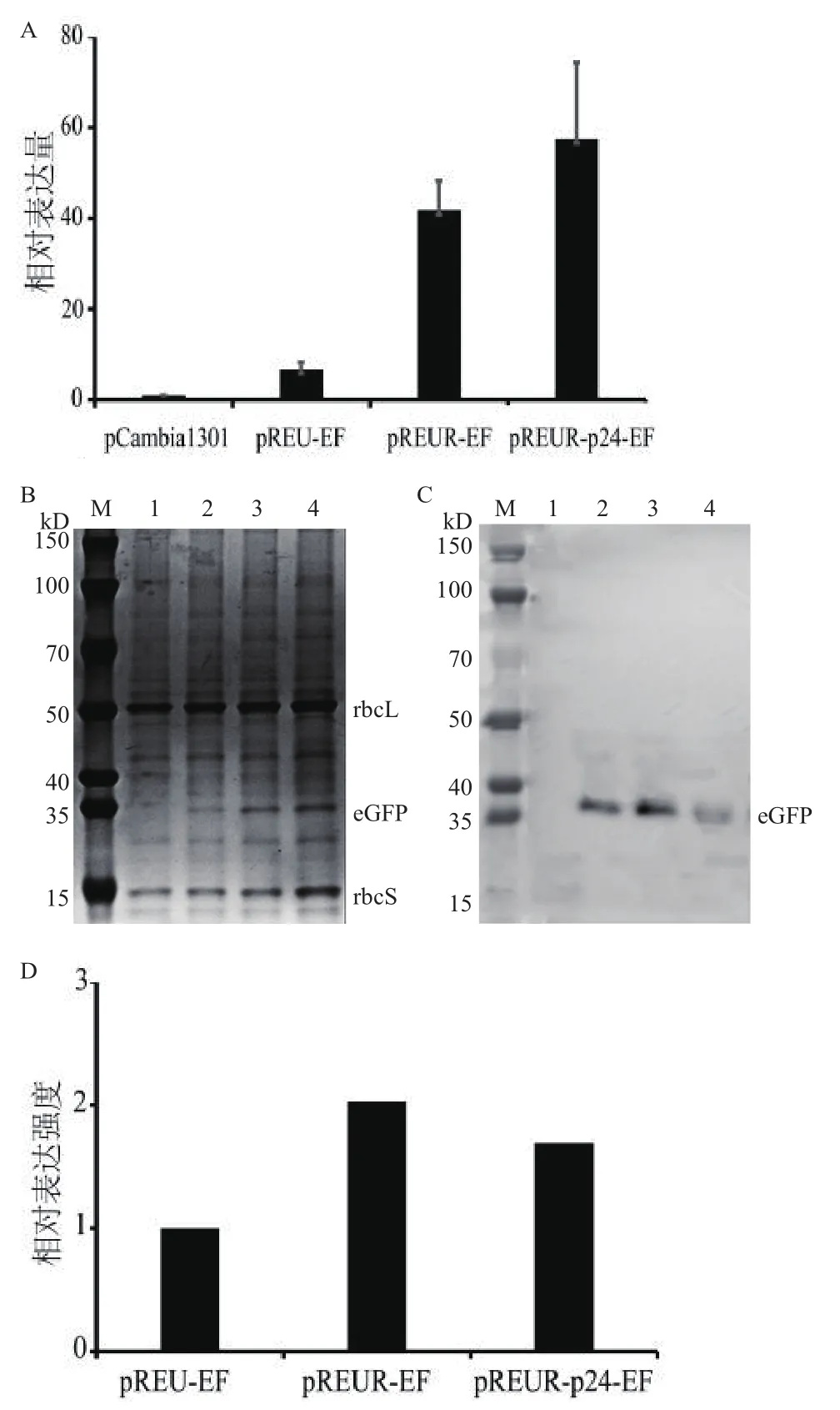
图3 对比分析不同元件对报告基因GFP表达的影响

图4 对比分析不同注射液浓度对pREUR-EF载体中报告基因GFP表达的影响
3 讨论

图5 转录因子MYB80对UNDEAD的调控分析
植物瞬时表达系统具有广泛应用,既可以用于快速研究基因功能,也可以用于获取重组蛋白。已有研究表明,目的蛋白性质、宿主、表达载体系统、密码子偏好性、转化条件等因素都会影响外源蛋白表达[4]。表达载体系统中各作用元件的优化一直是进一步提高外源蛋白的研究热点。在本研究中,我们挖掘和比较文献中不同作用元件对外源蛋白表达影响,筛选和克隆获得可以用于表达载体改造的6个相关作用元件(包括烟草叶片特异型启动子rbcS、AtPsaK基因上游63 bp的5' UTR、终止子Ext、CaMV 35S 3' UTR、基质附着区Rb7和RNA沉默抑制因子p24)。其中,烟草叶片特异型启动子rbcS和组成型启动子CaMV35S及基质附着区Rb7主要从转录水平提高外源基因表达,克隆自光系统小亚基K的5' UTR及细胞壁Extensin和烟草花叶病毒35S的3'UTR既能影响外源基因mRNA的转录和稳定性,也能影响外源基因的翻译效率。沉默抑制因子p24主要通过减少RNA沉默从转录后水平提高外源基因表达[13]。因此,我们组装的瞬时表达载体可以从多个层次改善外源基因的表达,这为表达载体的改良提供了新的思路。
启动子是影响外源基因表达的关键作用元件,孙家利等[18]发现烟草叶片特异型启动子rbcS驱动外源基因表达能力强于组成型启动子CaMV35S。表达载体中5' UTR被用作翻译增强子[8],像苜蓿花叶病毒(AMV)的5' UTR[24],烟草花叶病毒的Ω序列等[25],Diamos等[8]发现将来源拟南芥基因组AtPsaK 5' UTR插入CaMV35S启动子后能增强GFP翻译效率。双终止子串联能在瞬时表达系统中有效提高基因表达[21],Beyene等[10]发现将CaMV35S和NOS终止子串联使用能显著提高基因表达,Yamamoto等[21]也发现将Ext终止子和HSP终止子串联使用可以获得更多的GFP蛋白。在本研究中,通过转录水平(qRT-PCR)和蛋白水平(SDS-PAGE)分析表明,我们发现相比于常用的以CaMV35S启动子驱动,以NOS为终止子的载体,采用组织特异型rbcS启动子和CaMV 35S组成型启动子及AtPsaK 5'UTR串联驱动,辅以Ext和35S 3' UTR作为终止子元件的载体能显著提高外源基因的转录。已有研究表明,基质附着区能减少转基因沉默[26],Ji等[27]发现TM6能减少临近基因启动子区的甲基化从而提高烟草中重组蛋白表达。我们的定量结果表明,在双终止子之后插入基质附着区Rb7后,GFP转录显著增强,蛋白表达提高。转录后基因沉默是影响外源蛋白积累的常见因素,Mardanova等[13]研究发现,将RNA沉默抑制因子p24插入pEff载体后,相对不添加p24的载体,GFP表达提高3倍。我们的结果表明,p24插入载体后,GFP在转录水平上提高1.4倍,但是蛋白水平上GFP表达没有显著性差异,我们认为这可能与我们取材时间较早有关,随着体内表达时间的延长,含有RNA沉默抑制因子的pREUR-p24-EF载体可能会获得更高的蛋白积累。我们的研究结果表明,外源基因表达水平与高效作用元件的组合具有正相关性。Sheludko认为农杆菌介导的瞬时转化中适合的注射液浓度OD600在0.1-1.5之间[4],我们的结果显示菌液注射液浓度OD600为0.4左右时,可以获得更高的外源基因表达。
Phan等[28]利用体内染色质免疫共沉淀技术证明,拟南芥转录因子AtMYB80能结合到天冬氨酸蛋白酶UNDEAD基因的启动子区从而正向调控该基因表达。本研究将AtMYB80转录因子插入pREUR-EF瞬时表达系统进行Dual-Luciferase实验,其结果与该ChIP-PCR结果一致。该系统相比其他用于Dual-Luciferase实验的瞬时表达载体的优势在于在转化过程中不需要与含有RNA沉默抑制因子的pSoup-p19载体共转化,并且增加eGFP标签后可实时监测转录因子表达情况。此外,由于该瞬时表达载体具有更高的表达效率,可缩短体内转录调控研究的实验进程。
4 结论
本研究构建了含有eGFP和FLAG标签的高效的瞬时表达载体pREU-EF、pREUR-EF和pREUR-p24-EF,定量实验证实了影响载体表达的作用元件组合与外源基因表达具有正相关性,高效作用元件的组合使用可以提高瞬时表达载体的稳定性和外源基因表达。此外,对菌液注射液浓度的探索进一步完善了瞬时表达体系研究。采用上述优化载体和最佳注射浓度可用于后续转录调控研究。

