犬腺病毒和犬细小病毒双重TaqMan 荧光定量PCR 检测方法的建立
王艳杰,巨敏莹,王秀明,刘亭岐,刘东霞,刘建奇,孔彩平,范秀丽,赵丽霞,宋庆庆*
(1. 金宇保灵生物药品有限公司,内蒙古 呼和浩特 010030; 2. 国家工程实验室,内蒙古 呼和浩特 010030;3. 内蒙古农业大学,内蒙古 呼和浩特 010018)
犬腺病毒(Canine adenovirus,CAV)属腺病毒科,哺乳动物腺病毒属,其基因组为双股,线状DNA 病毒,根据其血凝和中和试验等特性不同可将CAV 分为I 型和II 型[1-2], CAV-I 型主要引起犬的致死性肝炎,引起野生犬脑炎病理学变化;CAV-II 型则引起上呼吸道感染和肠道感染,不引起肺炎症状,可引起幼犬咳嗽又叫犬窝咳[1-3]。
犬细小病毒病又称犬传染性出血性肠炎(Ca⁃nine prvovirus,CPV),属于细小病毒科,细小病毒属成员,是一类无囊膜、单股DNA 病毒。临床症状表现分为肠炎型和心肌炎型,肠炎型潜伏期1~2周,多见于青年犬,病情较轻且治愈率高,而心肌炎型多见于8 周龄以下的幼犬,突然发病,数小时死亡[4-6]。
这两种病毒单一感染或混合感染均可给养犬业带来严重的打击,两种犬病原临床症状较为相似,且常伴有混合感染,给临床诊断造成了一定的困难[7-8]。现有学者建立了用于同时检测犬瘟热病毒(CDV)、CPV、CAV-II 型和犬副流感病毒(CPIV)的多重普通PCR 检测技术[3],以及CDV、CPV、I 型和II 型CAV 多重普通PCR 检测方法[1],本研究拟建立CAV 和CPV 双重TaqMan 荧光定量PCR 检测方法,以提高产品检测敏感度和提高产品检测的效率,并降低气溶胶污染的风险,本研究利用TaqMan 检测技术原理,设计了扩增CAV 的Hexon 基因和CPV 的VP2 基因的2 对引物和2 条探针,建立双重TaqMan荧光定量PCR 检测方法,以实现CAV 和CPV 的快速鉴别检测,为两种病毒的检测提供有效的技术保障,同时为CAV 和CPV 疫苗半成品的抗原定量和疫苗产品的质量监控提供技术手段。
1 材料与方法
1.1 主要实验材料CAV DNA、CPV DNA、CDV RNA、CPIV RNA、犬冠状病毒(CCV)RNA 均由金宇保灵生物药品有限公司提供。用于感染实验犬的CAV、 CPV 株均由金宇保灵生物药品有限公司分离、鉴定和保存。比格犬购自江苏省常州市某试验动物犬基地。MDCK 细胞购自ATCC;AceQ qPCR Probe Master Mix 试剂盒购自Vazyme 公司;DL2000 DNA Marker、pMD19-T 载体、JM109 感受态细胞、质粒提取试剂盒、凝胶回收试剂盒等均购自TaKaRa公司;Axyprep 病毒核酸提取试剂盒(AxyprepTMBody Fluid Viral DNA/RNA Miniprep Kit)购自AxyGen 公司。
1.2 引物、探针的设计与合成根据GenBank 中登录的CAV 基因序列(EU717145.1)和CPV 基因序列(EF028071.1),利 用DNAStar 软 件 进 行 同 源 性 分析,采用Primer3 设计引物和探针(表1),引物和探针均由上海生工生物工程技术服务有限公司合成。

表1 CAV 和CPV 引物、探针序列Table 1 Primers and probes sequence of CAV and CPV
1.3 重组质粒标准品的构建与鉴定分别以CAV 和CPV DNA 为模板,采用表1 引物进行PCR扩增,反应体系为:2×AceQ qPCR Probe Master Mix 12.5 μL,上下游引物(10 μmol/L)各为0.5 μL,模板为2 μL,加无酶水补充至25 μL;反应条件为: 95 ℃5 min;95 ℃30 s、56 ℃30 s、72 ℃30 s,共35 个循环;72 ℃7 min。扩增的CAV 和CPV 目的片段长度分别为132 bp 和192 bp,PCR 产物回收经试剂盒纯化后克隆至pMD19-T 载体,转化至JM109 感受态细胞,选取经菌落PCR 鉴定和序列测定分析验证的阳性重组质粒pMD-Hexon-CAV 和pMD-VP2-CPV 作为质粒标准品。测定重组质粒浓度,并根据拷贝数计算公式换算成拷贝数。
1.4 双重荧光定量PCR 检测方法反应条件的优化采用25 μL 反应体系,其中2×AceQ qPCR Probe Master Mix 12.5 μL,上 下游引物(10 μmol/L)各为0.125 μL、0.25 μL、0.375 μL、0.5 μL、0.625 μL,探针(10 μmol/L)为0.25 μL、0.5 μL、0.75 μL、1.00 μL、1.25 μL,模板为5 μL,加dd H2O 补充至25 μL,采用棋盘法进行引物和探针浓度优化。CAV 和CPV 双重荧光定量PCR 体系比例配置按照1:0.5、1:1、1:1.5 和1:2 进行优化。扩增循环条件如下:95 ℃,10 min;95 ℃10 s、52 ℃~62 ℃30 s Read,循环数为45,进行退火温度优化。
1.5 双重荧光定量PCR 标准曲线的绘制将pMDHexon-CAV 和pMD-VP2-CPV 重组质粒标准品稀释至108拷贝/μL 后再作10 倍倍比稀释,采用已建立的双重荧光定量PCR(模板为2 种重组质粒标准品混合物)方法进行荧光定量PCR 扩增,通过分析软件生成标准曲线。
1.6 特异性试验利用优化的反应体系和条件对CDV、CPIV、CCV 核酸进行双重荧光定量PCR 扩增,以MDCK 细胞培养的CAV-I 型、CAV-II 型和CPV 培养液提取的核酸作为阳性对照,同时设立阴性对照。验证该方法的特异性。
1.7 敏感性试验以分别10 倍倍比稀释的(101拷贝/μL~108拷贝/μL)的两个质粒标准品混合物作为模板,按照本研究建立的CAV 和CPV 双重TaqMan荧光定量方法进行PCR 扩增,每个稀释度做3 次重复。确定TaqMan 双重荧光定量PCR 的敏感性,同时设立阴性对照。
1.8 重复性试验以103拷贝/μL~106拷贝/μL 4 个稀释度CAV 和CPV 混合重组质粒标准品为模板分别进行3 次重复扩增,利用本研究建立的方法检测,进行组内重复性分析;9 个不同批次的CAV 和CPV 混合模板重组质粒标准品为模板,利用本研究建立的方法检测,进行组间重复性分析,计算变异系数,分析该方法重复性。同时设立阴性对照。
1.9 临床模拟样品检测选择2~3 月龄健康易感犬6 只,分成3 组,一组口服感染2 mL 103.0TCID50/mL CPV 细胞培养病毒液,一组分别口服、滴鼻各1 mL 106.0TCID50/mL 的CAV 细 胞 培 养 病 毒 液,另 一 组 作 为未感染对照,连续观察感染犬临床症状,并于第14 d 解剖。将采集的分别感染CAV(10 份)和CPV(27 份)的犬新鲜口、鼻、眼、尿、肛式子和心、肝、脾、肺、肾、脑、肠、胃、气管、扁桃体、颌下淋巴结、肠系膜淋巴结组织,反复冻融并研磨后加入裂解液进行裂解,以提取的样品基因组DNA/RNA 为模板。分别采用本实验建立的荧光定量PCR和检测CAV(DB51/T 1710.7-2013)、CPV 的普通PCR方法[9]进行检测,比较二者的检测结果,并计算二者的符合率。
2 结 果
2.1 质粒标准品的构建与鉴定以CAV 和CPV DNA 为模板,利用设计的引物进行PCR 扩增,结果显示扩增获得预期大小目的片段(图略)。目的片段回收纯化后克隆于pMD19-T 载体中,构建重组质粒pMD-Hexon-CAV 和pMD-VP2-CPV,重组质粒经菌落PCR 鉴定和测序鉴定正确,测得重组质粒浓度为103 ng/μL 和81.7 ng/μL,换算成拷贝数分别为2.27×1010拷贝/μL 和1.80×1010拷贝/μL,作为双重荧光定量PCR 的标准品。
2.2 双重荧光定量PCR 反应条件的优化及标准曲线的建立经优化后,确定反应体系为(25 μL):2×AceQ qPCR Probe Master Mix 为12.5 μL,CAV 上下游引物(10 μmol/L)各为1 μL,CAV 探针(10 μmol/L)为0.75 μL,CPV 上下游引物(10 μmol/L)各为1 μL,CPV 探针(10 μmol/L)为0.75 μL,CAV 和CPV 1:1 混合模板为5 μL,加dd H2O 补充至25 μL。反应程序为: 95 ℃10 min; 95 ℃15 s,56 ℃30 s Read,循环数为45。经优化后CAV 和CPV 双重荧光定量PCR检测方法阴性对照无CT 值,CAV 和CPV 阳性对照CT 值均小于30,扩增曲线呈现典型的扩增曲型曲线,每一样品均进行了两个重复(图1)。将重组质粒标准品稀释至108拷贝/μL 并作10 倍倍比稀释,采用优化后的双重荧光定量PCR 扩增,生成标准曲线(图1)。结果显示,CAV和CPV相关系数分别为0.999和0.998,效率分别为99.8 和104.3,均在90%~110%之间,具有良好的线性关系。其回归方程分别为,CAV:y=-3.326x+38.933; CPV:y=-3.223x+39.882,因此可以根据所检测临床样品的Cq 值,参照标准曲线可以计算出待测样品的拷贝数。

图1 CAV 和CPV 双重荧光定量PCR 扩增曲线Fig.1 Amplification curve of CAV and CPV by the duplex qPCR assay
2.3 特异性试验结果采用建立的CAV 和CPV 双重荧光定量PCR 检测方法对CDV、CPIV、CCV 核酸进行PCR 扩增,设置2 个重复,并设立阴性和CAV-I、CAV-II、CPV 的核酸作为阳性对照。结果显示只有CAV-I、CAV-II 和CPV 核酸出现扩增曲线,且CT 值均小于30,而其他病原和阴性对照均无扩增曲线,呈阴性(图2),表明所建立的方法具有较强的特异性。
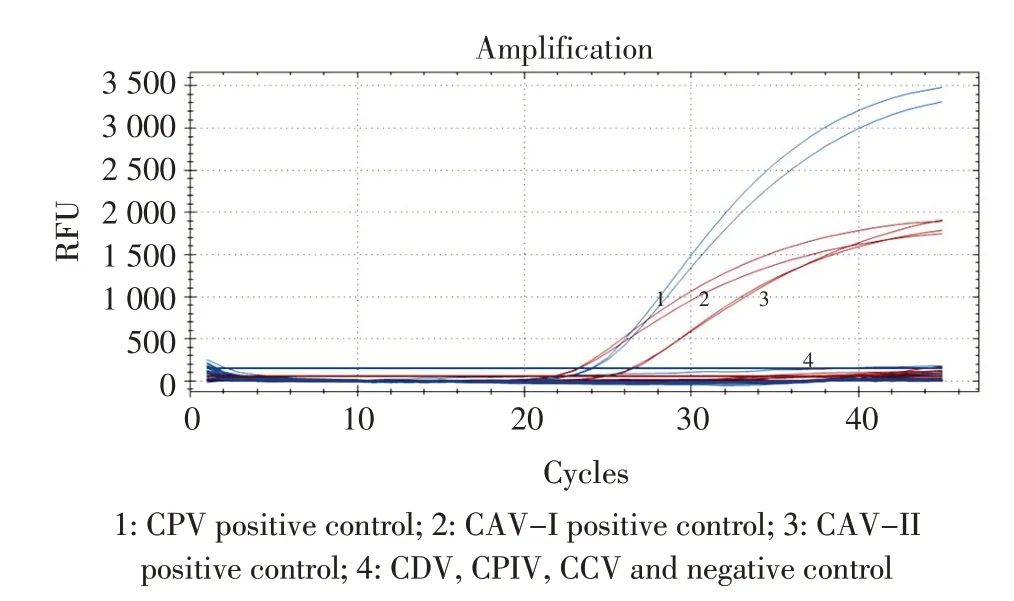
图2 双重荧光定量PCR 检测方法特异性试验Fig.2 The specific test of the duplex qPCR assay
2.4 敏感性试验结果应用本研究建立的CAV 和CPV 双重荧光定量PCR检测方法对经10倍倍比稀释的两个质粒标准品pMD-Hexon-CAV 和pMD-VP2-CPV 混合物(每一个质粒每个稀释度各取2.5 μL)作为模板进行该方法敏感性检测,结果显示,对质粒标准品pMD-Hexon-CAV 和pMD-VP2-CPV 的最小检出量均为101拷贝/μL(图3)。表明本研究建立的双重荧光定量PCR 方法敏感性较高。

图3 双重荧光定量PCR 检测方法敏感度检测Fig.3 The sensitivity test of the duplex qPCR assay
2.5 重复性试验结果利用CAV 和CPV 的4 个稀释度的各两个质粒标准品DNA模板混匀后进行组内和组间的重复性试验,利用变异系数计算公式计算变异系数,结果显示,CAV和CPV组内和组间变异系数均小于2%(表2),表明该方法具有较好的重复性。

表2 重复性试验结果Table 2 Repeatability test of the duplex qPCR assay
2.6 临床模拟样品检测结果将分别采集的10 份(CAV)和27 份(CPV)人工感染犬组织样品,分别利用建立的双重荧光定量PCR方法和普通PCR方法进行检测。结果显示,双重荧光定量PCR方法CAV检测阳性率为0(0/10),CPV 检测阳性率为88.89%(24/27),普通PCR 方法CAV 检测阳性率为0(0/10),CPV 检测阳性率为85.18%(23/27),根据金标准计算符合率的方法,所建立的双重荧光定量PCR 方法与普通PCR方法CAV 和CPV 的符合率分别为100%和96.30%。表明,所建立的双重荧光定量PCR 方法与普通PCR 方法符合率高,且CAV 阳性率低、CPV 阳性率高与感染动物典型临床症状相符,同时本检测阳性率只能代表本次感染样品的结果,受感染病毒株、剂量、途径和采样位置的不同,阳性率会存在差异,本临床模拟样品检测试验仅为验证方法的符合率。
3 讨 论
本研究分别根据CAV 和CPV 的保守基因,设计了分别检测CAV 和CPV 的1 对引物及其对应的1 条探针,实现两个病毒的同时检测,CAV 和CPV 双重荧光定量PCR 检测方法大大缩短了普通PCR 检测的时间,并且因其封闭式避免了PCR 产物气溶胶的污染,更好的保护了实验室环境,而且双重荧光定量PCR 相比于单重荧光定量PCR 降低了试验时间、成本以及同一样品中CAV 和CPV 两指标分别检测的误差,操作更加准确、快速。
本研究为避免双重PCR 两种不同检测指标之间的干扰,在PCR 引物探针设计阶段,尽可能将CAV和CPV 的目的片段设计得大小接近,且引物,探针退火温度接近,同时优化了CAV 和CPV 两种体系的引物和探针浓度对应比例关系和退火温度,使两种病毒检测干扰因素尽可能最低,经优化发现两种病毒单重PCR 和双重PCR 不存在干扰,单重和双重检测敏感度均为10 拷贝/μL,8 个梯度标品CT 值也无明显差异,该荧光定量PCR 检测敏感度比文献2 的多重检测敏感度(106拷贝/μL)约高10 000 倍,比文献2 的单重检测敏感度(105拷贝/μL)约高1 000 倍,尽管检测敏感度的表述方式不一,但根据文献[10]的联合PCR 与TCID50检测敏感度比较,证明理论上PCR 检测方法的敏感度要优于TCID50。随着新型检测技术的开发,文献[11]的高效纳米检测技术的敏感度也具有一定的优势,但是同文献[12]和[13]的普通PCR 一样,均需要进行琼脂糖凝胶电泳,不利于实验室环境的保护,且无法实现定量检测,同时荧光定量PCR 检测结果直观,无干扰条带对结果判定不清的弊端。
将本研究建立的CAV 和CPV 双重荧光定量PCR检测方法与普通PCR 检测方法进行符合率分析,符合率高且CAV 和CPV 双重荧光定量PCR 不仅能实现双指标的同时检测,并且可实现两种病毒的定量检测,因此本研究所建立的CAV 和CPV 双重荧光定量PCR 检测方法不仅可用于CAV 和CPV 感染监测还可实现兽用疫苗生产企业中CAV 和CPV 联苗抗原含量的检测,具有一定的指导生产意义,大大缩短疫苗抗原含量测定时间。

