一株鸭疫里默氏杆菌的分离鉴定及其免疫原性研究
孔桂慧,王方昆,孙淑红,孟照洁,许明清,赵 情
(1. 山东农业大学 动物医学院,山东 泰安 271018;2. 山东和康源生物育种股份有限公司,山东 济南 250101)
鸭疫里默氏杆菌病是由鸭疫里默氏杆菌(Rimer⁃ella anatipestifer,RA)引起的一种接触性传染性疾病,又称为鸭传染性浆膜炎。该病多见于2~8 周龄雏鸭,成年鸭罕见发病,呈急性或慢性败血症,主要表现为精神沉郁,纤维素性心包炎、肝周炎,眼睑流泪,还可引起干酪性输卵管炎、脑膜炎、结膜炎和关节炎等[1]。RA 在自然界分布广泛,血清型众多,公认的有21 种[2],并且不同血清型之间无交叉免疫保护作用,再加上临床治疗抗生素的滥用,导致该病的防控和治疗极其困难[3-4]。
近年来国内多次报道RA 病例,且血清型多样,临床症状各有不同。李书光等在50 日龄种鸭分离到一株2 型RA,该菌对鸭群造成死亡率约为1%,可导致纤维素性心包炎、肝周炎、气囊炎、脑部水肿[5];焦哲等在湖北13 日龄雏蛋鸭中分离到一株RA,该菌与呼肠孤病毒出现混合感染,该鸭群表现为头肿大流泪,脚软,共济失调,排白色稀便[6];郝东敏等在13 日龄肉鸭中分离到一株7 型RA,该菌可导致鸭群周死淘率1.4%,剖检病死鸭可见肝脏有纤维素膜附着,脑膜出血[7]。
2019 年7 月在山东某樱桃谷种鸭场,存栏5 500只,29 周龄,出现不明原因死淘升高,每天死亡12只左右,周死淘率为1.53%。死亡鸭子料量减少、有神经症状,现场剖检症状为卵泡出血、破裂,纤维素性心包炎、肝周炎、肝脏肿大、出血,根据剖检症状初步判定为细菌感染后,在脑中分离到1 株RA,并对其进行血清型鉴定和毒力测定等,通过动物回归实验最终确诊该种鸭场大量成年种鸭突发死亡病因是1 型RA 感染。
1 材料与方法
1.1 病料样品及实验动物病料样品来自山东省某种鸭场29 周樱桃谷发病种鸭,无菌采集发病鸭脑、肝脏、脾脏、卵泡等组织。7 日龄和28 日龄健康樱桃谷商品鸭来自山东和康源生物育种股份有限公司。
1.2 主要试剂病毒RNA 提取试剂盒购自广州飞扬生物工程有限公司;RT-PCR 一步法试剂盒[HiS⁃cript ⅡOne Step RT-PCR Kit(Dye Plus)]购自南京诺唯赞生物科技有限公司;DL2000 DNA Maker 购自TaKaRa 公 司; 营 养 琼 脂(NA)、 麦 康 凯 琼 脂(MAC)、SS 琼脂均购自青岛高科园海博生物技术有限公司;无支原体胎牛血清购自浙江天杭生物科技有限公司;药敏纸片购自杭州微生物试剂有限公司;1、2、7、11 型RA 阳性血清由齐鲁制药有限公司动保研究所提供;改良马丁肉汤培养基购自荣成雨林生物有限公司;吐温80、白油购自郑州益康生物有限公司。
1.3 细菌的分离无菌挑取病死鸭的脑组织,分别划线接种于5%胎牛血清NA 培养基、MAC 培养基、SS 培养基,5%胎牛血清NA 平板置37 ℃5%CO2培养24 h,MAC 培养基、SS 培养基置37 ℃培养24 h。挑取可疑菌落进行纯培养,观察菌落形态。
1.4 细菌PCR 鉴定将1.3 中纯化培养的菌落用无菌ddH2O 吹 下,5000 r/min 离 心5 min,弃 掉2/3 上清,将沉淀与剩余ddH2O 吹打混匀,沸水浴10 min,5000 r/min 离心5 min,取上清液作为模板,利用细菌16S rRNA 通用引物进行扩增[8],产物经1.2%琼脂糖凝胶电泳检测后由上海生工生物工程技术服务有限公司测序,测序结果与GenBank 中登录的RA 序列进行BLAST 比对分析。根据文献[9]中提供的RA 序列,合成RA camp 基因鉴定引物,采用PCR 方法进一步鉴定。
1.5 细菌血清型鉴定将1.3 中纯化培养的菌落用无菌PBS 吹下作为待检菌液,取1、2、7、11 型RA阳性血清25 μL 与25 μL 菌液进行凝集试验[10],对分离菌株进行血清型鉴定。
1.6 药敏试验参照《兽医微生物学实验指导》圆纸片扩散法[11],检测分离菌对常用的头孢类、青霉素类、氨基糖苷类、四环素类、氟喹诺酮类、氯霉素类、大环内酯类、林可霉素类、磺胺类、多肽10类18 种抗生素的敏感性。
1.7 动物回归试验及最小致死量的测定将RA 菌株接种于改良马丁肉汤培养基培养,将扩增后的菌液10 倍倍比稀释后(104cfu/mL~107cfu/mL),经胸部肌肉注射(1 mL)感染28 日龄商品鸭,每个剂量感染5 只,阴性对照5 只,观察一周内鸭子临床症状及发病死亡情况,剖检观察病理变化,并计算最小致死量。参照1.3~1.5 所述方法分离鉴定细菌。
1.8 分离株灭活油苗的制备和免疫保护试验扩增RA-sd01 菌液,平板计数,用3‰甲醛灭活24 h,灭活菌液8 000 r/min 离心10 min,弃上清,根据平板计数结果用0.85%灭菌生理盐水将菌液浓缩至1.5×1010cfu/mL,加入4%吐温-80 混合均匀,并与白油按1:2 比例乳化,油苗中菌株的最终浓度为5×109cfu/mL。
将7 日龄健康商品鸭分为3 组,每组10 只,A组免疫某疫苗公司疫苗,B 组免疫自制疫苗,C 组为空白对照组,免疫方式为颈部皮下注射,每只注射0.5 mL,详细信息见表1。

表1 动物实验设计Table 1 Animal experiment design
免疫后21 d,用培养后的RA-sd01 株攻毒,胸肌注射,每只鸭子攻毒菌株菌量为106cfu/只,攻毒后一周内观察鸭子的发病或死亡情况。
2 结 果
2.1 细菌分离培养结果无菌操作,对病死鸭的脑组织病料样品进行细菌培养,MAC 平板、SS 琼脂平板上未见细菌生长,5%血清NA 培养基平板上生长出均匀一致的菌落,表面光滑,呈水滴状,稍隆起,圆形,边缘整齐,45°角对光观察可见淡蓝色荧光,与RA 菌落特征一致。
2.2 细菌的PCR 鉴定结果利用16S rRNA 进行PCR 扩增,结果显示未加细菌DNA 模板空白对照无扩增条带,分离株样本可以扩增片段大小为1500 bp左右单一条带,与预期结果一致(图1),扩增产物由上海生工生物工程技术服务有限公司测序,测序结果在BLAST 中进行比对,结果显示,该分离株与RA 同源性在99%~100%,根据分类标准,初步确定该分离株为RA。
参考罗玲等报道的PCR 鉴定方法[9],应用RA camp 鉴定引物进行PCR 扩增,结果得到与目的片段610 bp 大小一致的单一条带(图1),进一步表明该分离株为RA,命名为RA-sd01 株。
2.3 细菌的血清型鉴定结果利用凝集试验检测该分离菌株血清型,结果显示,该分离株与1 型RA标准阳性血清混合后玻片上出现颗粒状凝集,与2、7、11 型标准阳性血清混合后均不出现颗粒状凝集,表明该分离株血清型为1 型RA。

图1 分离菌的PCR 鉴定结果Fig.1 Identification of the isolation bacteria by PCR
2.4 药敏试验结果采用纸片扩散法检测分离菌对10 类18 种抗生素的药物敏感性,结果显示,该细菌对头孢类药物、氟苯尼考、多西环素、红霉素等较敏感,具体药敏信息见表2。
2.5 动物回归试验与最小致死量测定结果利用不同浓度分离菌菌液感染实验鸭,感染后连续观察7 d,具体结果见表3。观察临床症状与鸭场病死鸭一致,发病死亡实验鸭死亡前期可见精神萎靡、有神经症状、料量减少、眼睑流泪;剖检实验鸭观察病理变化显示,肝脏肿大,心脏、肝脏表面有纤维素膜附着,与鸭场病死鸭相似,对病死鸭进行脑部细菌分离,均分离鉴定到1 型RA,表明分离菌株RA-sd01 为该次种鸭场暴发疫病的病原菌。根据死亡情况,计算出该菌株对鸭群的最小致死量为6.9×105cfu/mL。

表2 药敏试验结果Table 2 Drug sensitivity results

表3 最小致死量结果Table 3 The minimum lethal dose of RA-sd01 strain
2.6 免疫保护试验结果免疫后21d 用RA-sd01 菌株攻毒,结果显示,未免疫组鸭24 h 开始发病,精神沉郁,缩头,不吃料,48 h 开始出现死亡,截止至120 h 共死亡9/10 只,剖检均出现包心包肝症状,对脑进行细菌分离,10 只鸭均分离到1 型RA。免疫攻毒组鸭精神状态良好,采食量正常,A 组B 组均未出现死亡,120 h 剖检时A 组包心包肝占2/10,脑1型RA 分离率为2/10,B 组包心包肝占1/10,脑1 型RA 分离率为1/10,具体信息见表4。该免疫攻毒试验表明,同血清型疫苗对RA 的保护率达到90%。
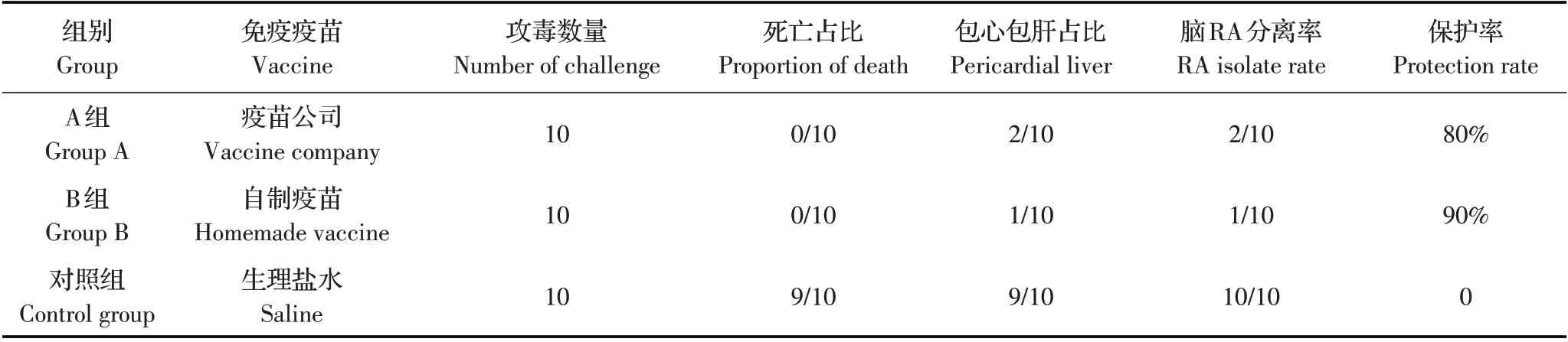
表4 免疫攻毒保护试验结果Table 4 Test results of immune challenge protection
3 讨 论
通过剖检、细菌分离鉴定和动物回归试验,确定该种鸭场疾病的发生是由1 型RA 导致。根据以往报道,鸭传染性浆膜炎多见于2~8 周龄雏鸭,成年鸭罕见发病[1]。本研究在前期排除几种常见病毒病感染的基础上,确诊一例29 周龄父母代种鸭1 型RA 感染,但发病的周龄与近年来报道病例不同。罗玲等在湖北省某鸭场10日龄雏鸭分离到一株1型RA[10];雷云等在贵州省某鸭场25 日龄病死鸭分离到4/6 的2 型RA[1];陆新浩等对宁波各地送诊的14 d~21 d 左右有典型气囊炎、肝包膜炎、心包膜炎的病鸭或死鸭的肝脏、脑分离到RA[6];以上报道均为小周龄鸭感染RA,对于成年鸭发病报道极少。本研究证明RA 可以引起成年鸭群发病,提示临床上应重视产蛋鸭RA 感染的风险,加强鸭传染性浆膜炎防控。
感染RA 后,2~8 周龄感染鸭最明显的病变是脏器浆膜面有纤维素性渗出,以肝脏和心脏最为明显,还可出现脑膜炎、气囊炎和输卵管炎等[12-14],由于血脑屏障的作用,药物很难进入脑组织,使用药物后其他脏器药物浓度较高,能够有效减少细菌的侵害,而脑中血药浓度较低,成为细菌繁殖的主要场所,从而导致脑膜炎的发生[15]。
针对RA 的感染,大多采用抗生素治疗[16],随着周龄的增大,药物的使用逐渐增多,对药物的耐药性逐渐增强,病原菌易产生耐药性,呈现多重耐药趋势[17]。本研究药敏结果显示,RA-sd01 株对9 种常见抗生素呈现多重耐药现象,仅对头孢类、氟苯尼考、多西环素、红霉素等较敏感。但氟苯尼考具有胚胎毒性,妊娠期和哺乳期慎用,产蛋期应禁止氟苯尼考的使用,疾病一旦发生,可紧急注射头孢,多西环素拌料饲喂。
当前预防控制该病发生的最有效手段就是RA疫苗,但是RA 血清型众多,迄今我国已发现21种,不同血清型菌株之间的交叉保护低、毒力差异大[17],给该病的防控增加了难度。可行的方法是采用病鸭分离的RA 菌株制备疫苗,能够更有效地控制该病在当地鸭群中的流行[18]。应用本研究分离株RA-sd01 株制备灭活苗,通过免疫攻毒保护试验,保护率可达到90%,高于市售商品化疫苗,与嵇辛勤和王小兰等报道相符[18-19],可以提供良好的免疫保护力。免疫保护实验证实RA-sd01 株可以作为现地候选疫苗株,可以通过优化免疫佐剂等进一步提高免疫保护率。本研究为当地有效预防控制鸭群RA 感染和种鸭场RA 净化奠定了基础。

