包头地区仔猪源致泻性大肠杆菌进化分群、生物被膜形成能力及耐药性检测
葛海燕
(内蒙古农业大学职业技术学院 , 内蒙古 包头 014100)
仔猪腹泻是临床中常见疾病之一,其发病率和死亡率均较高,引起仔猪腹泻病原较多,主要包括大肠杆菌、沙门菌、奇异变形杆菌、产气荚膜梭菌、流行性腹泻病毒、传染性胃肠炎病毒等,其中致病性大肠杆菌是引发仔猪腹泻的重要病原之一[1-3]。细菌生物被膜(Bacterial biofilm, BBF) 是组成结构性细菌群落的主要物质,主要由附着细菌细胞和包裹细菌的水合性胞外聚合物物质,在自然界中,当外界条件成熟,细菌均能够形成生物被膜(Biofilm,BF),生物被膜形成能力与细菌毒力及耐药性具有一定相关性[4-5]。仔猪大肠杆菌病的防治主要以抗菌药物为主,长期使用抗菌药物,会致使大肠杆菌多重耐药菌株不断出现,降低抗菌药物使用效果,同时也给人们健康带来一定威胁[6-7]。
本试验以临床分离的48株仔猪源致泻性大肠杆菌为研究对象,检测并分析其进化分群、生物被膜形成能力、耐药性及其相关性,为科学中合理用药及防控该病提供科学依据。
1 材料与方法
1.1 菌株来源 2018-2019年,临床分离的48株仔猪源致泻性大肠杆菌、大肠杆菌质控菌株 ATCC 25922均由本单位动物传染病实验室保存。
1.2 主要试验材料 营养肉汤,购自北京双旋微生物培养基制备科技公司;大肠杆菌显色培养基,购自青岛高科园海博生物技术有限公司;临床中常用药物纸片,购自杭州天和微生物试剂有限公司;96孔细菌培养板,购自上海研晶生物科技有限公司;2×TaqMarker Mix,购自北京康为世纪生物科技有限公司;DL-600 Marker,购自北京中科瑞泰生物公司;细菌DNA提取试剂盒,购自宝生物工程(大连)有限公司;常规的试验试剂由本试验提供。
1.3 细菌的复苏与培养 取出-80 ℃保存的菌种,室温解冻,无菌条件划线接种于大肠杆菌显色培养基,37 ℃恒温培养12~18 h,挑取大肠杆菌显色培养基生长的单个菌落,接种于营养肉汤中扩大培养,并进行计数。
1.4 细菌分子分群PCR鉴定 参考文献[8],设计大肠杆菌分子分群chuA、yiaA和TspE4.C2引物(表1),引物由生工生物工程(上海)股份有限公司合成。按照细菌DNA提取试剂盒说明书提取分离菌株的基因组DNA,采用多重PCR方法对大肠杆菌进行系统分群鉴定,大肠杆菌系统分群进化判定标准见图1。PCR反应体系25 μL:2×TaqMarker 12.5 μL,引物P1、P2各1 μL,DNA模板1 μL,去离子水9.5 μL。94 ℃预变性 5 min; 94 ℃变性 30 s, 57.5 ℃复性 30 s, 72 ℃延伸60 s,30个循环;最后 72 ℃延伸 5 min。将扩增后的 PCR 产物用1%琼脂糖上凝胶电泳检测目的条带。
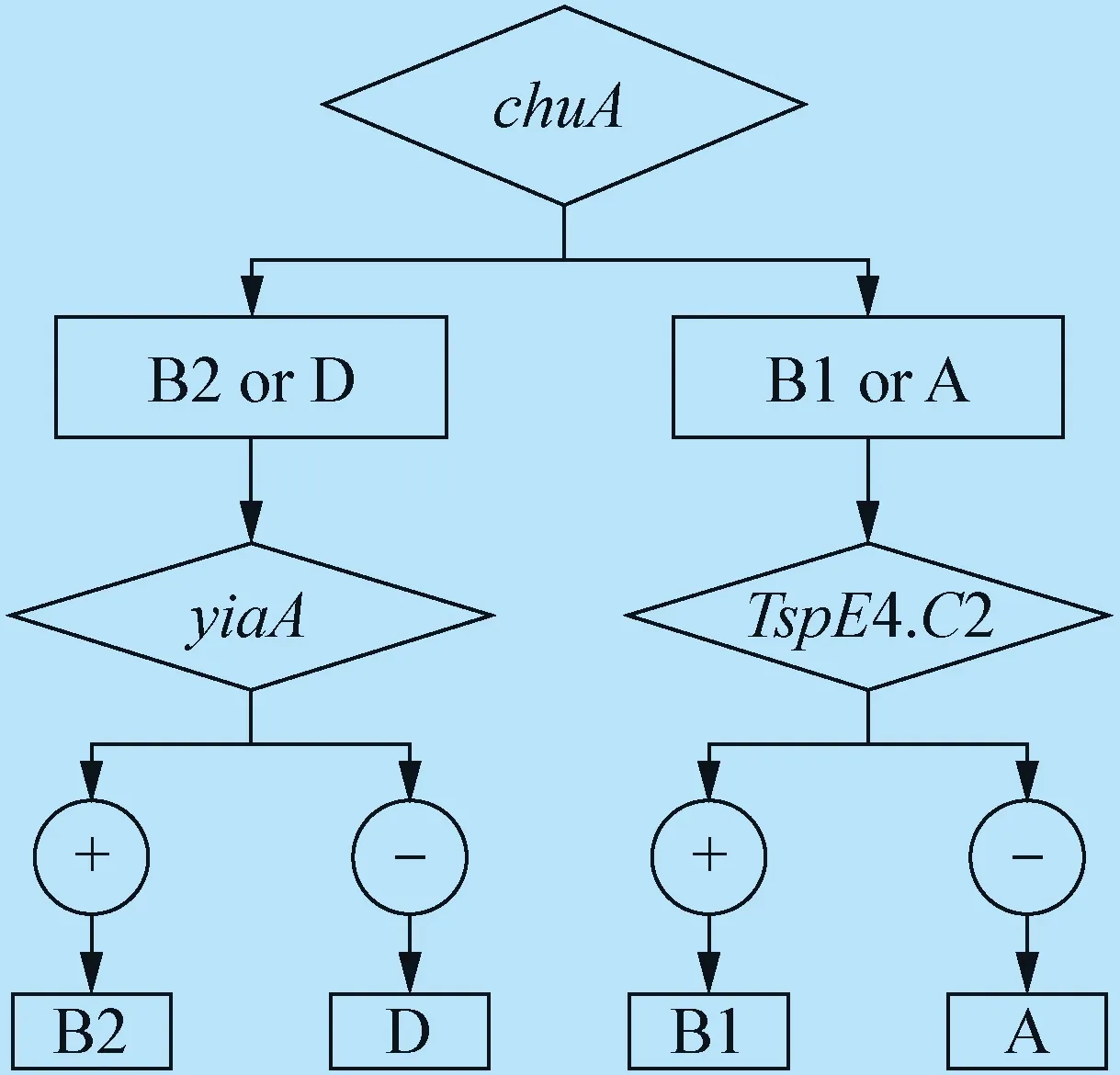
图1 大肠杆菌系统进化分群的判定标准
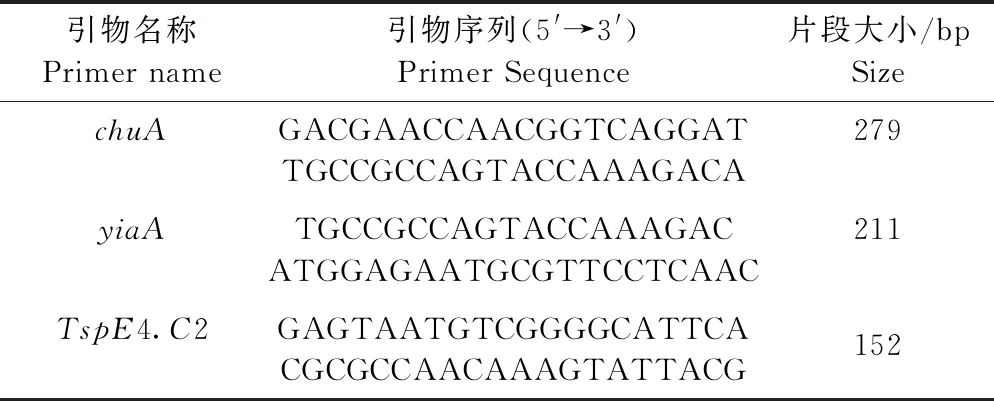
表1 大肠杆菌分子分群引物序列
1.5 细菌的药敏试验检测 参照美国临床实验室标准化协会(CLSI)推荐的标准药敏试验法进行操作和试验结果判断,以大肠杆菌 ATCC 25922作为质控菌株。调整分离菌株的浓度为0.5个麦氏浊度,无菌条件下均匀涂布在普通营养培养基上,贴上药敏纸片,37 ℃培养18~24 h,测量其抑菌圈直径(mm)。
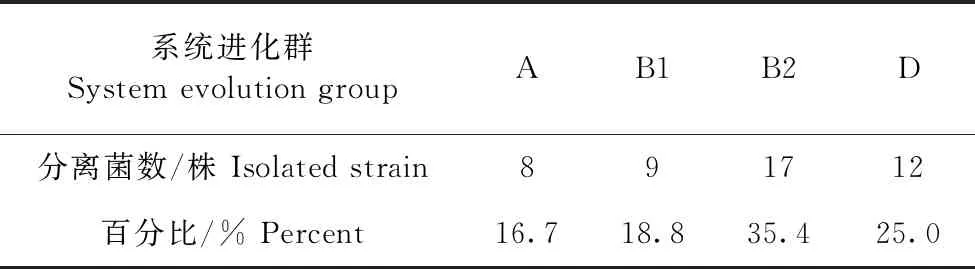
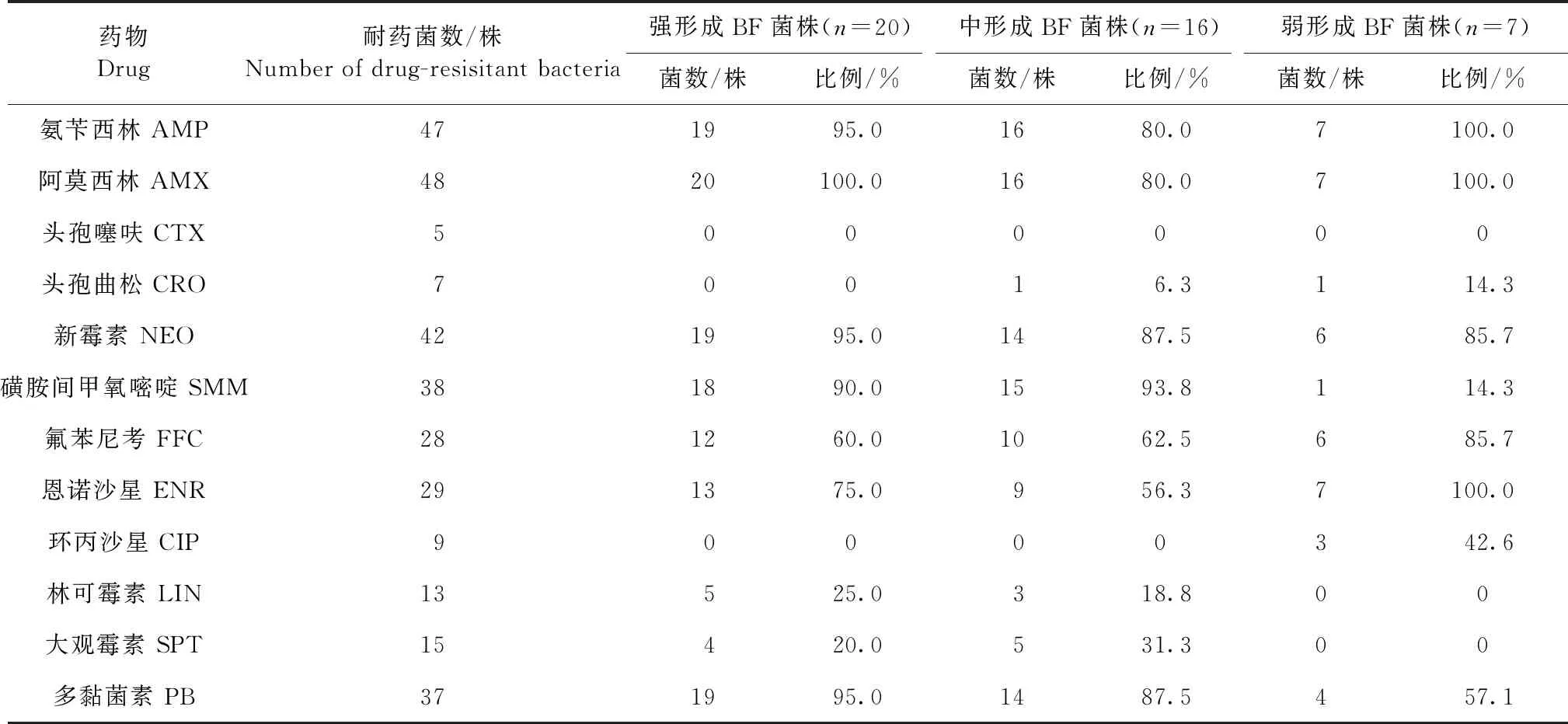
1.6 细菌的BF 检测 按参考文献[9],采用结晶紫微孔板法对临床分离的48株仔猪源致泻性大肠杆菌进行 BF形成能力测定。每株菌重复接种 10孔,在OD值595 nm下,重复检测试验孔和对照孔3 次,取均值。判定标准以阴性对照孔OD值的2倍作为判断能否形成 BF 的临界点ODc值,当OD值≤ODc值时,表示BF形成能力为0;当ODc值 2.1 细菌分子分群鉴定 分离的48株仔猪源致泻性大肠杆菌均扩出来chuA、yiaA和TspE4.C2目的条带。经结果判定,48株仔猪源致泻性大肠杆菌中,A群有8株、B1群有9株、B2群有17株、D群有12株,分别占分离菌株的16.7%、18.8%、35.4%、25.0%, 其中, B2群和D群流行为主(表2)。 表2 仔猪源致泻性大肠杆菌系统进化分群鉴定结果 2.2 耐药性检测 由表3可知,分离的48株仔猪源致泻性大肠杆菌对氨苄西林、阿莫西林、新霉素、磺胺间甲氧嘧啶、多黏菌素、氟苯尼考、恩诺沙星7种药物耐药性较高,耐药率在58.3%~100.0%;对头孢噻呋、头孢曲松、环丙沙星、林可霉素、大观霉素5种药物耐药性相对较低,耐药率在11.9%~31.3%。 表3 仔猪源致泻性大肠杆菌的耐药性分析结果 2.3 BF形成能力检测 采用结晶紫微孔板法对临床分离的48株仔猪源致泻性大肠杆菌进行 BF形成能力测定。临床分离的48株仔猪源致泻性大肠杆菌中43株能形成BF,占分离菌株的89.6%(43/48)。其中,强形成膜能力菌株有 20株、中形成膜能力菌株有16株、弱形成膜能力菌株有7株、不形成BF菌株的有5株,分别占分离菌株的41.7%、33.3%、14.6%、10.4%。 2.4 BF形成能力与耐药性相关性分析 由表4可知,多黏菌素、新霉素、磺胺间甲氧嘧啶、氟苯尼考、恩诺沙星、氨苄西林、阿莫西林7种药物耐药性与强形成BF菌株的复合率在60.0%~100%,多黏菌素、新霉素、磺胺间甲氧嘧啶、氟苯尼考、恩诺沙星、氨苄西林、阿莫西林7种药物耐药性与中形成BF菌株的复合率在56.3%~93.8%,多粘菌素、新霉素、氟苯尼考、恩诺沙星、氨苄西林、阿莫西林5种药物耐药性与强形成BF菌株的复合率在57.1%~100%。其余的抗菌药物的耐药性与BF形成复合率较低。说明多黏菌素、新霉素、磺胺间甲氧嘧啶、氟苯尼考、恩诺沙星、氨苄西林、阿莫西林7种药物耐药性产生与BF形成能力有关。 表4 仔猪源致泻性大肠杆菌耐药性与BF形成能力相关性分析结果 已有报道表明,大肠杆菌可分为 A、B1、B2 和 D 四个群,其中 B2 和 D 群被认为是主要的致病群[8-9]。研究表明,分离的致犬腹泻性大肠杆菌分离株以B2、D群为主。本试验表明,48株仔猪源致泻性大肠杆菌中以B2群和D群流行为主,分别占分离菌株的35.4%和25.0%,与王明诚等[10]报道的基本上一致。但与李金朋等[9]报道具有一定的差异性,可能与地区有关。 大肠杆菌耐药性产生与抗菌药物长期使用有关,还与其携带的耐药机制有关,其携带耐药质粒在不同菌株之间传播,引起其他菌株产生耐药性[11]。本试验表明,该地区分离的48株仔猪源致泻性大肠杆菌对抗菌药物耐药性严重。与计徐等[12]、王克领等[13]的报道存在一定差异性。可能与地区、菌株耐药性遗传及临床用药不同,导致仔猪大肠杆菌产生耐药性存在一定的差异性。本试验表明,48株仔猪源致泻性大肠杆菌的BF 形成能力与多黏菌素、新霉素、磺胺间甲氧嘧啶等7种药物耐药性存在一定的相关性,说明仔猪源致泻性大肠杆菌的BF 形成能力与其产生的耐药性有关,其BF形成能力增加大肠杆菌的耐药性。与李金朋等[9]报道基本上一致。BF形成能力增强细菌耐药性机理尚未明确,有待进一步研究。本试验为该地区仔猪源致泻性大肠杆菌病临床合理用药提供了试验依据。2 结果

3 讨论

