猪CR1-like蛋白酵母双杂交诱饵质粒的构建及鉴定
贾瑞璞 , 凌小雅 , 孙雨晨 , 尹 伟 , 范阔海 , 孙 娜 , 孙耀贵 , 李宏全
(山西农业大学动物科技学院 , 山西 太谷 030801)
以补体受体Ⅰ型(Complement receptor 1,CR1)为基础的红细胞免疫粘附是人红细胞最重要的免疫功能。非人灵长类动物的红细胞免疫粘附受体是一种分子量相对较小的蛋白,称作CR1-like。兽医学研究发现,许多禽类[1~2]、啮齿类[3]、灵长类[4]等动物疾病过程中都存在红细胞免疫功能的变化。1983年,以狒狒和恒河猴作为研究对象,证实了灵长类动物的红细胞可以在体内循环中拦截补体固定的免疫复合物(Immune complex,IC),粘附着IC的红细胞将其运送至肝脏并返回至循环系统中,这种红细胞-IC的清除机制在IC沉积介导的疾病中是至关重要的[5]。本实验室前期研究工作证实,猪红细胞也具有免疫粘附功能,猪红细胞CR1-like可粘附血清致敏的荧光大肠杆菌,并通过免疫沉淀技术进一步对猪红细胞膜总蛋白分析发现,CR1-like是猪红细胞发挥免疫粘附功能的分子基础[6-8]。
但总体而言,猪的红细胞虽然具有免疫功能,但是猪红细胞发挥免疫粘附功能的分子基础及其结构特征尚不清楚,猪红细胞转移递呈IC的机制研究近乎空白,为了深入研究猪红细胞免疫粘附的分子学基础,本试验构建了CR1-like基因的酵母双杂交诱饵载体,并且对诱饵质粒进行了自激活和毒性检测,为利用酵母双杂交技术进一步研究CR1-like发挥免疫粘附功能的分子机理奠定基础。
1 材料
1.1 菌株、质粒及主要试剂 酵母菌株Y2HGold、诱饵载体pGBKT7、酵母培养基、X-α-Gal、金担子素(Aureobasidia A,Aba)、Yeast Marker Yeast Transformation system 2、Yeast Protein Extraction Reagent酵母总蛋白提取试剂盒,均购自TaKaRa公司;DH5α感受态细胞,购自北京天根生化科技有限公司;c-Myc单克隆抗体,购自生工生物工程(上海)股份有限公司;E.Z.N.A.TMPlasmid Mini Kit质粒提取试剂盒、E.Z.N.A.TMGel Extraction Kit胶回收试剂盒,均购自Omega公司;NcoI、BamH I限制性内切酶、T4 DNA Ligase连接酶、Kanamycin,均购自Solarbio公司。
2 方法
2.1 引物设计与合成 根据本实验室已经筛选出的CR1-like序列CCP36和CCP811片段,使用在线软件Prime Premier 5设计引物,在上游引物和下游引物分别增加限制性内切酶BamH I和NcoI位点。送往北京擎科生物技术有限公司合成。序列见表1。
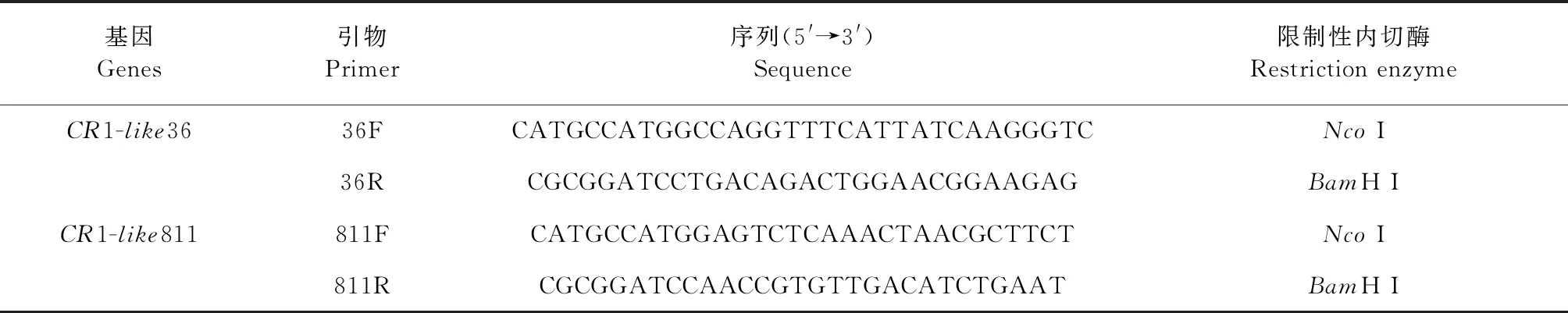
表1 本试验所用引物序列
2.2 基因的扩增 以本实验室构建保存的CCP36和CCP811质粒为模板,利用合成的特异性引物进行PCR扩增,PCR扩增体系为20 μL:Master Mix 10 μL,模板质粒1 μL,上、下游引物各0.8 μL,RNase Free H2O 7.4 μL。
PCR反应条件为:94 ℃预变性2 min;94 ℃变性30 s,CCP36 66.6 ℃退火1 min,40个循环;72 ℃终延伸10 min(CCP811退火温度为63.1 ℃)。将PCR产物使用1%琼脂糖凝胶电泳检测目的条带,电压75 V电泳60 min,凝胶成像系统采集图像,切下符合预期大小DNA片段进行胶回收和纯化,获得目的基因。
2.3 诱饵质粒pGBKT7-CR1-like36及pGBKT7-CR1-like811的构建 将电泳鉴定正确且纯化后的PCR产物与载体pGBKT7用NcoI和BamH I双酶切,建立20 μL双酶切体系:NcoI 1 μL,BamH I 1 μL,10×H Buffer 2 μL,PCR产物与载体pGBKT7各1 μg,ddH2O补齐至20 μL。37 ℃反应3 h。将反应液进行1%琼脂糖凝胶电泳,凝胶成像系统观察酶切是否成功,将符合预期大小的目的基因及载体片段进行胶回收和纯化,获得酶切后的CR1-like片段与载体pGBKT7。
酶切后进行连接,连接体系为10 μL:10×T4 DNA Ligase Buffer 1 μL,T4 DNA Ligase 1 μL,载体pGBKT7 1 μL,CR1-like片段7 μL。移液枪轻轻混匀后,4 ℃连接12 h,得到pGBKT7-CR1-like36和pGBKT7-CR1-like811重组质粒。
将连接后的重组质粒转化入DH5α感受态细胞,利用pGBKT7卡那霉素(Kana)抗性筛选阳性克隆。挑取单个阳性菌落接种于含有50 μg/mL Kana的LB液体培养基中,37 ℃培养过夜,按照E.Z.N.A.TMPlasmid Mini Kit I试剂盒说明书提取重组质粒。使用BamH I和NcoI对重组质粒进行双酶切,建立10 μL双酶切反应体系。37 ℃酶切反应3 h。1%的琼脂糖凝胶电泳鉴定重组质粒双酶切产物。将经过酶切鉴定正确的重组质粒送往美吉生物公司进行测序,将鉴定结果正确的重组质粒扩大培养并保存,以备后用。
2.4 诱饵质粒转化酵母菌Y2HGold 根据Clontech酵母手册,采用醋酸锂法制备感受态酵母菌Y2HGold。使用Clontech公司的Yeastmaker Yeast Transformation System 2试剂盒进行转化,分别将pGBKT7空载体和重组质粒pGBKT7-CR1-like36和pGBKT7-CR1-like811转化酵母感受态细胞。取200 μL菌液涂布于含有50 μg/mL Kana的SD/-Trp选择性培养基,倒置培养4 d,直至白色且大小均匀的克隆菌落出现。同时将pGBKT7-53+pGADT7-T阳性对照和pGBKT7-Lam+pGADT7-T阴性对照共转化酵母菌,将菌液涂布于SD/-Trp、SD/-Trp/X-a-Gal、SD/-Trp/X-α-Gal/Aba平板上共同培养。
2.5 融合蛋白在酵母菌中的表达 重组质粒转化到酵母菌后,挑取单菌落于5 mL SD/-Trp液体培养基中,30 ℃、250 r/min振荡培养24 h。按照Yeast Protein Extraction Reagent试剂盒说明书提取酵母总蛋白,进行Western Blot检测,使用一抗为c-Myc单克隆抗体。
2.6 诱饵质粒pGBKT7-CR1-like的毒性检测 转化pGBKT7-CR1-like和pGBKT7空质粒于 Y2HGold酵母感受态细胞后,分别挑取重组质粒转化子、空白质粒转化子于5 mL SD/-Trp中培养。30 ℃,24 h,250 r/min。各取100 μL菌液,以0.9% NaCl进行1∶10 000稀释,涂布于SD/-Trp固体培养基上,30 ℃培养4 d,观察菌落生长情况、对比菌落大小及菌落数量。
2.7 诱饵质粒pGBKT7-CR1-like的自激活检测 将包含pGBKT7-CR1-like的菌液1∶10 000稀释后涂布于SD/-Trp、SD/-Trp/X-a-Gal、SD/-Trp/X-α-Gal/Aba平板上,30 ℃培养4 d,观察菌落生长情况及菌落颜色变化。同时对比阳性组和阴性组菌落生长情况。判定标准:阳性组在SD/-Trp、SD/-Trp/X-a-Gal、SD/-Trp/X-α-Gal/Aba上均生长,且在SD/-Trp/X-a-Gal、SD/-Trp/X-α-Gal/Aba上菌落呈蓝色;阴性组在SD/-Trp、SD/-Trp/X-a-Gal上生长,菌落为白色,在SD/-Trp/X-α-Gal/Aba上不生长。
3 结果
3.1CCP36和CCP811基因扩增结果 以CCP36和CCP811质粒为载体,以36 F、36 R和811 F、811 R为引物进行扩增,CCP36的PCR产物经1%琼脂糖凝胶电泳后,可在500 bp处观察到清晰条带,符合预期结果518 bp;CCP811可在700 bp处观察到清晰条带,符合预期结果738 bp(图1)。
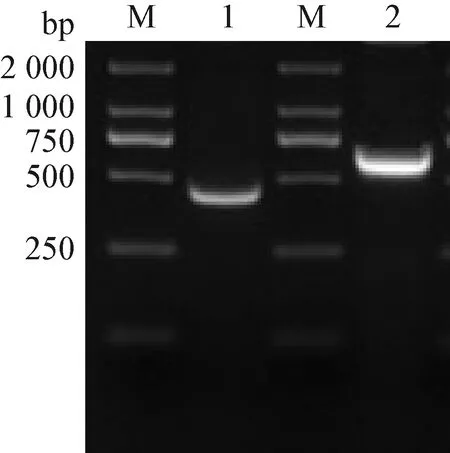
图1 CR1-like基因PCR扩增电泳图
3.2 重组质粒pGBKT7-CR1-like36和pGBKT7-CR1-like811酶切鉴定 将转入连接产物的DH5α阳性克隆进行培养,提取质粒,使用BamH I和NcoI对重组质粒进行酶切,如图2得到518 bp和738 bp左右的条带,与预期插入条带一致,公司测序结果表明插入片段正确。
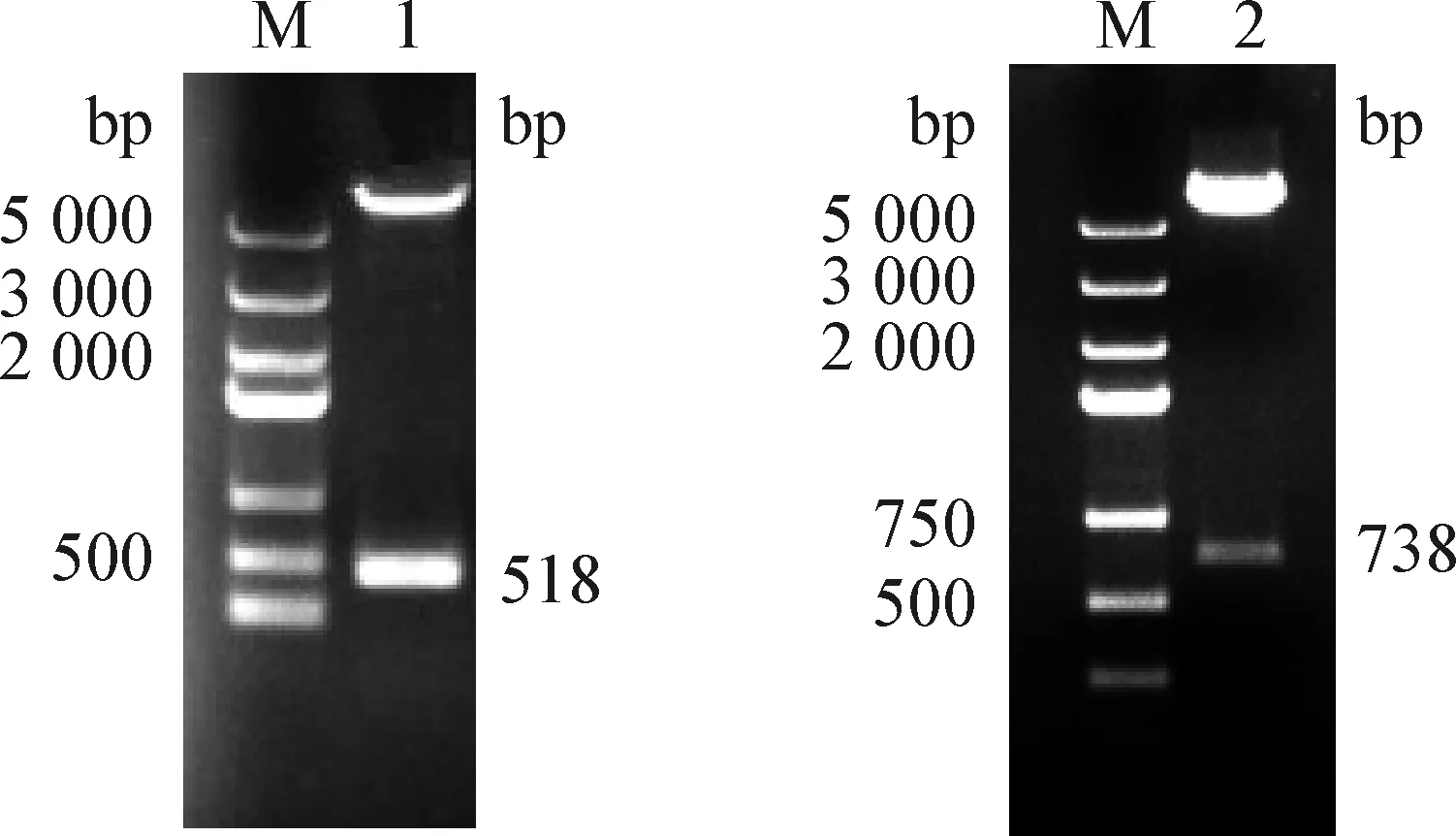
图2 重组质粒pGBKT7-CR1-like36和pGBKT7-CR1-like811的双酶切鉴定
3.3 融合蛋白的表达结果 发光液显色后,在50kDa和64kDa之间出现清晰条带。重组质粒pGBKT7-CR1-like36和pGBKT7-CR1-like811在酵母细胞中成功表达蛋白。
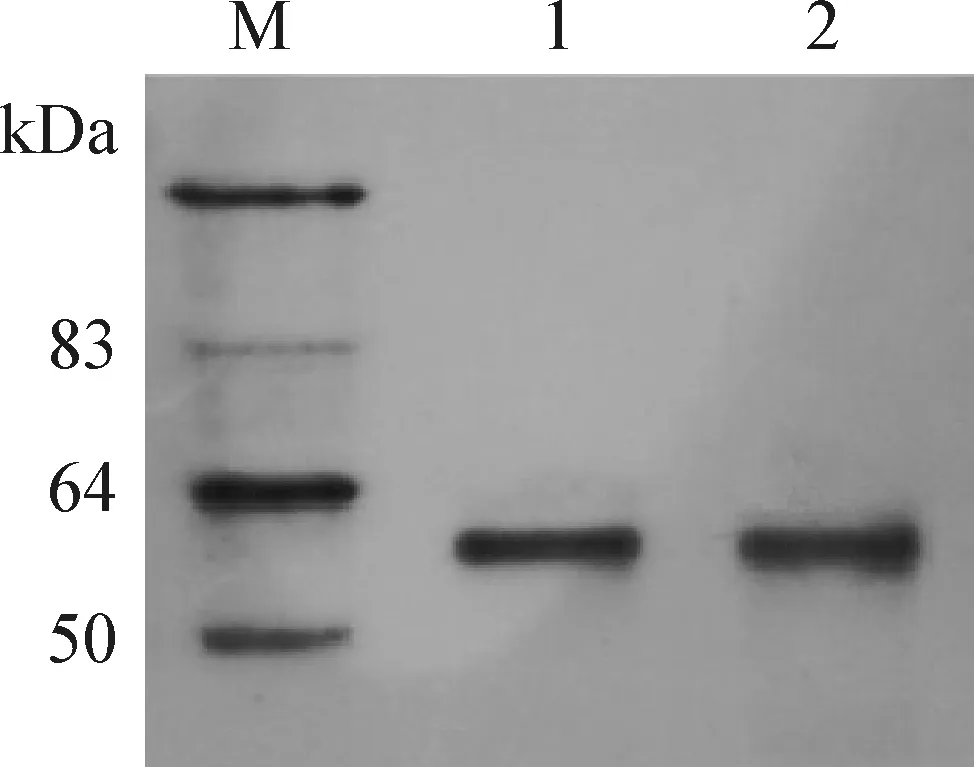
图3 融合蛋白的Western Blot检测
3.4 诱饵质粒的毒性检验 将pGBKT7-CR1-Like36、pGBKT7-CR1-like811和pGBKT7分别转化Y2HGold酵母感受态后,分别涂布于SD/-Trp营养缺陷型平板上,30 ℃培养4 d,结果显示,重组质粒和空质粒菌落大小和菌落数量无明显差异(图4),该pGBKT7-CR1-Like36和pGBKT7-CR1-like811诱饵质粒不影响酵母细胞的生长,对Y2HGold酵母细胞无毒性作用。
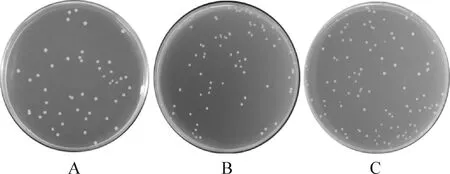
图4 诱饵质粒的毒性检测
3.5 诱饵质粒的自激活检测 将pGBKT7-CR1-Like36、pGBKT7-CR1-Like811转化Y2HGold酵母感受态后,分别涂布于SD/-Trp、SD/-Trp/X-α-Gal、SD/-Trp/X-α-Gal/Aba营养缺陷型平板,在SD/-Trp平板上长出白色菌落(图5A和5D),在SD/-Trp/X-α-Gal平板上菌落不变蓝(图5B和5E),在SD/-Trp/X-α-Gal/Aba营养缺陷型平板上无菌落长出(图5C和5F)。说明诱饵质粒pGBKT7-CR1-Like36和pGBKT7-CR1-Like811表达的蛋白不具有自激活性,所构建重组质粒可用于后续试验。

图5 诱饵质粒的自激活检测
如封二彩版图6所示,阳性对照组在3个培养基上均生长,且在SD/-Trp/X-α-Gal、SD/-Trp/X-α-Gal/Aba培养基上菌落呈蓝色(封二彩版图6B和6C);阴性组只在SD/-Trp、SD/-Trp/X-α-Gal上生长,在SD/-Trp/X-α-Gal/Aba上不生长(封二彩版图6F)。
4 讨论
红细胞免疫粘附功能的变化与机体疾病的发生、发展、转归及其免疫状态有高度的相关性[9]。研究证实,在阿尔茨海默氏疾病[10]、自身免疫性疾病[11]和炎症[12]等疾病中CR1均发挥着重要作用。CR1是补体C3b、C4b的主要补体受体,表达于多种细胞表面,是一种多态性膜糖蛋白。CR1也是补体活化的调节剂,可以辅助因子I将C3b降解使其失去致炎性,抑制补体的过度活化[13]。红细胞CR1介导的免疫粘附功能对评价机体天然免疫功能状态具有十分重要的意义。在畜牧兽医临床应用中,监测动物红细胞的免疫功能对判定动物健康状态、疾病的发生、治疗效果、转归等方面具有重要的诊断应用价值。在疾病防控方面,可以通过调控猪红细胞免疫粘附的靶点提高机体红细胞免疫功能,增强猪对繁殖与呼吸综合征(PRRS)、圆环病毒病(PCVD)等免疫抑制性疾病的抗病能力。然而在前期的研究中,尚未对猪发挥免疫粘附功能的分子基础进行研究,为了进一步了解猪红细胞免疫粘附的分子机制,本试验利用酵母双杂交技术构建了猪CR1-like蛋白酵母双杂交诱饵质粒,检测其毒性作用和自激活作用,鉴定是否符合酵母双杂交系统的要求。
酵母双杂交技术是检测蛋白质与蛋白质间相互作用的一种有效的分子生物学方法,由Fields和Song等在1989年提出[14],是基于对酵母转录因子GAL4性质的研究。试验中为了避免结果的假阳性,对酵母双杂交诱饵载体进行自激活检测,确保其自身不会激活转录因子。并且检测了重组质粒表达的融合蛋白是否对酵母细胞有毒性而影响蛋白间的相互作用造成假阴性结果。本试验利用酵母双杂交技术,构建了猪CR1-like蛋白的酵母双杂交诱饵载体pGBKT7-CR1-Like36和pGBKT7-CR1-Like811,利用pGBKT7载体自身能合成色氨酸的特点进行筛选,结果诱饵载体转入酵母菌后在缺乏Trp的培养基上生长出白色菌落,说明重组质粒已成功转入酵母细胞。并且通过提取酵母总蛋白,检测到融合蛋白在酵母细胞中的表达。对比转染空质粒的酵母菌落,含有重组质粒的酵母菌落生长大小无差别,菌落数量相近,说明融合蛋白对酵母细胞无毒性作用,不影响酵母菌的正常生长。酵母转录因子GAL4激活后,报告因子之一的α-半乳糖苷酶被酵母细胞表达分泌,在显色底物X-a-Gal的存在下表现为蓝色,激活后的酵母细胞同时也表达报告因子AUR1-C,表现出强的抗Aba性。含有重组质粒的酵母菌落在含有X-α-Gal的培养基上生长未变蓝,在添加Aba的培养基中无菌落生长,说明融合蛋白不会单独激活酵母细胞的转录启动子,所构建的质粒无自激活性。综上所述,本试验构建的诱饵载体pGBKT7-CR1-like36和pGBKT7-CR1-like811对Y2HGold酵母细胞无毒性作用,也无自激活现象,符合酵母双杂交系统的要求,为进一步研究猪红细胞的免疫功能及其分子机理奠定了基础。

