DNA甲基化抑制剂对盐胁迫下小麦部分生理及农艺性状的影响
李有芳,靖建国,张静悟,李卫华
(石河子大学农学院/新疆生产建设兵团绿洲生态农业重点实验室,新疆石河子 832000)
土壤盐渍化是影响作物产量和品质的重要因素之一[1]。盐胁迫诱导植物细胞膜产生渗透胁迫,导致活性氧大量积累,影响植物生长过程中的正常代谢,最终抑制植物生长[2]。DNA甲基化是植物中普遍存在的一种表观遗传方式,利用DNA甲基转移酶将S-腺苷-甲硫氨酸(S-daomet,SAM)的甲基基团转移到胞嘧啶(C)或胸腺嘧啶(T)上[3],在DNA序列不改变的情况下调控植物基因表达,调节植物生长发育。在生物胁迫和非生物胁迫下,植物通过甲基化状态的改变来调节抗逆有关基因的表达,进而影响表型和适应性的改变[4]。
5-氮杂胞苷(5-azaC)是一种DNA甲基化抑制剂,能够与DNA甲基转移酶相结合,降低DNA甲基化水平[5-7]。5-azaC处理使未春化的拟南芥植株相比对照提前开花,而对春化作用不敏感的晚开花突变体植株无影响[8]。干旱胁迫下水稻通过降低叶和根甲基化水平,激活相关基因表达,进而提高水稻耐旱性[9]。在盐胁迫条件下棉花通过诱导抗逆相关基因编码区去甲基化,调控基因的表达,从而有利于植株耐盐[10]。高温条件下,5-azaC可以降低白菜幼苗MDA含量,提高POD活性和蛋白质含量[11]。上述研究结果说明,在胁迫条件下,DNA甲基化具有调节植物胁迫响应基因的表达和生长发育的作用[12]。目前的研究多集中于盐胁迫对小麦生理特性及相关基因表达的影响,而有关DNA甲基化水平的降低对盐胁迫下小麦耐盐性影响的探讨还鲜有报道。本试验选用耐盐性不同的春小麦品种新春6号和新春11号为材料,研究盐胁迫条件下DNA甲基化抑制剂处理对小麦部分生理和农艺性状的影响,以了解DNA甲基化的改变与小麦抵抗盐胁迫能力的相关性。
1 材料与方法
1.1 试验材料
本试验选用耐盐性不同的春小麦(TriticumaestivumL.)品种新春11号(高耐盐)、新春6号(盐敏感)为供试材料[13],种子由新疆石河子大学麦类作物研究所提供。
1.2 小麦幼苗培养及处理
选取饱满的小麦种子,在自来水下冲洗干净,经75%酒精消毒2 min,用5%次氯酸钠消毒15 min,再用无菌水冲洗干净。将消毒后的小麦种子在蒸馏水中浸泡数小时,待其有白色小芽露头时移入铺有两层滤纸的发芽盒中(发芽盒已消毒),置于光照培养箱中培养。培养条件:温度 25 ℃,湿度50%,光暗比16 h/8 h。试验共设5个处理(CK:清水对照;T0:0 μmol·L-15-azaC +200 mmol·L-1NaCl;T1:50 μmol·L-15-azaC +200 mmol·L-1NaCl;T2:150 μmol·L-15-azaC +200 mmol·L-1NaCl;T3:300 μmol·L-15-azaC +200 mmol·L-1NaCl),每个处理3次重复。
DNA甲基化抑制剂添加:处理期间,每次向发芽盒中滴加相应浓度的5-azaC溶液15 mL,对照组滴加相应的清水,每隔1 d处理1次,处理 7 d后结束。
盐胁迫:选取DNA甲基化抑制剂处理后长势一致的幼苗移栽至花盆(30 cm×20 cm)中,营养土与蛭石3∶1混合,每盆15株,每个处理3次重复。待幼苗长至三叶一心时,用200 mmol·L-1NaCl进行盐胁迫,用清水做对照(CK),处理7 d后进行各项生理指标的测定。
1.3 小麦农艺性状测定
成熟时,不同处理随机选取15株小麦,测定株高及主茎穗长、穗粒数和穗粒重。
1.4 小麦气体交换参数测定
盐胁迫处理7 d后,选取小麦倒二叶即第5片叶,采用Li-6400型便携式光合仪测定各处理小麦叶片净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr) 和胞间CO2浓度(Ci)。便携式光合测定系统叶室光照强度设定为1 000 μmol·m-2·s-1,CO2参比浓度为400 μmol·mol-1,温度为25 ℃。每个处理设三次重复,每个重复测定三 片叶。
1.5 小麦生理指标测定
取处理后的小麦叶片,采用硫代巴比妥酸法测定丙二醛(MDA)含量[14]。可溶性糖含量测定采用蒽酮比色法;脯氨酸含量的测定采用酸性茚三酮法,利用南京建成生物工程研究所试剂盒进行测定。SOD活性测定采用羟胺法;CAT和POD活性测定采用可见光法,三种抗氧化酶活性具体参照南京建成生物工程研究所试剂盒说明书进行测定。各项生理指标均测定三次。
1.6 数据分析
用SPSS 19.0进行数据统计分析,采用LSD法进行处理间差异显著性分析,用Excel 2010进行图表的制作。
2 结果与分析
2.1 DNA甲基化抑制剂对盐胁迫下小麦农艺性状的影响
与CK相比,盐胁迫(T0)导致新春6号的株高显著降低,对新春11号影响不显著(表1),说明盐胁迫对盐敏感品种新春6号植株有明显的致矮作用。与T0处理相比,新春6号株高在T1、T2、T3处理下均显著下降,降幅分别为8.01%、10.66%、11.93%;新春11号株高在T2、T3处理下显著下降,降幅分别为10.27%、7.38%,说明盐胁迫下DNA去甲基化对小麦株高表现出一定的抑制作用。与CK相比,盐胁迫后两个品种的穗长、穗粒数、穗粒重均显著降低;DNA甲基化抑制剂和盐胁迫共同处理与单独盐胁迫相比差异较小,基本上均不显著。这表明盐胁迫会抑制盐敏感小麦品种生长,降低穗长、穗粒数和穗粒重。DNA去甲基化也会造成小麦植株矮化,但对产量性状影响不大。
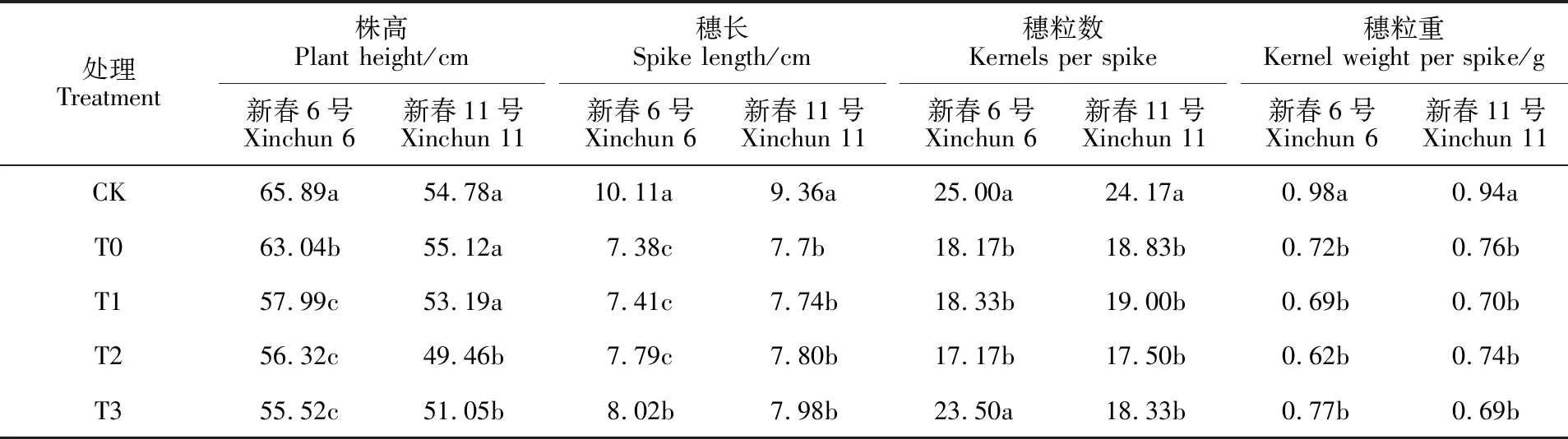
表1 DNA甲基化抑制剂对盐胁迫下小麦农艺性状的影响Table 1 Effect of 5-azaC on wheat agronomic traits of two wheat varieties
2.2 DNA甲基化抑制剂对盐胁迫下小麦叶片气体交换参数的影响
与CK相比,盐胁迫对两个品种的Tr均产生明显的抑制作用,对Pn、Gs和Ci影响均不显著(表2)。盐胁迫下,新春11号的Pn值随着DNA甲基化抑制剂浓度的升高呈降低趋势,其中T2、T3处理与T0处理均差异显著,降幅分别为22.12%、27.88%,而DNA甲基化抑制剂对新春6号的Pn影响不显著。盐胁迫下DNA甲基化抑制剂处理与T0处理相比显著降低了新春6号的Tr,但提高了新春11号的Tr,其中T2和T3处理与T0处理差异达到显著水平;新春6号T2和T3处理的Gs和Ci较T0处理均显著提高,而DNA甲基化抑制剂处理对新春11号的Gs和Ci影响均不显著。以上结果说明,盐胁迫下DNA去甲基化会对小麦光合能力产生抑制作用,减弱盐敏感品种新春6号气孔的气体交换,但对耐盐品种新春11号气孔的气体交换影响不大。
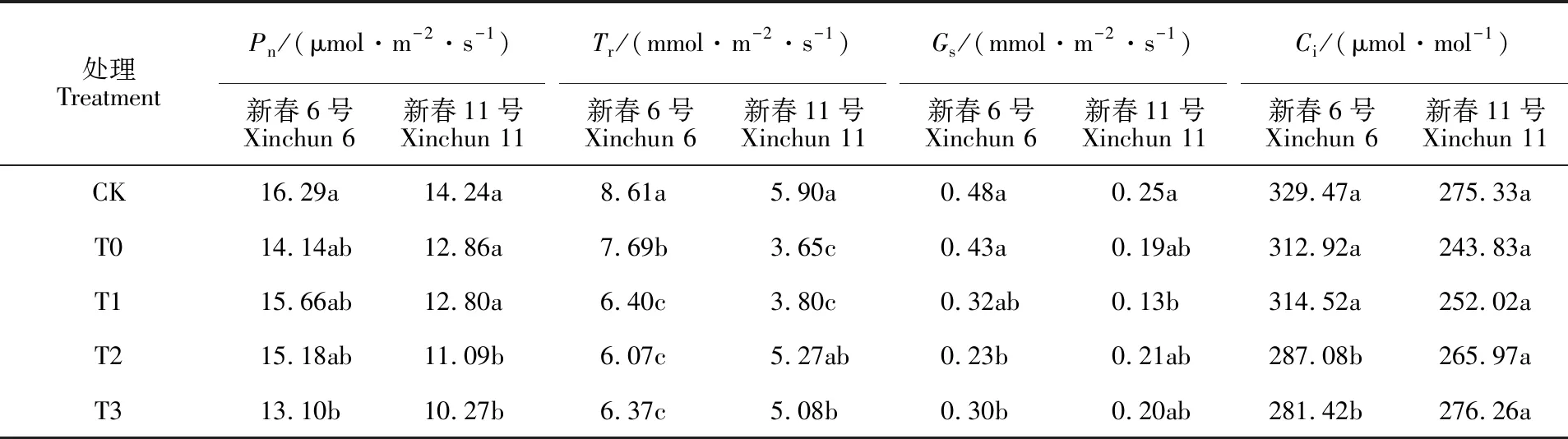
表2 DNA甲基化抑制剂对盐胁迫下小麦叶片气体交换参数的影响Table 2 Effect of DNA methylation inhibitor on gas exchange parameters of wheat leaves under salt stress
2.3 DNA甲基化抑制剂对盐胁迫下小麦叶片MDA含量的影响
与CK相比,盐胁迫后新春6号、新春11号叶片MDA含量分别上升37.02%、30.67%,差异均显著(表3),说明盐胁迫对小麦产生过氧化伤害,且对新春6号损伤程度较大。盐胁迫下新春6号叶片T1处理的MDA含量较T0处理显著降低,降幅31.06%,与正常水平(CK)相当,但T2和T3处理与T0处理差异不显著;新春11号则表现相反,T2、T3处理与T0处理相比显著降低,降幅分别为29.59%、48.47%,T1处理变化不显著。由此可见,DNA去甲基化减弱盐胁迫对小麦膜脂过氧化伤害的效果因DNA甲基化抑制剂浓度和小麦耐盐性而不同,低浓度DNA甲基化抑制剂对盐敏感品种有利,高浓度DNA甲基化抑制剂对耐盐品种有利。
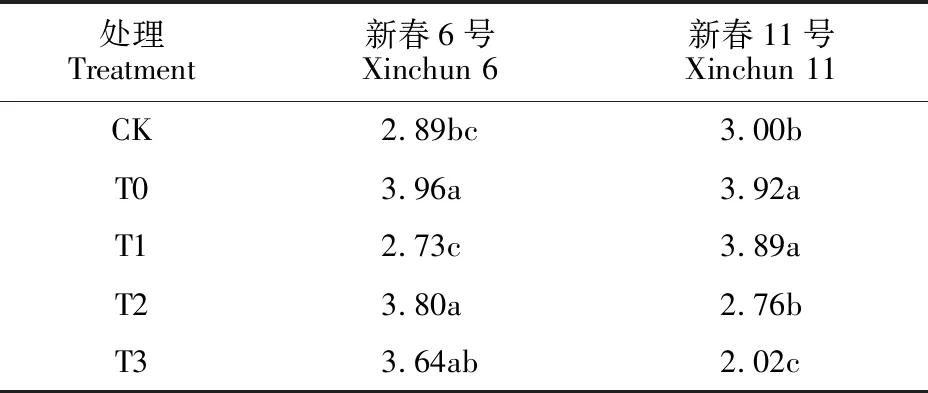
表3 DNA甲基化抑制剂对盐胁迫下小麦叶片MDA含量的影响
2.4 DNA甲基化抑制剂对盐胁迫下小麦叶片脯氨酸含量和可溶性糖含量的影响
与CK相比,盐胁迫后小麦叶片脯氨酸和可溶性糖含量变化均不显著(表4)。盐胁迫下DNA甲基化抑制剂处理的新春6号脯氨酸含量有所上升,其中T2、T3处理与T0处理差异显著;DNA甲基化抑制剂处理的新春11号脯氨酸含量及两品种可溶性糖含量均与T0处理差异不明显。这说明盐胁迫条件下,DNA去甲基化可促进盐敏感品种新春6号脯氨酸积累,对可溶性糖影响不大,而对耐盐品种新春11号脯氨酸和可溶性糖含量影响较小。
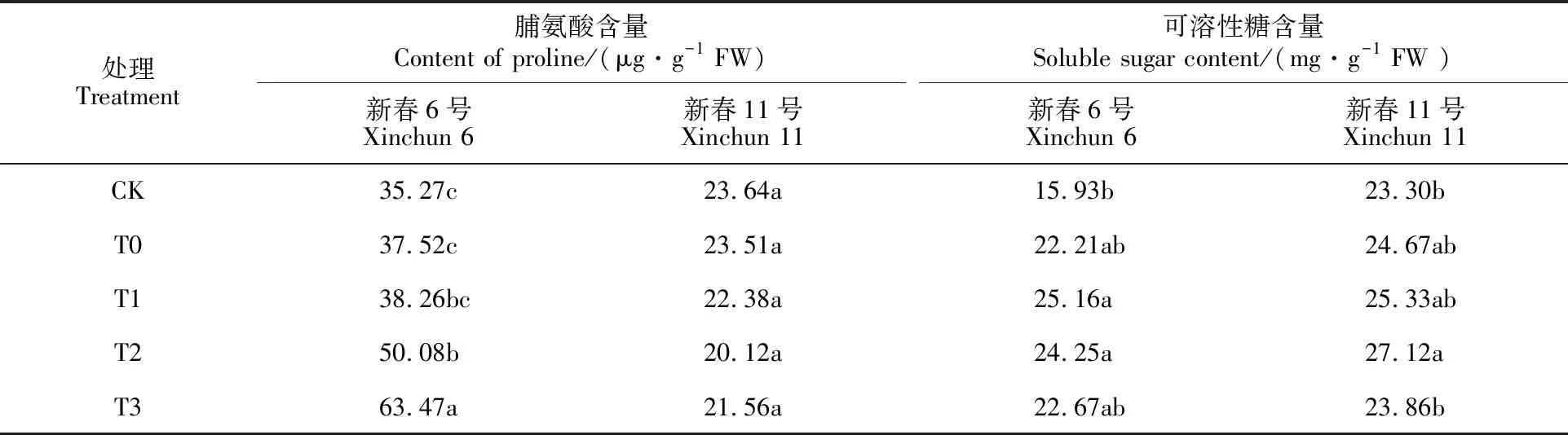
表4 DNA甲基化抑制剂对盐胁迫下小麦叶片脯氨酸和可溶性糖含量的影响Table 4 Effect of DNA methylation inhibitor on proline and soluble sugar content in wheat leaves under salt stress
2.5 DNA甲基化抑制剂对盐胁迫下小麦幼苗抗氧化酶活性的影响
盐胁迫导致新春11号POD活性显著下降,对其SOD和CAT活性及新春6号的三种酶活性影响均不明显(表5)。盐胁迫下DNA甲基化抑制剂处理显著增强了新春11号的POD活性,T1、T2、T3处理较T0处理分别提高7.54%、13.94%、9.73%,与CK水平相当,而对SOD、CAT活性影响较小;DNA甲基化抑制剂处理可显著增加新春6号的SOD、CAT活性,而降低POD活性。以上结果说明,DNA去甲基化对盐胁迫下小麦叶片抗氧化酶活性的影响因品种而异。
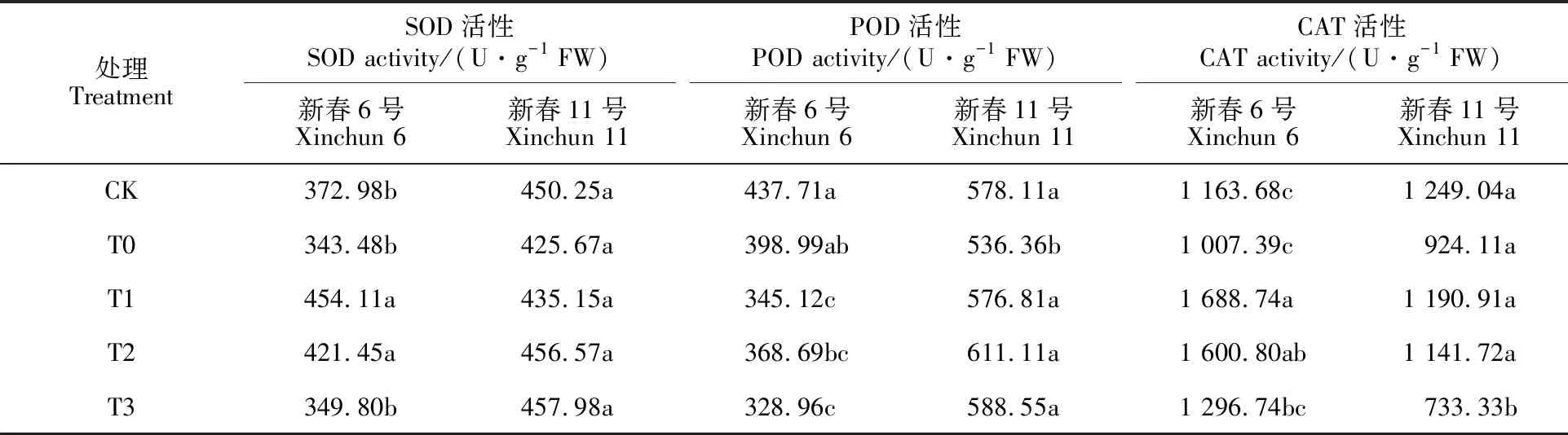
表5 DNA甲基化抑制剂对盐胁迫下小麦叶片抗氧化酶活性的影响Table 5 Effect of DNA methylation inhibitor on antioxidant enzyme activities in wheat leaves under salt stress
3 讨 论
植物在遭受盐胁迫逆境时,产生渗透、氧化等胁迫反应,对植物生长产生抑制作用[15]。逆境条件下,DNA甲基化能够调节植物抗逆相关基因的表达和生长发育的能力。5-azaC是一种DNA甲基化抑制剂,其诱导DNA甲基化变化,可增强植物对非生物胁迫的抗性。
研究发现,盐胁迫下不同小麦品种的株高、穗长、分蘖数等都不同程度地降低[16]。King[17]和Sano等[18]用5-azaC处理甘蓝幼苗和水稻种子,发现其生长发育表现出许多异常,如植株矮化和叶片变小。本研究表明,小麦的生长发育在盐胁迫下受到明显抑制,株高、穗长、穗粒数和穗粒重均显著降低。DNA甲基化抑制剂处理后小麦株高相比单独盐胁迫处理显著下降,造成植株矮化,这与前人的研究结果是一致的。Farquhar等[19]认为,造成小麦光合作用变化的原因主要有两方面:(1)气孔导度下降,导致CO2供应不足;(2)同化CO2能力下降,胞间CO2浓度升高。本试验结果表明,盐胁迫下小麦净光合速率下降,同时气孔导度和胞间CO2浓度明显降低,说明光合速率的降低是因为气孔因素限制而导致的。盐胁迫导致膜脂过氧化促使丙二醛(MDA)积累,对小麦造成伤害[20]。本研究中,盐胁迫下DNA甲基化抑制剂处理后,小麦叶片MDA含量显著降低,低浓度抑制剂可显著降低新春6号叶片MDA含量,高浓度抑制剂可显著降低新春11号叶片MDA含量,可见耐盐性不同的小麦品种对DNA甲基化抑制剂浓度表现出不同的敏感性。
逆境条件下,脯氨酸、可溶性糖等渗透调节物质显著积累,以调节细胞渗透压,增强植物适应逆境的能力[21]。本研究表明,DNA去甲基化处理可提高盐胁迫下小麦叶片脯氨酸含量和可溶性糖含量,耐盐性强的小麦品种新春11号变化幅度较小,耐盐性弱的小麦品种新春6号变化幅度较大,这与Guzel等[22]的研究结果是一致的。盐胁迫下小麦体内活性氧积累,导致细胞膜膜脂过氧化,植物通过增强体内抗氧化酶活性来减轻逆境胁迫造成的伤害。许会会等[11]研究发现,5-azaC处理可显著增强热胁迫下白菜幼苗POD、SOD活性。本研究中,DNA去甲基化处理提高了盐胁迫下小麦叶片抗氧化酶的活性。盐胁迫条件下5-azaC处理对SOD和CAT活性的影响表现为在盐敏感品种中明显上升,耐盐品种中明显下降,而POD活性则表现为在盐敏感品种中明显下降,而在耐盐品种中明显上升。这也说明耐盐性不同的小麦通过提高不同的抗氧化酶活性来提高小麦幼苗的抗盐性,这与前人研究结果相似[23]。
综上所述,DNA去甲基化可对植株造成矮化,增强盐胁迫条件下小麦的抗氧化能力,降低膜脂过氧化程度,增强其抗逆能力,耐盐性不同的小麦品种对DNA去甲基化抑制剂敏感性不同。推测DNA甲基化参与调节小麦抗盐性基因表达,从而调控小麦植株的耐盐能力。

