云南铁壳麦的穗发芽抗性鉴定与分析
周国雁,陈 丹,隆文杰,武晓阳,蔡 青,伍少云
(云南省农业科学院生物技术与种质资源研究所/云南省农业生物技术重点实验室/农业农村部西南作物基因资源与种质创制重点实验室,云南昆明 650205)
小麦穗发芽(pre-harvest sprout,PHS)是指小麦在成熟收获前遭遇连续阴雨或潮湿环境,其籽粒在穗上发芽[1-2]的自然灾害现象。这种现象使小麦严重减产、加工品质下降、种用价值尽失[3],是全世界小麦生产与育种研究都需要重视和解决的问题。影响小麦穗发芽抗性的因素很多,如种子休眠特性[4-6],种皮渗透性和颜色,α-淀粉酶活性和内源激素水平[7],穗的形态与结构学特征及功能,包壳的机械隔水或持水功能及其可能存在的发芽诱发或抑制物质[8]等。
鉴定小麦穗发芽抗性的方法有田间延期收获法、穗发芽试验、种子发芽试验、酶活性测定及分子标记辅助选择等。其中,整穗发芽法能从穗部形状、种子休眠、刺激诱发或抑制物质等方面直观、准确地反映不同品种的穗抗发芽性[9]。种子发芽法虽然操作简便易行,但其结果只是反映了籽粒的休眠特性,不能真实代表穗发芽抗性[10]。随着分子生物学的不断发展和进步,分子标记技术也被用于小麦的穗发芽抗性鉴定。杨 燕等[11]根据玉米控制籽粒休眠相关的转录子 Vp1开发了用于鉴定小麦种子休眠性的STS功能标记Vp1B3,并被利用和验证[12-14]。ZHANG等[15]研发并验证了CAPS功能标记sdr-5,发现Tasdr-B1基因既与穗发芽抗性相关又与种子休眠性相关。王根平等[16]利用Tamyb10基因的分子标记,检测了119 份来自不同麦区的红粒小麦材料,发现Tamyb10D1基因对穗发芽抗性的影响最大,与红粒品种的高穗发芽抗性相关。王 瑜等[17]利用与穗发芽抗性相关的STS标记Tamyb10D和Vp1B3及CAPS 标记TaDFR-B对2 套(78和103 份)白粒小麦材料的穗发芽抗性进行综合筛选,发现标记Tamyb10D能有效地鉴别白粒小麦品种的穗发芽抗性。STS标记Vp1A3与Vp1B3一样,也是根据白粒小麦休眠基因viviparous-1在穗发芽抗性不同的小麦材料中的序列差异而设计的与白粒小麦穗发芽抗性相关的分子标记,表现出了高效的筛选效果[11-12,18]。
云南铁壳麦是云南小麦(T.aestivumssp.yunnanense,AABBDD)的俗称,隶属于普通小麦种下的中国西南地区的稀有亚种。曾经只分布在云南省怒江、澜沧江两岸的部分县、区[19]。常被种植于海拔1 500~2 500 m、年均温度15 ℃和年降雨量1 480 mm左右的山区、半山区的林间空地、箐沟边、坡耕山地之中,对当地的特殊农业生态系统有着独特的适应性,是小麦新品种选育的重要基因资源,也是探讨栽培六倍体小麦起源与演化的桥梁种质资源。其成熟期正是当地的雨季,具有强穗发芽抗性[19]。有关云南铁壳麦的穗发芽抗性或种子休眠性的研究很少有报道。杨金华等[20]鉴定了32份云南铁壳麦的穗发芽抗性和种子休眠性,认为其穗发芽抗性主要来源于种子的强休眠性、颖壳的机械作用和浸出物的抑制作用。本研究拟以推广良种云麦53号为对照,利用整穗和整粒发芽法、分子功能标记法综合鉴定、评价55份云南铁壳麦的穗发芽抗性及种子的休眠特性,分析不同抗性级别、不同休眠级别、不同基因型材料在种子发芽指数、发芽率方面的差异,探讨其穗发芽抗性、种子休眠性的机制,为进一步保护和利用这种珍稀小麦种质资源、筛选高抗穗发芽的材料提供参考依据。
1 材料与方法
1.1 材料
参试材料共56份,其中55份为云南铁壳麦,另1份为对照品种云麦53号(表2),由云南省作物种质库保存和提供。全部材料于2018年10月下旬种植在云南省农业科学院位于昆明市嵩明县小街镇的试验基地(25°21′23″N,103°06′39″E)。2019年5月中旬蜡熟时收获。田间常规管理,生长期间不曾遭遇雨、雪、霜冻等自然灾害。但在苗期遭遇暖冬,4至5月抽穗、开花和灌浆及成熟期遭遇高温、干旱影响。嵩明县2019年4月17日至5月20的日最高气温达31 ℃,4、5月的月均最高温为26 ℃和27 ℃,较2018年同期温度升高 3 ℃和4 ℃。
1.2 方 法
1.2.1 整穗发芽率(SGR)的测定
整穗发芽率测定参照刘光辉等[14]的方法并作适当修改。随机选取成熟度基本一致的6个单株的主穗,于蜡熟期收获,10 d后,分别带茎扎成束,称重;浸泡在盛有自来水的塑料箱中,为阻止麦穗上浮,用另一较小的塑料箱装水压顶;6 h后捞出麦穗,用吸水纸吸干麦穗表面水分,复称重,计算麦穗的持水率(HWR),用此评价参试材料麦壳的隔水作用。HWR=(麦穗吸水后重量-吸水前重量)/吸水前重量×100%。将复称重后的麦穗垂直插于装有沙土的塑料箱中,置于温度25 ℃和相对湿度 85%的人工气候箱(DRXM-508C-4,宁波江南仪器厂)内暗发芽。每天向穗顶部喷淋水以保持湿度。7 d后,取出麦穗并立即于65 ℃烘箱中烘干24 h,阻止其进一步发芽。手工剥出籽粒,以见芽或根者为发芽,记录发芽的种子数,计算整穗发芽率(SGR)。SGR=6穗的发芽粒数/6穗的总粒数×100%。
1.2.2 发芽指数(GI)和发芽率(GP)的测定
选取同期收获的麦穗,手工剥出籽粒,将其腹沟朝下置于垫有滤纸的培养皿内,加适量无离子水,与1.2.1相同条件下发芽。每份材料重复3次,每次50粒。从试验2 d开始,以芽长达到种子长度一半为发芽,统计发芽的籽粒数,直到发芽试验结束止。计算发芽指数(GI)=(n1×7+n2×6…n7×1)/(7×50)×100%,发芽率(GP)=7天发芽的种子数/50×100%。式中n1、n2、…、n7是第1、第2、…、至第7天发芽的籽粒数,50表示用于发芽的种子总数。
1.2.3 穗发芽抗性及种子休眠性的分级
穗发芽抗性分级:以穗发芽率为分级指标时,参照NY/T 1739-2009的小麦抗穗发芽性检测方法,以相对发芽率I(供试材料的穗发芽率/对照品种的穗发芽率)将参试材料的穗发芽抗性分为5级,即高抗(I≤0.05)、抗(0.05
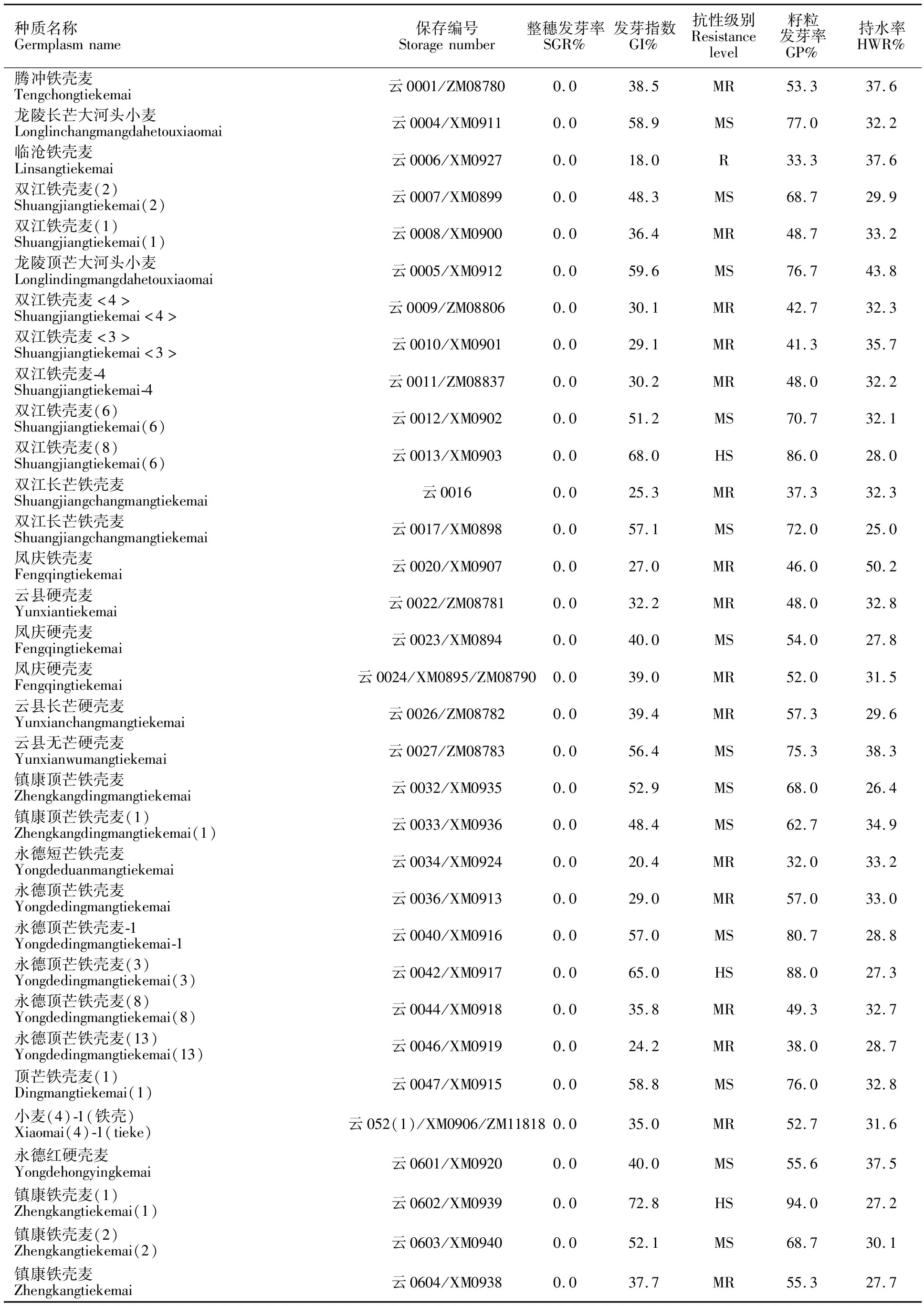
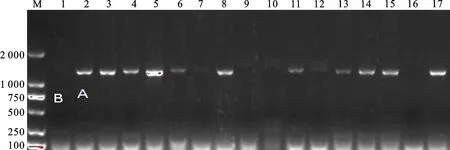
种子休眠性分级:以籽粒发芽率为依据,参照白宇浩等[13]划分小麦穗发芽抗性的4级标准并作适当调整,将参试材料的种子休眠性划分为5级,即深休眠(GP≤10%)、休眠(10% 1.2.4 试验材料DNA的提取及其PCR扩增 取1.2.2中生长7 d的新鲜嫩苗,采用改进的 CTAB 法提取其基因组DNA[22]。 5个功能标记Vp1B3、Tasdr-B1、Tamyb10D1、Tamyb10D和Vp1A3(表2)的PCR 扩增体系为20 μL,包括2× Master Mix 10 μL,上下游引物各0.4 μL(10 μmol·L-1),模板 1.5 μL(25 ng·μL-1),ddH2O 7.7 μL。所用试剂均购于擎科生物技术有限公司。PCR扩增程序为:95 ℃ 3 min;94 ℃ 50 s,53~66 ℃退火45~50 s,72 ℃1 min,35个循环;72 ℃3 min。其中,Vp1B3和Tasdr-B1退火 45 s,Tamyb10D1、Tamyb10D和Vp1A3退火50 s。PCR扩增产物用1%的琼脂糖凝胶电泳检测。 利用SPSS Statistics 19进行方差分析及t测验。 以整穗发芽率(SGR)为评价指标,除凤庆硬壳麦(云0624/XM0909)的SGR为2.0%外,其余54份参试云南铁壳麦的SGR都为0,对照云麦53号的 SGR为76.2%(表2和图1),云南铁壳麦的SGR明显低于对照品种。按NY/T 1739-2009的5级分级标准,参试云南铁壳麦的穗发芽抗性均为高抗。 表1 试验选用的5个标记 图1 对照云麦53(左)和云南铁壳麦(右)的穗发芽对比 55份云南铁壳麦的GI值在15.5%~72.8%之间,平均为40.8%,较对照品种云麦53号(65.7%)低约25.0%(表2)。按张维军等[21]的5级分级法,检测到抗穗发芽材料(临沧铁壳麦-云0006/XM0927等)5份、中抗材料(腾冲铁壳麦-云0001/ZM08780等)23份、中感材料(龙陵长芒大河头小麦-云0004/XM0911等)22份、高感材料(双江铁壳麦(8)-云0013/XM0903等)5份,分别占参试铁壳麦材料数的9.1%、41.8%、40.0%和9.1%。对照云麦53号表现为高感穗发芽。抗、中抗、中感、高感材料的GI分别为15.5%~ 18.7%、20.4%~39.4%、40%~59.6%和 60.3%~72.8%,平均值分别为17.7%、31.6%、50.3%和66.4%。4个级别材料的GI差异极显著(P<0.01)。 从表2可知,55份云南铁壳麦的籽粒发芽率(GP)在23.2%~94.0%之间,均值为57.3%,明显低于对照云麦53号(92.0%)。参试云南铁壳麦中无深休眠的材料,休眠材料有耿马铁壳麦(云0614/XM0933)、云县硬壳麦(云0622/XM0897)和凤庆硬壳麦(云0623/XM0908)共3份;中度休眠的有腾冲铁壳麦(云0001/ZM08780)、临沧铁壳麦(云0006/XM0927)、双江铁壳麦(1)(云0008/XM0900)等29份;浅休眠有龙陵长芒大河头小麦(云0004/XM0911)、双江铁壳麦(2)(云0007/XM0899)、龙陵项芒大河头小麦(云0005/XM0912)等18份;无休眠的有双江铁壳麦(8)(云0013/XM0903)、永德项芒铁壳麦-1(云0040/XM0916)和永德项芒铁壳麦(3)(云0042/XM0917)等5份材料,各自的GP为 23.3%~27.3%、32.0%~57.3%、60.7%~77.0%和 80.7%~94.0%,均值分别为25.3%、47.8%、70.1%和87.2%。四个休眠级别参试材料的平均发芽率间存在极显著差异(P<0.01)。 表2 参试材料的发芽率与穗发芽抗性 由表2可知,对照云麦53号的整穗和籽粒发芽率为76.2%和92.0%,麦穗持水率为33.1%。云南铁壳麦的整穗发芽率为0.0~2.0%,籽粒发芽率为23.2%~94.0%,麦穗持水率在23.6%~50.2%之间,平均为32.6%,与对照的麦穗持水率接近。其中,麦穗持水率在30.0%以下的材料21份,占参试铁壳麦的38.2%,在30.0%以上的材料34份,占参试铁壳麦的61.8%。说明大多数云南铁壳麦的颖壳并未阻止其籽粒或种子对水分的吸收,造成整穗与籽粒发芽率巨大差异的原因可能是其颖壳中存在发芽抑制物。推测云南铁壳麦的高抗穗发芽能力可能主要与其颖壳内的发芽抑制物质有关。 为探讨云南铁壳麦抗穗发芽特性的分子基础,选用被广泛应用的Vp1B3等5个STS标记对参试材料进行检测。 标记Vp1B3可在53份云南铁壳麦和对照材料中扩增出A(约652 bp)、B(约569 bp)及C(无带)3种带型(图2和表3)。其中,扩增出A带型的材料49份,占90.7%;扩增出B带型的材料仅1份,为对照云麦53号;无扩增产物的材料4份,占7.4%。A带型材料的GI均值(41.1%)与B带型材料的GI之间存在极显著差异(P< 0.01);C带型材料的GI均值(38.7%)与B带型材料的GI则存在显著差异(P<0.05);但A带型与C带型材料的GI间无显著差异。A带型材料的GP值(57.5%)与B带型材料的GP值有极显著差异(P<0.01);C带型材料的GP值(53.7%)与B带型材料的GP值间差异显著(P<0.05);A带型材料与C带型材料的GP值间无显著差异。 M:DL2000;1:云0613/XM0905双江铁壳麦;2:云0613(1)双江铁壳麦;3:云0613(2)双江铁壳麦;4:云0614/XM0933耿马铁壳麦;5:云0615/XM0934耿马铁壳麦;6:云0616/XM0932 澜沧铁壳麦;7:云0617/XM0914永德红硬壳麦;8:云0618/XM0921云县铁壳麦;9:云0619/XM0922永德光头铁壳麦;10:云0620/XM0923永德硬壳麦;11:云0621/XM0896云县铁壳麦;12:云0622/XM0897云县铁壳麦;13:云0623/XM0908风庆铁壳麦;14:云0624/XM0909风庆铁壳麦;15:云0370-1黑壳铁壳麦;16:云0612/XM0904双江铁壳麦;17:CK云麦53。 表3 标记 Vp1B3扩增的3种带型及其发芽指数和籽粒发芽率的差异 用标记Vp1A3在51份云南铁壳麦和对照材料中扩增出A(170 bp)、B(约762 bp,目标片段)、C(无带)及D共4种带型(图3),D带型只有1份材料,不列入统计。扩增出A带型的材料15份,占28.8%;扩增出B带型的材料3份(含对照品种),占6.0%;扩增出C带型的材料34份,占 65.4%。A带型材料的GI均值(39.1%)与B带型(25.7%)、C带型材料(44.0%)的GI均值之间无显著差异;但B带型与C带型材料的GI均值存在显著差异(P<0.05)。 M:DL2000;1:云0001/ZM08780腾冲铁壳麦;2:云0003/ZM0910龙陵大河头小麦;3:云0004/ZM0911龙陵长芒大河头小麦;4:云0006/ZM0927临沧铁壳麦;5:云0007/ZM0899双江铁壳麦(2);6:云0008/ZM0900双江铁壳麦(1);7:云0005/ZM0912龙陵顶芒大河头小麦;8:云0009/ZM08806双江铁壳麦<4>;9:云0010/ZM0901双江铁壳麦<3>;10:云0011/ZM08837双江铁壳麦-4;11:云0012/ZM0902双江铁壳麦(6);12:云0013/ZM0903双江铁壳麦(8);13:云0015双江无芒铁壳麦;14:云0016双江长芒铁壳麦;15:云0017/ZM0898双江长芒铁壳麦;16:云0020/ZM0907风庆铁壳麦;17:CK云麦53。下同。 用标记Tamyb10D1(图4)在53份云南铁壳麦和对照材料中可扩增出1 353 bp的目标条带(A)和无带(B)2种带型。其中A带型的材料32份(含对照品种),占59.3%;B带型的22份材料,占40.7%。但2种带型材料的 GI、GP均无显著差异(P<0.05)。 图4 标记 Tamyb10D1扩增的2种PCR片断类型 用标记Tasdr-B1能扩增出650 bp(目标片段)和无带2种带型,2种带型材料的GI和GP间均无显著差异(P<0.05)。用标记Tamyb10D则没扩增到目标片段(1 629 bp)。 由于种子的休眠特性与穗发芽抗性紧密相关,并能解释一半以上的穗发芽抗性变化[2];种子休眠性的强弱可以通过检测种子的发芽指数或发芽率判断,与测定穗发芽率相比,测定种子的发芽指数或发芽率更简便易行,所以大多数研究者都以种子休眠特性代替穗发芽抗性[13,21,24]。但种子发芽率不能真正代表穗发芽抗性。本试验证明了通过种子休眠性鉴定穗发芽抗性的局限性。参试的55份云南铁壳麦的穗发芽率很低,100.0%的材料都表现为高抗穗发芽。但同期收获种子的发芽指数在20.0%及以上,表现为中抗穗发芽至高感穗发芽的材料50份,占参试铁壳麦的90.9%;籽粒发芽率在30.0%以上,休眠性为中等至无休眠的材料52份,占参试铁壳麦的94.5%。用籽粒发芽法获得的穗芽发抗性与用整穗发芽法获得的抗性一致的材料只有10.0%。因此慎用籽粒发芽法来鉴定、筛选高抗穗发芽的材料。 云南铁壳麦的种子有一定的休眠期和极强的休眠性,但其休眠性可能易受种植环境、特别是温度的影响。本研究团队2018年用整粒、半粒发芽法鉴定了来自与本研究试验地块相同、且包括本研究所用55份铁壳麦材料在内的62份种子的休眠性。发现这批种子在收获后30 d的整粒发芽率为0.0%~41.3%,平均16.4%;收获82 d后的整粒发芽率为27.3%~96.7%,平均65.5%,整粒发芽率达80.0%及以上的材料仅18份,占29.0%,约70%的材料仍处于种子休眠期,表明所有材料的种子都有较长的休眠期和极强的休眠性。但本试验中,收获10 d后的籽粒发芽率已达23.3%以上,平均为57.3%,接近2018年收获 82 d后的发芽水平,表明这批种子的休眠性较弱。分析种植地点2018-2019年小麦抽穗、扬花及灌浆成熟期间的气温,发现2019年的温度较2018年同期升高了3 ℃~4 ℃。推测高温可能会降低小麦种子的休眠性,因为在籽粒发育、成熟阶段,母体植株所处的环境温度更温凉时,籽粒的休眠性更强[25-26]。 本研究认为,云南铁壳麦高抗穗发芽的机制主要是颖壳内的浸出物或发芽抑制物单独、或与种子休眠性共同作用的结果,与杨金华等[20]的研究结果基本一致。对究竟是什么物质以及如何抑制穗发芽的发生,还需要进一步深入研究。 杨 燕等[11]、孙晓燕等[12]、白宇皓等[13]和刘光辉等[14]都认为标记Vp1B3是一个与小麦穗发芽抗性相关、能够用于穗发芽抗性辅助选择的分子标记。因为具有Vp1B3基因型、特别是具有抗穗发芽Vp1B3(569 bp)和高抗穗发芽Vp1B3(845 bp)基因型的材料,其发芽指数均值显著或极显著低于具有感穗发芽(652 bp)基因型的材料。但是,能扩增出569 bp条带的材料,其发芽指数也可能较高,如浚麦K8(61.8%)[13]。相反,能扩增出652 bp条带的材料,其发芽指数也可能较低,如本研究中的关215(0.29%)、周麦24(3.71%)和HD2932(4.95%)等。该标记在对照云麦53号中也能扩增出569 bp的条带,但云麦53号的发芽指数高达 65.7%,属于高感穗发芽的品种。另外,53份铁壳麦中,有49份扩增出562 bp条带,但整穗发芽法显示,这些材料都高抗穗发芽。因此,标记Vp1B3不适用于云南铁壳麦穗发芽抗性或种子休眠性的鉴定,与孙果忠等[27]的结果一致。其他4个标记扩增到不同带型材料的发芽指数、发芽率差异均不明显。所以,本研究所用的5个标记均不能解释云南铁壳麦穗发芽抗性的变化。1.3 数据统计分析
2 结果与分析
2.1 供试材料的穗发芽抗性及分级


2.2 参试材料种子的休眠性及分级
2.3 云南铁壳麦抗穗发芽机制分析
2.4 云南铁壳麦穗发芽抗性或种子休眠性的分子特征



3 讨 论

