茶树CsPLK基因的鉴定与表达分析
陈星星 夏莹 黄龙全 张剑韵


摘 要: 茶树中富含茶氨酸、儿茶素和咖啡碱等重要功能成分,具有较高的价值功效,茶树在生命周期中经常遭受逆境胁迫,维生素B6(VB6)在植物体内参与逆境应答,吡哆醛激酶(pyridoxal kinase,PLK)是VB6补救途径中的关键酶。为进一步了解PLK在茶树生物合成中的功能和作用机理,该研究基于茶树基因组数据库,以龙井43为材料,采用逆转录PCR(RT-PCR)的方法从茶树中克隆出CsPLK的基因。结果表明:该基因序列长为1 179 bp,编码393个氨基酸;CsPLK蛋白和已知物种中PLK蛋白具有较高的同源性,都是核糖激酶超家族成员;通过构建pET-CsPLK载体进行原核表达,并鉴定出重组蛋白有很强的催化活性;组织表达特异性分析表明,叶中的表达量比茎、根的高,在根中最低;荧光定量PCR表示,低温诱导CsPLK上调表达,干旱诱导CsPLK下调表达,发现该基因在茶树中有明显的逆境应答,推测CsPLK在茶树的生长发育、逆境胁迫发挥重要作用。
关键词: 茶树, 基因鉴定, 逆境胁迫, 组织特异性
中图分类号: S571.1 文献标识码: A
文章编号: 1000-3142(2020)06-0873-09
开放科学(资源服务)标识码(OSID) :
Abstract: Tea plant is rich in important functional ingredients such as theanine, catechin and caffeine, with high value and efficacy. Tea plants are often subjected to stress in their life cycle, and VB6 is involved in the stress response in plants, Pyridoxal kinase (PLK) is a key enzyme in the vitamin B6 (VB6) salvage pathway. In order to further understand the function and mechanism of PLK in tea plant biosynthesis, this study based on the tea plant genome database, and using longjing 43 as material, the CsPLK gene was cloned from tea plant by reverse transcription polymerase chain reaction (RT-PCR). The results were as follows: The sequence of CsPLK was 1 179 bp in length, encoding 393 amino acids; CsPLK protein and PLK protein of known species had high homology, both were members of the ribokinase superfamily; The pET-CsPLK vector was constructed for prokaryotic expression, and the recombinant protein was identified to have strong catalytic activity, indicating that the gene cloned from tea tree is PL kinase; Tissue expression specificity analysis showed that the expression level in leaves was higher than that in stems and roots, and the lowest in roots; Real-time PCR showed that CsPLK was up-regulated expressed by low temperature and CsPLK was down-regulated by drought. This study reveals that CsPLK had an obvious stress response in tea plants, suggesting that CsPLK played an important role in the growth and development of tea plants and the stress resistance.
Key words: tea plant, gene identification, abiotic stress, tissue specificity
維生素B6(VB6)是一类可以相互转换的吡啶类化合物的总称,包括吡哆醇(pyridoxine,PN)、吡哆胺(pyridoxamine,PM)、吡哆醛(pyridoxal,PL)以及它们相应的磷酸酯形式:磷酸吡哆醇(Pyridoxine-5-phosphate,PNP)、磷酸吡哆胺(Pyridoxamine-5-phosphate,PMP)和磷酸吡哆醛(Pyridoxal-5-phosphate,PLP)。其中PLP是140多种酶的辅酶,涉及广泛的代谢和调节过程(Schulman & Richert,1957;Smolin & Benevenga,1982;Amadasi et al., 2007)。植物是VB6自养型生物,拥有“DXP非依赖途径”(DXP independent pathway),以谷氨酰胺、5-磷酸-核糖(或5-磷酸-核酮糖)和3-磷酸-甘油醛(或磷酸二羟丙酮)为底物,在PDX1和PDX2构成的PLP合酶复合体的作用下,直接从头合成(de novo synthetic)PLP(Julliard & Douce,1991;Franco et al., 2001)。除了VB6的从头合成,植物体内还存在VB6补救途径(salvage pathway)(Tanaka et al., 2005),该途径通过一系列酶的作用,实现不同VB6的相互转化和PLP的补救合成,以及维持VB6状态的稳定。PL激酶(PL kinase,PLK)是PLP的补救合成途径重要的一种酶,PLK在金属阳离子和ATP的存在下催化PL的磷酸化生成PLP。科研人员陆续从拟南芥(Lum et al., 2002)、小麦(Huabo et al., 2004)和油菜(Yu & Luo,2010)克隆出PL激酶基因,开启了从植物中研究PLK基因的热潮。
茶树(Camellia sinensis)是我国重要的经济作物,富含茶氨酸、儿茶素和咖啡碱等重要功能成分。VB6不仅在茶树的初生代谢和功能成分的生物合成过程中发挥重要作用,同时VB6在植物体内参与逆境应答,但目前关于茶树中VB6生物合成鲜有报道。因此,研究茶树中VB6补救途径中的PL激酶在茶树生长发育和逆境调控中的作用具有重要意义。本研究以茶树龙井43的cDNA为模板克隆出PL激酶基因,通过原核表达进行功能验证,并分析不同组织中的基因表达差异,同时设置干旱和低温胁迫分析CsPLK的逆境应答,为利用VB6代谢调控提高茶叶品质和增强茶树抗性的研究奠定基础。
1 材料与方法
1.1 茶树CsPLK的克隆与分析
所用材料为龙井43茶树幼苗,种植于安徽农业大学茶与食品科技学院实验分析平台。
使用全能型植物RNA提取试剂盒(康维世纪),提取茶树叶片、根和茎的总RNA,用Nanodrop ND 1 000检测RNA的浓度与纯度,1.0%凝胶电泳检测RNA 质量。用HifiScript cDNA合成试剂盒(康维世纪)对上述总RNA样本进行反转录获得cDNA。
以拟南芥PLK序列为模板,从中国科学院昆明植物研究所茶树基因组数据库中,通过比对获得候选序列并设计特异性引物,由安徽通用生物公司合成。上游引物:gGAATTCATGTCCGAGAAATTGACA;下游引物:gcTCTAGATTAGTTGTATCTCTCAGCC。下划线部分为EcoR I和Xba I酶切位点。
以上述cDNA为模板,建立扩增体系:Primer Star MIX 酶(TaKaRa 公司)12.5 μL、ddH2O 9.5 μL、cDNA模板1 μL 、上下游引物各1 μL。扩增条件:98 ℃预变性5 min;98 ℃ 10 s,55 ℃ 15 s,72 ℃ 90 s,共35个循环;72 ℃ 10 min。反应结束后用1%琼脂糖凝胶电泳检验PCR产物,分离回收正确的PCR 产物连接载体pEasy-blunt(北京全式金生物有限公司),并转化到大肠杆菌DH5α,命名为pPLK,送至通用生物公司进行测序。
使用ExPASy网站的在线分析工具(http://web.expasy.org/cgi-bin/compute_pi/pi_ tool)分析蛋白质的分子量和等电点;使用DNAMAN进行序列比对分析。
1.2 CsPLK表达载体构建和功能鉴定
使用柱式质粒DNA提取试剂盒(Sangon Biotech)提取转化了CsPLK基因的pPLK菌株的质粒和pET-22b(+)载体质粒,使用限制性内切酶EcoR I和Xba I(TAKARA)于37 ℃分别进行双酶切3 h,使用胶回收试剂盒(Sangon Biotech)回收双酶切之后的目的片段和载体片段,利用T4 DNA连接酶(TAKARA),于16 ℃连接16 h,连接产物转化到Trans T1大肠杆菌中,经菌液PCR验证后送至通用生物公司进行测序。
提取连接上CsPLK基因的pET-22b(+)菌株质粒,转化至Rosetta(DE3)(TransGen)表达菌株中,涂板过夜培养,挑取单菌落进行菌液PCR验证,选择验证正确的菌落加入0.2 mmol·L-1 IPTG,在16 ℃诱导表达24 h→4 ℃、4 000 r·min-1离心10 min→弃去上清,加入PBS重悬→超声波细胞破碎仪,5 s、3 s、破碎99次→4 ℃、12 000 ×g离心10 min,所得上清液即为粗酶液。将含有重组质粒pET-PLK的粗酶液命名为Pro-CsPLK,含有空质粒pET-22b的粗酶液命名为Pro-22b。
采用Lum et al.(2002)的方法,略做改动后测定CsPLK酶活性,反应体系3 mL。向含有0.2 mmol·L-1 PL、0.2 mmol·L-1 ATP和0.1 mmol·L-1 ZnCl2的70 mmol·L-1磷酸钾缓冲液(pH 6.5)中,加入含0.5 mg Pro-CsPLK蛋白,37 ℃水浴反应30 min。添加高氯酸终止反应后12 000 ×g离心10 min,在上清中加入苯肼溶液并定容到3 mL。2.5 min时在410 nm处测定其吸光值为X,同时加入粗酶液和高氯酸的反应管中测定吸光值为Y,(X-Y)为每一组样品的最终吸光值。以Pro-22b代替Pro-CsPLK,其余条件相同,作为空白对照。
1.3 茶树CsPLK表达模式分析
以生长健壮、长势一致的1年生龙井43为材料,取生长在(25±1) ℃、含水率为(55±3)%的茶树幼苗的的嫩根、嫩茎、顶端第2至第3片成熟叶进行组织表达差异性分析。参照Liu(2015)和Lin et al.(2016)的方法进行低温(4 ℃)和干旱处理。调节人工气候室的温度使之维持在(4±1) ℃,实验组与对照组均为生长在温室(25±1) ℃中的茶树幼苗。对照组保持温室(25±1) ℃生长不变,实验组中的茶苗迅速移入低温气候室(4 ℃)中,其他环境条件保持不变,进行低温处理,分别在2、8、12、24、48 h时取茶苗上枝条顶端第2至第3片成熟葉为材料;将茶树幼苗放置在(25±1) ℃的人工气候室中,实验组与对照组土壤含水率为(55±3)%,对照组浇水使土壤含水率维持在(55±3)%,实验组停止浇水,其他环境条件保持一致,进行干旱处理,分别在6、12 d时取样(顶端第2至第3片成熟叶)后,给实验组浇水使其土壤含水率恢复至(55±3)%,在恢复6 d时取样(顶端第2至第3片成熟叶),用于检测CsPLK在干旱胁迫后复水过程的表达模式。每个处理进行3次生物学重复。所有样品液氮速冻后保存于-80 ℃,提取RNA,检测CsPLK的表达模式。
采用荧光定量PCR(Quantitative Real-time PCR,QRT-PCR)测定CsPLK的表达,以GAPDH为内参基因。CsPLK的上游引物为AAGGTTGTCCCTGTTG,下游引物为TTGTGGGTGACGAATA。GAPDH的上游引物为TTGGCATCGTTGAGGGTCT,下游引物为CAGTGGGAACACGGAAAGC。
使用UltraSYBR Mixture荧光定量试剂盒(康维世纪)进行荧光定量PCR,30 μL反应体系由2×ULtraSYBR 15 μL、正向引物1.5 μL、反向引物1.5 μL、cDNA模板1.5 μL、ddH2O 10.5 μL构成,反应程序为95 ℃ 10 min,95 ℃ 15 s,58 ℃ 1 min,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s,30个循环。3次技术重复,用2-ΔΔCT法计算结果。对照组和处理组之间的差异显著性采用t检验进行分析:*表示0.01≤P<0.05 ,* *表示P<0.01。
2 结果与分析
2.1 茶树CsPLK基因的克隆
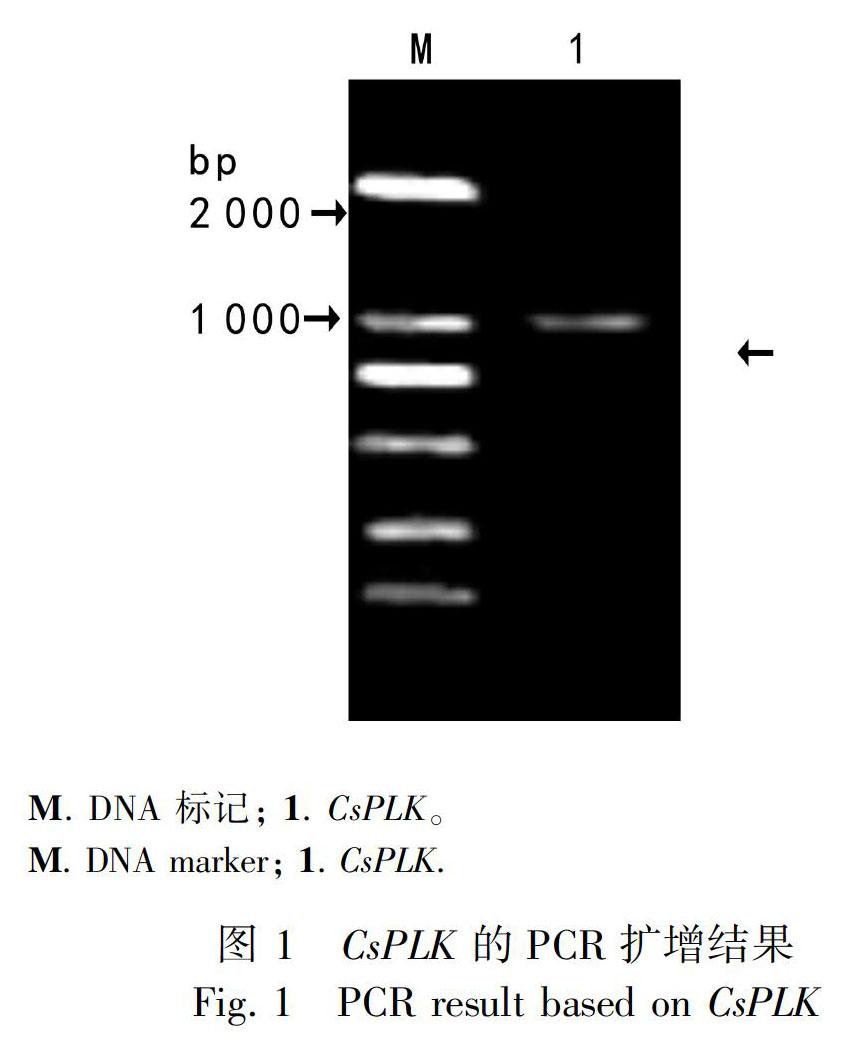
以拟南芥PLK的基因序列(NM_001344222)为模板,在茶树基因组数据库搜索比对得到一条相似性最高(57.86%),且含有完整编码框的基因序列。在NCBI分析该段序列发现第37至第343位氨基酸是吡哆醛激酶功能域,属于核糖激酶超家族。随后设计克隆引物,以茶树总RNA反转录得到的cDNA为模版,PCR扩增得到一条清晰明亮的单一条带,大小约为1 200 bp(图1),测序正确后,将此序列命名为CsPLK,其编码框长1 179 bp,编码含有393个氨基酸残基的蛋白质,蛋白质的分子量为43.9 kDa,理论等电点6.51(图2)。
2.2 茶树CsPLK的序列分析
使用DNAMAN构建CsPLK在原核表达中的图谱(图3)。将CsPLK与其他植物中的PLK进行序列比对(图4)。发现CsPLK与植物的PLK序列具有高度的一致性,与拟南芥(Arabidopsis thaliana)、M. DNA 标记; 1. CsPLK。油菜(Brassica napus)、大豆(Glycine max)、烟草(Nicotiana tabacum)、小麦(Triticum aestivum)和玉米(Zea mays)PLK的一致性分别为77.39%、79.71%、76.23%、82.95%、71.30%和71.59%,有很高的亲缘性。
2.3 CsPLK基因原核表达载体构建
使用EcoR I和Xba I限制性内切酶对含有目的基因的pPLK载体和pET-22b(+)载体进行双酶切(图5)。使用T4连接酶16 ℃连接目的基因与载体片段,转化至Trans T1大肠杆菌中,涂板过夜培养,进行菌落PCR验证,可以看出目的基因成功连接至pET-22b(+)载体上(图6)。
2.4 CsPLK蛋白的诱导表达
采用T7启动子/T7 RNA聚合酶表达系统茶树PLK、拟南芥PLK(26397694)、 油菜PLK(92111351)、大豆PLK(68131817)、烟草PLK(85068609)、小麦PLK(304561310)、玉米PLK(226502934)。图中☆、◇表示两种不同的活性位点;红色划线部分为loopI、loop Ⅱ;黄色方框是GTGD基序。
pET-22b(+)-Rosetta(DE3)对CsPLK在大肠杆菌中进行蛋白表达。在IPTG的诱导下,插入T7启动子后的编码区能够在表达菌株Rosetta(DE3)中被高效转录。原核表达产物经SDS-PAGE凝胶电泳显示,在45 kDa附近成功诱导出了目的蛋白,且在上清中大量表达,与预测蛋白大小一致(图7)。
2.5 CsPLK的酶活测定及部分酶学性质分析
以PL为底物,在pH 6.5和37 ℃条件下,对原核表达的重组茶树PL激酶进行功能鉴定。图8结果显示,pro-CsPLK的酶活力约为4.853 μmol PLP·mg-1·min-1,对照组pro-22b约为0.529 μmol PLP·mg-1·min-1,pro-CsPLK酶活力是对照的9.17倍。这表明CsPLK具有较强的PL激酶活性,原核表达的蛋白确为茶树PLK蛋白。
PL激酶在金属阳离子存在下才能催化反应,pH值是影响酶活性的一个非常重要的因素,所以对PL激酶的最适的金属离子及pH值进行测定。显示该酶的最适pH大约在6.4左右(图9),Zn2+的催化活性最强(图10)。
2.6 CsPLK的组织表达差异性分析
采取荧光定量PCR对茶树根、嫩茎、嫩叶进行分析,结果显示,在茶树叶片组织中CsPLK的表达量最高,茎和根中的表达量相似,约为叶片组织的1/4(图11)。
2.7 逆境条件下CsPLK基因的表达情况
低温胁迫处理48 h过程中,CsPLK表达先上升,在处理8 h时到达顶点后逐渐下调,但仍高于未处理前的水平(图12:a)。干旱胁迫处理后,CsPLK表达量下降,第12天时表达量降到最低,复水后第6天表达量上升,且高于干旱处理前水平(图12:b)。这表明CsPLK参与茶树对低温和干旱胁迫的响应,但其在两种胁迫下表达模式不同。
3 讨论与结论
本研究利用已知的拟南芥PLK的基因序列为模板,在茶树基因组数据库中比对得到一条相似性最高(57.86%)的为候选茶树PLK序列,其编码的氨基酸序列含有一个典型的吡哆醛激酶功能域,属于核糖激酶超家族的成员。利用PCR技术从茶树龙井43中克隆出PLK基因,命名为CsPLK。多序列的同源比对结果表明,CsPLK与拟南芥、烟草、大豆等植物中的PLK氨基酸序列相似性达到70%以上,有很强的亲缘性。CsPLK的Asp151、Tyr161、Gly313和阴离子孔基序GTGD(Gly313-Asp3171)与已经证实的PLK的ATP结合位点完全一致,这几个氨基酸残基高度保守,三个ATP磷酸基团通过由高度保守的序列基序GTGD和附近螺旋N末端形成的阴离子孔以及结合需要的金属阳离子,促进氢键与蛋白质残基互相作用,使PLK活性位点的空间结构更稳定,从而提高PLK活性(Kim & Hong,2016)。科研人员分别对牛(Neary & Diven,1970)、猪(Gao et al., 1998)、羊(Maras et al., 1999)和拟南芥(Lum et al., 2002)的PLK進行酶动力学研究时,得出Zn2+是PLK发挥活性作用的最适金属离子,本研究通过对不同的二价金属离子测定酶活性,发现活化效率依次是Zn2+> Co2+>Mn2+> Mg 2+> Ca2+,得出PL激酶在Zn2+存在下的催化活性最强,与前人结论一致。CsPLK的Ser 68、Thr 103、Tyr143和Asp317与已经验证的与PL形成氢键相互作用的氨基酸残基一致,这些氨基酸残基也高度保守,决定底物特异性(Scholz & Kwok, 1989)。茶树中的CsPLK和其他物种PLK一样具有高度保守的与功能密切相关的loopI和loop Ⅱ结构,CsPLK的loopI结构为Gly155-Val162,与大多数植物和微生物长度一致,为8个氨基酸,而高等动物为12个氨基酸,loopI对防止ATP无效的水解,以及在保护和促进底物结合方面有重要作用,至于不同物种中loopI的氨基酸不同,是否与生物进化有关目前尚不清楚,需要进一步的实验研究;CsPLK的loop Ⅱ区域在植物中高度保守,与酶的底物特异性和底物亲和力有关(Campobasso et al., 2000;Cheng et al., 2002)。
本研究通过构建原核表达载体以及体外酶活测定,得出茶树中的CsPLK在pH为6.4和金属阳离子为Zn2+时有很强的催化活性,催化PL的磷酸化生成PLP,表明原核表达产物为CsPLK蛋白。通过对茶树体内CsPLK的组织差异性分析,发现在茶树的叶、茎、根中均有表达,并且在叶片中表达量最高,推测可能与叶片中含有丰富的叶绿体有关。植物有VB6的从头合成途径, 利用DXP非依赖途径直接合成PLP从而被细胞利用,合成的场所是细胞质, 叶绿体中可能是通过PLP的补救a. 低温胁迫; b.干旱胁迫。
途径来合成PLP,而PL激酶是PLP补救途径中的关建酶,所以PL激酶基因在茶树叶片中的表达量比较高。
越来越多的研究说明植物PLK基因的表达受各种生物或非生物胁迫的影响,从而参与植物的逆境应答,其中拟南芥中的PL激酶基因的表达在冷胁迫下显著增加(Lum et al., 2002),甘蓝型油菜中的PL激酶的表达受低温诱导(Yu & Luo,2010),小麦中的PL激酶基因表达不受渗透胁迫的调节(Huabo et al., 2004)。在本研究中,茶樹CsPLK基因受低温胁迫后能够快速诱导表达,即使在低温处理的48 h后依然高于未处理前表达量;在干旱胁迫下主要表现为抑制,但复水后能够快速诱导植物进行响应,且此期间的CsPLK具有较高的转录水平,干旱后复水响应也是植物抗旱机理研究中重要的内容之一。以上结果表明,茶树中CsPLK与低温、干旱逆境胁迫响应密切相关,同时可以得出CsPLK在不同物种间的逆境应答有明显的差异性。
本研究对茶树中VB6补救合成途径中的CsPLK基因进行了初步的鉴定与表达分析,得出CsPLK参与低温和干旱逆境应答,此研究结果为利用VB6代谢调控来提高茶树抗性从而提高茶树品质的应用研究奠定了基础,也充实了植物抗性生理的研究。后续可通过克隆茶树上VB6补救途径的其他基因来全面研究VB6在茶树逆境应答中的作用。
参考文献:
AMADASI A, BERTOLDI M, CONTESTABILE R, et al., 2007. Pyridoxal 5-phosphate enzymes as targets for therapeutic agents [J]. Curr Med Chem, 14(12): 1291-1324.
CAMPOBASSO N, MATHEWS II, BEGLEY TP, et al., 2000. Crystal structure of 4-methyl-5-beta-hydroxyethylthiazole kinase from Bacillus subtilis at 1.5 A resolution [J]. Biochem, 39(27):7868-7877.
CHENG G, BENNETT EM, BEGLEY TP, et al., 2002. Crystal structure of 4-amino-5-hydroxymethyl-2-methylpyrimidine phosphate kinase from Salmonella typhimurium at 2.3re-solution [J]. Struct, 10(2):225-235.
FRANCO MG, LABER B, HUBER R, et al., 2001. Structural basis for the function of pyridoxine 5′-phosphate synthase [J]. Struct, 9(3):245-253.
GAO ZG, LAU CK, LO SC, et al., 1998. Porcine pyridoxal kinase c-DNA cloning, expression and confirmation of its primary sequence [J]. Int J Biochem Cell Biol, 30(12): 1379-1388.
HAO S, 2013. The qrt-pcr under different stress conditions was suitable for the selection of internal reference genes [D].Nanjing: Nanjing Agricultural University. [郝姗, 2013. 茶树不同逆境条件下QRT-PCR适宜内参基因的筛选 [D]. 南京: 南京农业大学.]
HUA BW, DONG CL, CHUN GL, et al., 2004. The pyridoxal kinase gene TaPdxK from wheat complements vitamin B6 synthesis-defective Escherichia coli [J]. J Plant Physiol, 161(9):1053-1060.
JULLIARD JH, DOUCE R, 1991. Biosynthesis of the thiazole moiety of thiamin (vitamin B1) in higher plant chloroplasts [J]. Proc Int Acad Sci, 88(6):2042-2045.
KIM MI, HONG M, 2016. Crystal structure and catalytic mechanism of pyridoxal kinase from Pseudomonas aeruginosa [J]. Biochem Bioph Res Comm, 478(1):300-306.
LIN ZH, ZHONG QS, SHANG RY, et al., 2016. Expression analysis of cold resistance genes CsCBF1 and CsICE1 in tea plants at low temperature [J]. J Nucl Agric Sci, 30(9):1693-1698. [林郑和, 钟秋生, 单睿阳, 等, 2016. 茶树抗寒基因CsCBF1与CsICE1低温下的表达分析 [J]. 核农学报, 30(9):1693-1698.]
LIU SC, 2015. Physiological and molecular mechanisms of response to drought stress and rehydration of tea plants [D]. Beijing: Chinese Academy of Agricultural Science. [刘声传, 2015. 茶树对干旱胁迫和复水响应的生理、分子機理 [D]. 北京:中国农业科学院.]
LUM HK, KWOK F, LO SC, et al., 2002. Cloning and characterization of Arabidopsis thaliana pyridoxal kinase [J]. Plant, 215: 870-879.
MARAS B, VALIANTE S, ORRU S, et al., 1999. Structure of pyridoxal kinase from sheep brain and role of the tryptophanyl residues [J]. J Protein Chem, 18(3): 259-268.
NEARY JT, DIVEN WF, 1970. Purification, properties, and a possible mechanism for pyridoxal kinase from bovine brain [J]. J Biol Chem, 245(21):5585-5593.
NIU TT, ZHANG JY, HUANG LQ, et al., 2010. Activity analysis of vitamin B6 metabolic enzyme PLK in fresh tea leaves [J]. J Tea Sci, 30(4):269-272. [钮甜甜, 张剑韵, 黄龙全, 2010. 茶树鲜叶中维生素B6代谢酶PLK的活性分析 [J]. 茶叶科学, 30(4):269-272.]
SCHOLZ G, KWOK F, 1989. Brain pyridoxal kinase: Photoaffinity labeling of the substrate-binding site [J]. J Biol Chem, 264(8):4318-4321.
SCHULMAN MP, RICHERT DA, 1957. Heme synthesis in vitamin B6 and pantothenic acid deficiencies [J]. J Biol Chem, 226(1):181-189.
SHI H, ZHU JK, 2002. SOS4, a pyridoxal kinase gene, is required for root hair development in Arabidopsis [J]. Plant Physiol, 129(2):585-593.
SMOLIN LA, BENEVENGA NJ, 1982. Accumulation of homocyst(e)ine in vitamin B6 deficiency: A model for the study of cystathionine beta-synthase deficiency [J]. J Nutr, 112(7):1264-1272.
TANAKA T, TATENO Y, GOJOBORI T, et al., 2005. Evolution of vitamin B6 (pyridoxine) metabolism by gain and loss of genes [J]. Mol Biol Evol, 22(2):243-250.
WANG HB, LIU DC, LIU CG, et al., 2004. The pyridoxal kinase gene TaPdxK from wheat complements vitamin B6 synthesis-defective Escherichia coli [J]. J Plant Physiol, (161): 1053-1060.
YU S, LUO L, 2010. Expression analysis of a novel pyridoxal kinase messenger RNA splice variant, PKL, in oil rape suffering abiotic stress and phytohormones [J]. Acta Biochim Et Biophys Sin, 40(12):1005-1014.
(责任编辑 何永艳)

