人参皂苷Rb1对A β1-42导致的Tau蛋白异常磷酸化的影响
杨淑达,于浩飞,张兰春,李 媛,耿艺娟,张荣平,胡炜彦
昆明医科大学 药学院暨云南省天然药物药理重点实验室,昆明650500
阿尔茨海默病(Alzheimer’s disease,AD),又叫老年性痴呆,是一种中枢神经系统慢性退行性疾病。Tau蛋白过度磷酸化形成的神经原纤维缠结为其特征性病理改变之一。正常人的大脑中微管相关蛋白(protein Tau)与磷酸化微管相关蛋白(P-Tau)处于相对平衡状态,但在AD患者,Tau蛋白处于过度磷酸化状态,参与了神经原纤维缠结(neurofibrillary tangle,NFT)的形成,并且AD病人的痴呆程度与NFT的数目密切相关[1-4]。
人参皂苷是我国传统的名贵中草药材——人参中的一类主要的有效成分,约占4%,研究表明:人参皂苷在调节中枢神经系统功能方面,具有增强记忆和认知功能的作用,是研究中药抗痴呆的热点之一[5-7]。Rb1、Rg1同属于人参皂苷的单体之一,国内外文献对Rb1和Rg1的报道较多,对人参皂苷Rb1在AD微管相关蛋白(Tau)异常磷酸化中的作用有一些报道,但多是针对Aβ25-35诱导的神经元[8-10]或神经干细胞分化过程中[11]Tau蛋白磷酸化的影响,限于细胞水平,对Aβ1-42诱导的组织水平Tau磷酸化的影响却鲜有报道。本实验参照国内外有关文献[12,13],采用Aβ1-42诱导小鼠海马神经元和离体脑片的方法,建立Tau蛋白过度磷酸化的模型,观察人参皂苷Rb1对Aβ1-42所致小鼠海马神经元呵和脑片微管相关蛋白(Tau)异常磷酸化的抑制作用及其可能机制,旨在丰富人参皂苷Rb1抑制β淀粉样蛋白诱导神经元Tau蛋白过度磷酸化的机制研,为含人参皂苷Rb1药物在抗痴呆治疗中的应用提供实验基础。
1 材料
1.1 实验动物
清洁级C57小鼠,雄性10只,雌性E18天孕鼠5只,鼠龄均为8周,由昆明医科大学实验动物学部提供(合格证号:SCXK(滇)-2011004)。
1.2 药物与试剂
人参皂苷Rb1(云南植物药业有限公司,批号:20171201,纯度98.5%),使用前溶于生理盐水配成浓度分别为10、50和250 mg/mL的三种溶液。Aβ1-42(Peptide公司,纯度98%),使用前溶于生理盐水中,配制成1mg/mL溶液待用。Tau[pS202](Thermo公司);Tau[pS199]、Tau[pS396]、Erk1/2、p-Erk1/2和β-actin抗体(SIGMA公司);Tau多克隆抗体(DAKO公司);Tuj1抗体(Abcam公司);荧光二抗(Invitrogen公司);DAPI染色液(碧云天公司)。
2 方法
2.1 离体海马脑片的制备
小鼠用6%水合氯醛麻醉(400 mg/kg),断头,冰上迅速切开头皮,暴露颅骨,取出全脑,置于经95% CO2和5% CO2混合气体饱和的人工脑脊液冰水混合物中,用振动切片机(WPI,Sarasota,FL,USA)行冠状切制海马脑片(厚度350 μm)。海马脑片置盛有95% CO2和5 % CO2混合气体饱和的人工脑脊液中孵育培养(温度32±0.5 ℃)。人工脑脊液成分(mmol/L):(NaCl 126、KCl 2.5、NaH2PO41、CaCl22.5、MgSO41.5、NaHCO326和glucose 10)。
2.2 实验分组和给药
将海马脑片分为模型组、人参皂苷Rb1高、中、低剂量组和试剂空白组,各组脑片分别置盛有95% CO2和5% CO2混合气体饱和的人工脑脊液中孵育培养(温度32±0.5 ℃)1 h后,人参皂苷Rb1高、中、低剂量组分别加入浓度为250、50、10 mmol/L的人参皂苷Rb1,加入等体积生理盐水做试剂空白。继续培养2 h后,模型组和人参皂苷Rb1高、中、低剂量组分别加入Aβ1-42至其浓度达到1 mmol/L。继续培养6 h,取出脑片,做后续检测。
2.3 蛋白表达量测定
2.3.1 蛋白提取
各组脑片取出后,迅速经人工脑脊液清洗后,放入1.5 mL的离心管中,每片加入200 μL的RIPA组织裂解液(已加入蛋白酶及磷酸酶抑制剂)。冰上研磨成组织匀浆,4 ℃离心(15 000 × g,20 min),取上清,测定总蛋白含量。取测定总蛋白浓度后的蛋白提取液样品,加入等体积的2×上样缓冲液(125 mmol/L三羟甲基氨基甲烷(Tris)pH 6.8,质量浓度为10 g/L甘氨酸(glycerol),质量溶度为10 g/L的十二烷基磺酸钠(SDS),质量分数为0.006%溴酚蓝,130 mmol/L二硫苏糖醇(DTT))混匀,在95 ℃沸水中煮5 min,冰上冷却后,-80 ℃储存备用。
2.3.2 总蛋白含量测定
蛋白含量按照BCA试剂盒操作进行测定:1)将50体积的BCA reagent与1体积Cu reagent混合,配置成工作溶液(working reagent,WR);2)用超纯水将标准品BSA(4 000 μg/mL)稀释至2 000、1 000、500、250、125、25 μg/mL;3)将25 μL不同浓度的标准品BSA或待测样品与同体积的WR工作溶液混合;4)37 ℃反应30 min,冷却至室温,混匀,加入96孔培养板(设3个复孔)。562 nm下测定的吸光度,绘制标准曲线并计算总蛋白浓度。
2.3.3 蛋白印迹反应
配置5%浓缩胶(30% acrylamide 1 700 μL,1.0 M Tris(pH 6.8)1 250 μL,10% SDS 100 μL,10% AP 100 μL,TEMED 10 μL,dd H2O 6 800 μL)、10%~12%分离胶(30% acrylamide 3 300 μL,1.5 M Tris(pH 8.8)2 500 μL,10% SDS 100 μL,10% AP 100 μL,TEMED 4 μL,ddH2O 4 000 μL)及电泳缓冲液(Tris 15.1 g,glycine 94 g,SDS 5 g,加入800 mL去离子水溶解后定容至1 L),按预定顺序将30 μg各蛋白样品上入泳道上样;连接电泳装置与电源,调节电压进行电泳分离;将凝胶板置于盛有转膜缓冲液(Tris 5.8 g,glycine 2.9 g,SDS 0.37 g,加入去离子水600 mL溶解,调节PH值至8.3,定容至800 mL后,加入200 mL甲醇)的容器中,安装转膜装置,注满4 ℃预冷的转膜缓冲液,调节电压转膜;洗膜(室温,5 min);室温封闭1 h(封闭液:5%脱脂奶粉用TBST预先配制,并于摇床上震摇均匀);孵一抗(4 ℃,大于8小时);TBST洗膜(室温,3×5 min);孵二抗(室温,60 min);TBST洗膜室温,3×5 min);用ECL显影液显影条带,凝胶成像仪拍照。用anti-β-actin孵育同一张PVDF膜作为内参。用 Quantity One软件对条带进行光密度分析,用目的蛋白与内参蛋白(β-actin)的光密度比值代表目的蛋白的相对含量。
2.4 统计学分析
数据结果均以平均数±标准差表示,数据处理采用one-way ANOVA进行方差分析,P<0.05视为具有显著性统计学差异。
3 结果
3.1 A β1-42诱导对小鼠培养脑片Tau及p-Tau的影响
与空白组比较,模型组Tau蛋白表达无增加(P>0.05),模型组p-Tau表达增加(P<0.01或P<0.05)(见图1)。

图1 A β1-42诱导对小鼠培养脑片Tau及p-Tau的影响
3.2 A β1-42诱导对小鼠培养脑片Erk1/2及p-Erk1/2的影响
与空白组比较,模型组Erk1/2蛋白水平无增加(P>0.05),模型组p-Erk1/2蛋白水平明显增加(P<0.01)(见图2)。

图2 A β1-42诱导对小鼠培养脑片Erk1/2及p-Erk1/2的影响
3.3 人参皂苷Rb1对小鼠培养脑片Tau及p-Tau的影响
小鼠脑片经过Rb1培养后,与空白对照相比,Tau蛋白表达量无明显增加;与模型组相比,人参皂苷Rg1各剂量组Ser199、Ser202、Ser396位点标记 的p-Tau蛋白表达水平均有不同程度减少(P<0.05或P<0.01),人参皂苷Rb1各剂量组之间比较,大剂量组较中、小剂量组更有效降低p-Tau的表达(P<0.05或P<0.01)(见图3)。
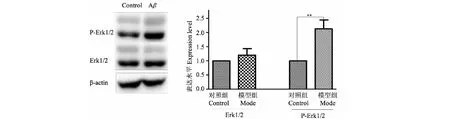
图3 人参皂苷Rb1对AD模型小鼠脑片Tau及p-Tau的影响
3.4 人参皂苷Rb1对小鼠培养脑片Erk1/2及p-Erk1/2的影响
小鼠脑片经过Rb1培养后,与空白对照相比,Erk1/2蛋白表达量无明显增加;与模型组相比,人参皂苷Rb1各剂量组p-Erk1/2蛋白表达水平均有不同程度减少(P<0.05或P<0.01),人参皂苷Rb1各剂量组之间比较,大剂量组较中小剂量组更有效降低p-Erk1/2的蛋白水平(P<0.05或P<0.01)(见图4)。
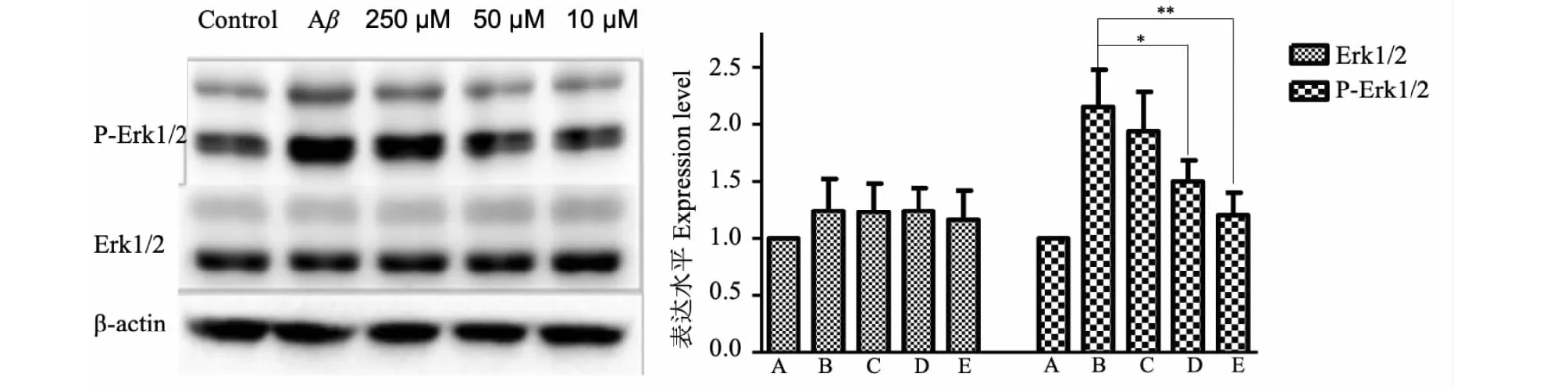
图4 人参皂苷Rb1对AD模型小鼠脑片p-Erk1/2及Erk1/2的影响
3 讨论
老年痴呆(AD)是一种常见的中枢神经系统退行性疾病,严重害老年人健康。由于微管相关蛋白(Tau)过度磷酸化而形成的神经纤维结节(NFT)是AD患者脑内典型病理改变之一。正常的微管相关蛋白(Tau)能促进微管蛋白聚合成微管并增强其稳定性,在神经系统形成和轴突信号传导中起着重要作用,过度磷酸化的Tau丧失了促进微管蛋白聚合的能力,导致神经元微管解体,引起轴浆转运障碍,神经纤维变性。当Tau蛋白去磷酸化后,可使NFT发生松解,释放出的Tau又重新恢复其促微管的活力[14-16]。
Aβ1-42是AD患者脑内引起Tau蛋白磷酸化的主要物质,抑制Aβ1-42引起Tau蛋白磷酸化对AD的预防和治疗有帮助[17,18]。本实验研究发现:Aβ1-42可诱导小鼠脑片Tau蛋白在特异性位点(Ser199、Ser202、Ser396)的磷酸化水平增加(与正常组比较差异具有显著性,P<0.01);而给与不同剂量人参皂苷Rb1处理后,可降低这些特异性位点的Tau蛋白的磷酸化水平(与Aβ1-42组比较差异具有显著性,P<0.05)。我们的部分研究结果(Tau蛋白Ser396位点)与Zhao等[11]在神经干细胞分化过程中的研究结果一致(人参皂苷Rb1可减轻β-淀粉样蛋白25-35诱导的神经干细胞分化过程中Tau蛋白过度磷酸化),与他们的实验不同的是:本实验以小鼠海马脑片为研究对象,观察了三个Tau蛋白的特异性位点,从组织水平说明了人参皂苷Rb1能有效减轻Aβ1-42引起的Tau蛋白不同位点的过度磷酸化,从而减轻NFT的形成;本研究还发现,Aβ1-42引起的Tau蛋白不同特异性位点(Ser199、Ser202、Ser396)磷酸化水平的异常升高随人参皂苷Rb1剂量的增加而降低,表明人参皂苷Rb1对Tau蛋白不同特异性位点磷酸化的抑制作用具有剂量依赖性。
Tau蛋白的磷酸化受蛋白激酶和蛋白磷酸酯酶的调节,许多蛋白激酶如周期蛋白依赖性激酶(CDK)、糖原合成激酶3β(GSK-3β)、丝裂原激活的蛋白激酶(MAPK)都能促使Tau蛋白磷酸化[19-23]。已有研究表明:人参皂苷Rb1可能可以通过激活PI3K、抑制GSK-3β、影响p25/cdk5等减轻Tau蛋白过度磷酸化善作用[8-10]。我们的研究发现:Aβ1-42可使p-Erk1/2蛋白水平明显增加(与正常组比较差异具有显著性,P<0.01),总Erk1/2水平升高未见显著性差异(P>0.05),说明Aβ1-42可能通过激活Erk1/2,诱导Tau 蛋白在特异性位点发生磷酸化;而我们用人参皂苷Rb1(50 μmol/L 和250 μmol/L)预处理后,p-Erk1/2蛋白水平的异常升高得到明显改善(与Aβ1-42组比较差异具有显著性,P<0.05,P<0.01),对总Erk1/2水平的影响未见显著性差异(P>0.05)。本研究还发现,Aβ1-42引起的p-Erk1/2表达水平的异常升高随人参皂苷Rb1剂量的增加而降低,表明人参皂苷Rb1对Erk磷酸化的抑制作用具有剂量依赖性。
我们的研究结果表明:Aβ1-42可通过激活Erk诱导Tau蛋白发生异常磷酸化,人参皂苷Rb1则能剂量依赖性的通过抑制Erk1/2的过度激活降低Tau蛋白的磷酸化水平,使其去磷酸化增多而稳定神经元的微管系统,恢复其功能,进而有可能逆转AD的病理改变,成为用于治疗AD的药物。本研究为人参皂苷Rb1作为AD的治疗的潜在药物研究提供了实验依据,然而对于其具体的作用机制,尚有待于进一步的研究证明。
——水芹主要害虫识别与为害症状

