土壤镉污染对香樟幼苗光合和生理特性的影响*
周际海 程 坤 郜茹茹 段洪浪 濮海燕 金志农
(1.南昌工程学院 江西省退化生态系统修复与流域生态水文重点实验室 南昌 330099; 2.安徽师范大学生命科学学院 重要生物资源保护与利用研究安徽省省级重点实验室 芜湖 241000)
随着工农业集约化发展,大量重金属污染物通过污水灌溉、农药化肥施用、矿产资源开采等方式进入土壤,影响着人类和动植物的生存环境,其中镉(Cd)污染问题尤为突出(曾星等, 2019)。镉易被植物根系吸收,因此较高浓度镉污染对植物体的生长会产生不良影响,主要表现为植物体光合作用降低、叶绿素含量减少、生物量下降、气孔关闭、叶片萎缩、甚至出现死亡等现象(赵秀峰等, 2017; 吕波等, 2018; Zhangetal., 2003; Sandersonetal., 2019)。土壤中镉等重金属不仅限制植物正常生长,还可通过食物链进入人体,危害人体健康,20世纪60年代发生的日本“痛痛病”事件就是典型的镉中毒事件。
土壤重金属污染修复的方法有多种,其中植物修复因投资成本低、无二次污染等诸多优点受到重视。植物修复是利用植物固定、吸收或提取土壤中的重金属,以达到降低其生物有效性或去除污染物的效果(陈顺钰等, 2019)。现已发现许多草本植物,如天蓝遏兰菜(Thlaspicaerulescens)(Bakeretal., 1994)、东南景天(Sedumalfredii)(朱凰榕等, 2019)、三叶鬼针草(Bidenspilosa)(刘沙沙等, 2018)、龙葵(Solanumnigrum)(Yuetal., 2015)和蜈蚣草(Pterisvittata)(杨树深等, 2017)等对Cd具有超富集作用。
香樟(Cinnamomumcamphora)是我国南方主要园林与经济树种,主要用于园林绿化与精油提取等,有较高经济价值。目前,有研究表明香樟对重金属污染物具有一定富集能力(Hoetal., 2014; Zhanetal., 2011),而关于重金属污染土壤中香樟生理生化特征变化的研究却鲜有报道。将香樟用于重金属污染土壤的修复,既可以治理重金属污染,又可提取精油,获得环境和经济双重效益。本研究选取1年生香樟作为供试植物,研究镉对香樟的净光合速率、叶绿素等生理生化特性的影响,为科学评估香樟用于镉污染土壤的生态恢复提供初步的科学依据。
1 材料与方法
1.1 试验材料 0~20 cm土层鲜土采自进贤县江西省红壤研究所。剔除石块及根茬等,自然风干,过2 mm筛后供盆栽用。土壤基本理化性质为: 有机质7.24 g·kg-1,全氮1.58 g·kg-1,全磷0.96 g·kg-1,有效磷128.57 mg·kg-1,总镉0.26 mg·kg-1,pH4.35,饱和含水量42.3%。1年生香樟由南昌工程学院香樟种质资源圃提供,株高28 cm,基径4.12 mm,每株保留3个侧枝。
1.2 试验设计 采用室内盆栽试验,依据中国《土壤环境质量标准》(GB15618—1995),将镉污染浓度分别设置为0(CK)、1 mg·kg-1(Cd1,一级标准值的5倍)、10 mg·kg-1(Cd2,一级标准值的50倍)、30 mg·kg-1(Cd3,一级标准值的150倍),每个处理设5个重复。精确配置2 000 mg·L-1的含Cd2+溶液作为母液,依试验设计,从盆栽底部均匀浇灌于盆中,使土壤镉浓度分别达到相应胁迫浓度,栽种1年生香樟幼苗。按农田常规施肥量N 300 kg·hm-2、P 150 kg·hm-2,将水溶性肥料(N ≥ 30 g·L-1、P2O5≥ 14 g·L-1)稀释后作基肥每盆施用40 mL。盆栽置于光照试验台上,盆的大小为直径15 cm、高24 cm,每盆装土2.5 kg。每周更换盆栽位置,每天称量并浇入去离子水,使盆栽土壤含水量保持在饱和含水量的50%。培养期间光照与黑暗各12 h·d-1(开、关灯时间为7:00、19:00,光照强度200 μmol·m-2s-1),控制室内温度为25~30 ℃,分别于第0、15、30、60天时,采样测定香樟叶片光合作用参数、叶绿素等生理生化指标。
1.3 测定方法 光合作用参数: 采用带有红蓝光源的Li-6400XT型便携式光合测量系统,于采样当天上午9: 00—11: 00,测定距离顶端的第5片叶在饱和光强下的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)等; 测定的饱和光强为1 200 μmol·m-2s-1,流速为500 mL·min-1,CO2浓度为400 μmol·mol-1,叶室温度为28 ℃。叶绿素(Chl)含量测定采用95%乙醇浸提法; 脯氨酸(Pro)含量测定采用酸性茚三酮比色法; 可溶性蛋白含量采用测定考马斯亮蓝G-250比色法; 可溶性糖含量测定采用蒽酮比色法; 超氧化物歧化酶(SOD)活性测定采用氮蓝四唑比色法; 过氧化物酶(POD)活性测定采用愈创木酚比色法; 丙二醛(MDA)含量测定采用硫代巴比妥酸法(李合生, 1999)。
1.4 数据统计分析 试验数据采用Excel 2013进行统计,利用SPSS 19.0进行单因素(One-way ANOVA)方差分析,Origin 9.5进行非线性回归分析并绘图。
2 结果与分析
2.1 镉对香樟叶片光合作用参数的动态影响 由图1可知,香樟叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)和瞬时水分利用效率(WUEi)随着镉胁迫时间的增加,各镉浓度处理的气体交换参数均呈下降趋势,且胁迫后期(30和60天)高浓度镉处理(Cd3)对净光合速率影响较显著。第15天时, Cd1的Pn、Gs、Ci和Tr比对照CK分别增加约4.25%、35.78%、34.71%和24.15%,Cd2的分别增加约4.59%、40.37%、50.04%和11.78%,而Cd3的各项参数(净光合速率除外)均低于CK。第30天时,不同镉浓度的Pn显著降低,且随镉浓度增加逐渐下降,与CK相比,Cd1、Cd2和Cd3的Pn分别下降11.74%、10.48%和20.35%(P<0.05); 不同镉浓度的Gs较CK平均显著降低约21.23%,而不同镉浓度处理间差异不显著; 不同浓度镉处理的Ci均显著低于CK(P<0.05),其中Cd1的Ci最小,降低约12.56%; 不同镉浓度处理均可降低香樟叶片的瞬时水分利用效率WUEi,而增加其气孔限制值Ls。第60天时,不同镉浓度的Pn较CK均有不同程度降低,其中Cd3的Pn显著低于CK约24.32%(P<0.05); Cd1、Cd2和Cd3的Ci分别较CK显著增加约33.49%、41.01%和36.40%(P<0.05); Cd1和Cd2的Tr分别较CK显著增加约33.48%和54.60%(P<0.05); 而各浓度镉处理的WUEi和Ls均低于CK,其中Cd2的最低,分别降低约41.13%和28.47%。整个培养期内各浓度镉处理的Pn、Gs均有下降趋势,但对香樟生长无明显影响。以上结果表明,镉胁迫对香樟光合作用各参数都有一定程度的影响,但香樟对本研究中的镉胁迫均有一定耐性。

图1 不同镉浓度对香樟叶片光合作用参数的影响Fig.1 Effects of different concentrations of cadmium on the photosynthetic characteristics parameters
由图2可知,各处理的净光合速率和气孔导度间呈非线性关系(y=k·ln(x) +yasym,asym代表气孔导度趋向1时的增大净光合速率),净光合速率随气孔导度增加而增加,但存在阈值。由表1可知,曲线回归系数R2、k和yasym的相关关系,不同处理间的净光合速率和气孔导度无显著相关关系,说明本研究香樟的光合参数变化主要与镉胁迫有关。
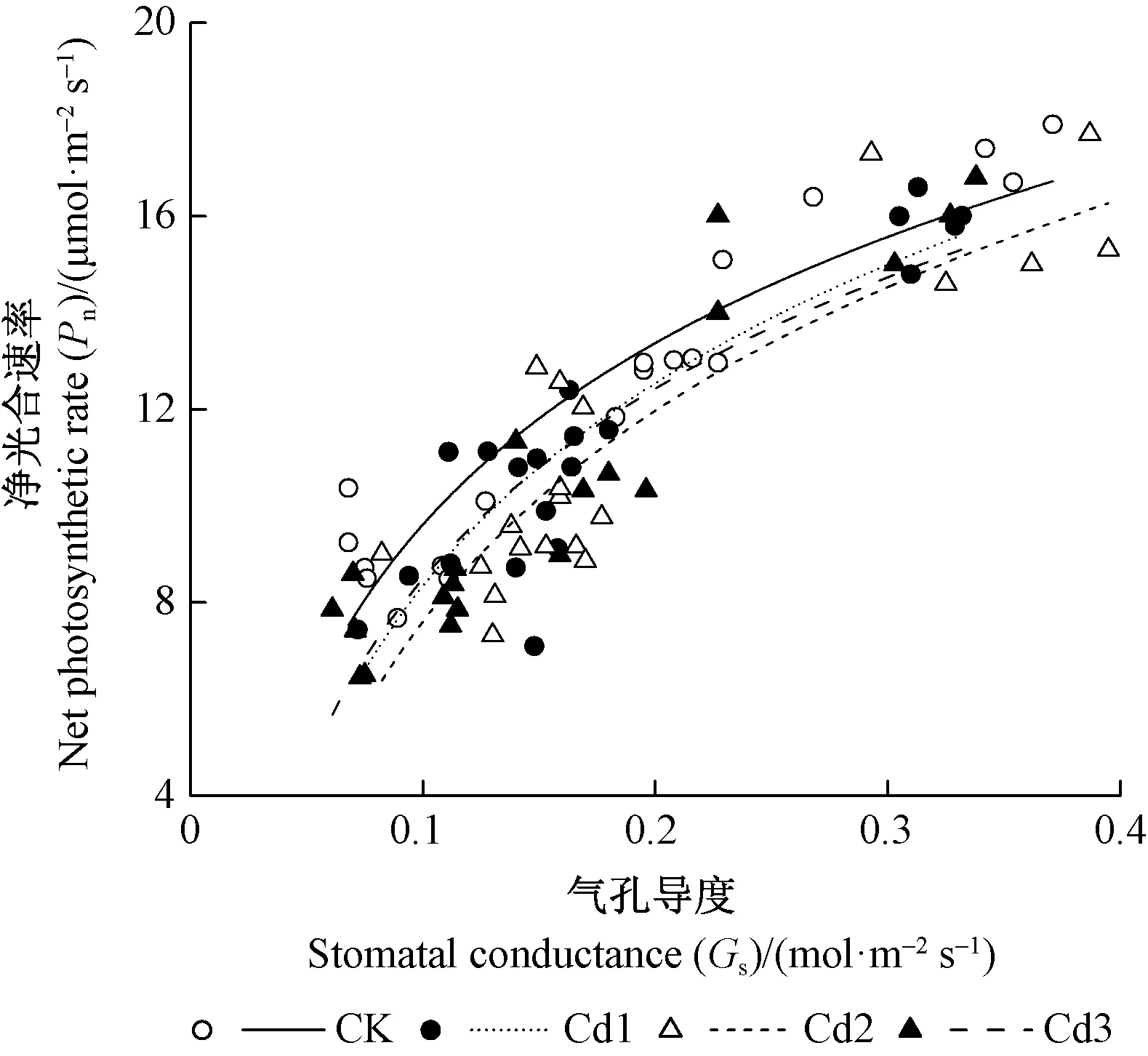
图2 净光合速率与气孔导度关系Fig.2 The relationship between net photosynthetic rate and stomatal conductance

表1 净光合速率与气孔导度间关系特征①Tab.1 Nonlinear regression parameters between net photosynthetic rate and stomatal conductance
2.2 镉对香樟叶绿素含量的影响 由图3可知,随着镉胁迫时间及浓度增加,各类色素和叶绿素a/b并不呈单一的上升或下降趋势。第15天时,Cd1和Cd3的叶绿素a、叶绿素b及叶绿素总量较CK最高分别显著降低约29.96%、33.19%和25.76%,而Cd2的各色素差异不显著。第30天时,镉胁迫下的叶绿素a和总叶绿素含量较CK分别显著降低26.46%和16.72%(P<0.05); 与CK相比,Cd1和Cd2的叶绿素b含量分别降低11.70%和18.72%,而Cd3的显著增加47.65%(P<0.05); Cd3的叶绿素a/b显著低于CK约60.74%,而其他各处理间无显著差异。第60天时,与CK相比,不同浓度镉处理的叶绿素a、叶绿素b和叶绿素总量均不同程度下降,其中Cd3的各类色素含量最低,其叶绿素a、叶绿素b和叶绿素总量分别较CK显著降低31.04%、38.10%和33.37%(P<0.05); 镉胁迫处理对叶绿素a/b无显著影响。以上结果表明,镉胁迫可以影响香樟叶片叶绿素等色素的合成,进而对光合作用产生一定的影响。

图3 不同浓度镉对香樟叶片叶绿素含量的影响Fig.3 Effects of different concentrations of cadmium contaminated on chlorophyll content of C. camphora leaves
2.3 镉对香樟叶片渗透调节物质的影响 随着镉胁迫时间的增加,不同镉浓度处理的脯氨酸含量呈先下降后上升再下降的趋势(表2)。第15天时,Cd1、Cd2和Cd3的脯氨酸含量分别比CK高36.57%、11.41%和65.10%,除Cd2与CK差异不显著外,其他处理间差异显著(P<0.05)。第30天时,Cd1、Cd2和Cd3的脯氨酸含量分别比CK高8.42%、41.23%和54.38%,除Cd1与CK差异不显著外,其他处理间差异显著(P<0.05)。第60天时,Cd3的脯氨酸含量最高,比CK高14.85%(P<0.05),而其他处理与CK间均无显著差异。随着镉胁迫时间的增加,不同浓度镉处理的可溶性糖含量呈上升趋势,且不同处理间存在一定差异(表2)。在整个培养期内,Cd3的可溶性糖含量高于其他处理,比CK高43.74%(P<0.05)。第15天时,除Cd2的可溶性糖含量与CK无显著差异外,其他处理间均有显著差异(P<0.05)。第60天时,Cd1、Cd2和Cd3的可溶性糖含量分别高于CK约26.61%、29.73%和30.27%(P<0.05),其他处理间无显著差异。随着镉胁迫时间的增加,不同浓度镉处理的可溶性蛋白含量呈先下降后上升趋势(表2)。在整个培养期内,Cd2和Cd3的可溶性蛋白含量显著高于Cd1和CK(P<0.05),且Cd2和Cd3间差异不显著。第15天和30天时,Cd2和Cd3的可溶性蛋白含量最高分别高于CK约65.43%和73.15%(P<0.05)。以上结果表明,香樟可以通过调控渗透调节物质的合成来适应镉胁迫环境。

表2 不同浓度镉对香樟叶片渗透调节物质的影响Tab.2 Effects of different concentrations of cadmium on the osmotica of C. camphora leaves
2.4 镉对香樟叶片超氧化物歧化酶、过氧化物酶活性和丙二醛的影响 由图4A可知,随着镉胁迫时间的增加,超氧化物歧化酶(SOD)活性总体呈下降趋势。第15天时,Cd1、Cd2和Cd3的SOD活性显著低于CK(P<0.05)。第30天时,Cd2和Cd3的SOD活性分别高于CK约26.19%和18.53%(P<0.05),而Cd1的则低于CK约4.07%,Cd3与其他处理间差异不显著。第60天时,Cd2和Cd3的SOD活性分别高于CK约21.31%、13.48%(P<0.05),CK与Cd1、Cd2与Cd3间的SOD活性无显著差异。由图4B可知,随着镉胁迫时间的增加,过氧化物酶(POD)活性总体呈上升趋势,且不同处理的SOD活性均表现为Cd3> Cd2> Cd1> CK。第15天时,Cd1、Cd2和Cd3的POD活性分别高于CK约18.33%、28.09%和65.13%(P<0.05),各处理间差异显著。第30天时,Cd1、Cd2和Cd3的POD活性分别高于CK约16.49%、39.18%和44.33%(P<0.05)。第60天时,Cd1、Cd2和Cd3的POD活性分别高于CK约24.94%、29.20%和48.60%(P<0.05)。由图4C可知,整个培养期内Cd2的丙二醛(MDA)含量最高,而CK最低。第15天时,Cd2和Cd3的MDA含量分别高于CK约21.36%和16.94%(P<0.05),但各处理间无显著差异。第30天时,Cd2的MDA含量高于CK约24.21%(P<0.05),其他处理间无显著差异。第60天时,Cd2和Cd3的MDA含量分别高于CK约41.75%和34.38%(P<0.05)。以上结果表明香樟可以通过调控抗氧化系统来适应镉胁迫环境。

图4 不同浓度镉对香樟叶片超氧化物歧化酶 (A)、过氧化物酶活性 (B) 和丙二醛 (C) 的影响Fig.4 Effects of different concentrations of cadmium on the activities of SOD (A), POD (B) and MDA content (C) in C. camphora leaves
3 讨论
3.1 光合作用参数对镉胁迫的响应 光合作用与生产力和产量等密切相关(Zhouetal., 2019)。Cd胁迫可通过影响与光合有关的元素吸收与同化、改变色素含量、干扰叶片气孔开闭行为、影响电子传递等,进而影响植物的光合速率,使植物失绿、黄叶、生长减缓。简敏菲等(2015)研究表明,Cd胁迫下光合气体交换参数(Pn、Gs、Tr和WUEi)随着胁迫时间及Cd浓度的增加表现出下降趋势。本研究发现短时间(15天)镉胁迫对香樟叶片的Pn、Gs和Ci无显著影响,而长时间(30和60天)镉胁迫下的Pn较CK均有不同程度的下降,其中最高浓度镉处理Cd3的净光合速率下降最明显,表明高浓度镉对香樟光合能力的抑制作用更为强烈。净光合速率(Pn)下降主要可分为气孔限制和非气孔限制2种(Adeletal., 2005),而Ci值的高低可作为判断气孔限制和非气孔限制的主要参考依据,Pn、Gs和Ci同时下降可能是气孔限制;Pn、Gs下降,Ci增加则表明可能是非气孔限制所致(祁金洋等, 2018)。本研究Pn随着Gs的增加呈非线性增加且存在阈值,而不同浓度镉处理的Pn和Gs间关系无显著差异。香樟叶片的Pn在镉胁迫后期随镉浓度的增加而降低,这可能是香樟叶绿素含量下降,也可能是因为镉胁迫引起香樟脱落酸含量增加(Kazninaetal., 2014),迫使Gs下降,导致光合作用受到抑制,进而影响Pn和Gs,使其随培养时间及镉浓度的增加逐渐降低。
3.2 镉胁迫对叶绿素合成的影响 叶绿素是植物叶片进行光吸收、光传递和光转化的场所,在一定程度上是反映植物光合能力受环境胁迫程度的重要指标(王怡霖等, 2019)。不同浓度镉处理下香樟叶绿素含量均有不同程度的降低,这与杨叶萍等(2016)研究结果相似。可能是香樟在镉胁迫环境中,吸收了较多Cd2+进入香樟细胞组织内,与叶绿体蛋白质上的羟基配位螯合或与其中的铁、镁等离子发生置换,使叶绿体的形态和基粒结构发生变化,叶绿体功能紊乱,生理机制平衡逐渐被抑制作用代替(Adeletal., 2005),导致叶绿素含量下降。培养期内,Cd1处理的叶绿素含量虽低于对照,但随着镉胁迫时间的增加有逐渐增加趋势,可能是低浓度镉对香樟叶绿素合成的影响程度较弱,香樟逐渐对镉胁迫产生一定的适应性,香樟可通过消耗更多能量或与其他抗氧化酶协同维持机体内的生理代谢平衡。在较长时间高浓度镉胁迫下会导致香樟光合色素及光合作用下降,但是香樟通过调控Pn和Gs等生理特性以适应或降低镉胁迫的影响,增强自我调节机制。
3.3 镉胁迫对香樟叶片渗透调节物质的调控 植物受重金属胁迫时,其生理生化特性可反映植物的应对机制。脯氨酸、可溶性糖和可溶性蛋白作为植物细胞内重要的渗透调节物质,其累积与植物体内过量活性氧自由基的清除及膜脂过氧化伤害的减轻密切相关(张丽萍等, 2016; Batooletal., 2014; Sinishaetal., 2018),在植物逆境胁迫中发挥重要作用。本研究发现,无论高还是低浓度的镉胁迫,香樟幼苗叶片的脯氨酸、可溶性糖含量和可溶性蛋白含量均有一定程度增加,且高浓度镉处理Cd3的各物质含量最高,这与Ali等(2014)研究植物体内可溶性蛋白含量会随镉浓度增加而降低不同,可能与不同镉浓度的变化有关。各调节物质含量的提高可能是在镉胁迫下香樟叶片通过自身的调控机制,如螯合、区化等作用产生更多的脯氨酸、可溶性糖和可溶性蛋白,保持细胞原生质渗透势和膨压,缓解逆境胁迫造成的植株细胞脱水或水分代谢异常,以维持植株的正常生长发育。陈良华等(2017)研究认为,10 mg·kg-1镉处理下脯氨酸含量增加,有利于平衡美洲黑杨(Populusdeltoides)雌、雄株叶肉细胞内的渗透势,减缓叶肉细胞受到的氧化危害。此外,陆秀君等(2008)研究也发现,长时间镉胁迫可诱导刺槐(Robiniapseudoacacia)叶片大量形成脯氨酸、可溶性糖和可溶性蛋白,以提高植物的抗逆性。
3.4 镉胁迫对香樟叶片抗氧化系统的影响 SOD是植物体内酶促防御系统中重要的保护酶之一,有助于将氧自由基团转化为H2O2和O2,减轻自由基对植物体细胞的毒害(胡国涛等, 2016; 杨波等, 2018; Yilmazetal., 2018)。本研究结果表明,镉胁迫前期(15天),不同浓度镉处理的SOD活性低于CK,而在镉胁迫后期,中高浓度镉处理的SOD活性高于低浓度镉处理和CK,由此认为较长时间高浓度镉胁迫会诱导香樟提高SOD活性来清除自由基,以维持香樟正常生长机能。这与汤叶涛等(2010)研究发现滇苦菜(Picrisdivaricata)SOD活性随着镉浓度的增加而提高有类似之处。POD具有去除过氧化氢和酚类等毒性物质的重要功能(张军等, 2018)。POD活性随着镉胁迫时间及镉浓度的增加而增加,可能是受镉胁迫后,更多的镉离子进入香樟组织,使其组织内有毒害作用的H2O2不断累积增加,从而诱导植物体POD活性增加,以抵御外界不良环境。MDA是植物细胞膜脂过氧化物,其含量的高低反映了植物细胞膜结构受损伤的程度(Lluganyetal., 2013)。本研究结果表明,在整个镉胁迫期内,中高浓度镉处理(Cd2和Cd3)的MDA含量高于CK,在胁迫60天时影响最为显著,这与Stoláriková-Vaculíková等(2015)研究结果相似。长时间高浓度镉胁迫对香樟叶片细胞膜系统具有损害作用,而香樟会通过调节体内SOD和POD活性来消除毒害物质,是香樟耐镉的主要机制之一。关于高浓度镉胁迫机制及调节物质的应答机制还有待深入研究。
本研究结果表明,在一定浓度的镉污染土壤中,香樟可通过调控光合作用、抗氧化保护酶系统和渗透调节物质等生理生化过程适应镉污染环境,维持其正常生长。但本研究仅开展了短期(60天)镉胁迫下香樟的生理生化特性研究,可能是一些短期现象,更长时间镉胁迫对香樟的生理生化影响是否相似,有待后期长期深入监测研究,以期为香樟用于重金属污染场地的生态修复提供理论依据。
4 结论
香樟叶片的净光合速率、叶绿素、渗透调节物质、抗氧化酶系统和MDA等生理生化特征对不同浓度镉的响应存在一定差异。短时间内各浓度镉处理香樟叶片的净光合速率(Pn)无明显变化,较长时间镉胁迫会导致Pn降低,且镉浓度越高,叶片的Pn越低。镉胁迫会导致香樟的叶绿素含量出现不同程度的降低,而使香樟叶片的脯氨酸、可溶性糖含量增加,且以高浓度镉处理Cd3最高。培养后期(30和60天),SOD和POD活性显著上升,可减轻逆境对香樟叶片膜系统造成的损伤。香樟在重金属镉胁迫下能保持较好生长,因此香樟对镉具有较强耐性,具备修复重金属污染土壤的潜力。

